从表观遗传学角度看母代运动对子代的健康效应
2022-03-12石海旺
石海旺,段 锐
有性生殖的特征之一是基因信息通过父母双方传递给后代,由于DNA复制过程高度准确,保证了代际间遗传的稳定性[1]。然而,越来越多的研究表明,遗传性状并非完全由基因组序列决定,遗传信息传递的调控机制同样扮演了重要角色[2]。表观遗传调控是影响遗传信息传递主要形式,其通过DNA甲基化、组蛋白修饰以及蛋白间相互作用等影响基因表达,且生理和环境条件的改变可能会通过表观遗传调控影响后代的生长发育[3-4]。如处于1944-1945年荷兰饥荒和1959-1961年我国饥荒时期的妊娠期女性,由于生活环境改变和长期营养不良,导致其后代胰岛素生长因子2的甲基化水平改变,与未经历过饥荒的妊娠期妇女的后代相比,其罹患超重、2型糖尿病等代谢综合征的风险均增加[5-6]。运动作为健康促进的一种形式,母代运动可以改善不良母体环境对胎儿发育的影响,促进子代健康。这是否由于母代运动影响了遗传信息传递的调控呢?本文将从表观遗传学的角度探讨母代运动通过调控妊娠期母亲的代谢健康及宫内环境“重编程”胎儿的生长发育,为母代运动的健康效应和代际遗传提供新的研究思路。
1 表观遗传学简介
DNA是人类和几乎所有生物体的遗传物质,是生物体发育和正常运作必不可少的生物分子。同时,遗传信息通过DNA传递给子代的过程也非常稳定,父母生理环境的改变会引发遗传序列的改变,进而诱导表型产生适应性变化,影响子代的生长发育,其中不当的基因突变会导致遗传疾病的发生。但是,已有研究报道部分后代即使存在可以导致遗传疾病的基因突变,却没有表现出该遗传疾病预期的全部症状[7],表明胎儿的生长发育过程并非完全由DNA序列调控,基于非DNA序列的遗传效应也扮演了重要的角色。Conrad H.Waddington首先提出“表观遗传学”一词来描述生物体与环境间相互作用产生可观察表型特征的过程[8]。随着20世纪80年代后期基因组印迹的发现以及DNA甲基化在哺乳动物发育过程中所起重要作用的阐明,表观遗传修饰的分子过程才逐渐被确定[9]。
2 表观遗传调控的主要分子机制
2.1 DNA甲基化
DNA甲基化的主要生物学后果是基因沉默,主要发生在基因组胞嘧啶-磷酸-鸟嘌呤(CpG)二核苷酸序列中,通过阻止基础转录机制或需要与胞嘧啶相互作用的转录因子的结合,影响核小体的稳定性以及核心组蛋白的访问,从而改变转录因子对启动子区域的激活[10]。甲基转移酶在 DNA 合成过程中复制模板链中存在的甲基化标记,从而确保在细胞分裂周期中遗传特定的表观遗传模式,发挥生物功能[11]。
2.2 组蛋白修饰
组蛋白是赋予染色质结构活力和流动性的主要蛋白质成分,通过包装用于细胞基因调控的DNA区域和影响转录机制,在基因组修饰过程中发挥了重要作用[12]。同时,组蛋白通过其末端尾部的翻译后修饰影响蛋白质的稳定性,多个组蛋白修饰后的累积效应最终决定了基因的转录活性[13]。组蛋白甲基化和乙酰化是其主要的修饰形式。其中,甲基转移酶(HMT)通过催化S-腺苷甲硫氨酸(SAM),将SAM中的甲基添加到组蛋白的赖氨酸和精氨酸残基上,阻止基础转录机制或与胞嘧啶相互作用的转录因子的结合,抑制靶基因的生物功能。去甲基化转移酶(HDMT)可以促进组蛋白中甲基的消除,提高靶基因的表达水平[10]。另外,组蛋白乙酰转移酶(HATs)活性和去乙酰化酶(HDACs)活性的动态平衡是组蛋白乙酰化的调节剂,HAT催化乙酰辅酶A中的乙酰基转移到组蛋白赖氨酸残基上,中和组蛋白的正电荷并减少组蛋白和DNA之间的静电相互作用,将染色质转变为转录活跃状态。相反,组蛋白去乙酰化是通过HDAC将赖氨酸残基上的乙酰基水解,导致异染色质的形成,并降低DNA的转录活性[14]。
3 妊娠期表观遗传的调控因素
在哺乳动物生命周期内,细胞会经历两个主要的全基因组表观遗传重编程事件:配子重编程事件和胚胎重编程事件。其中,配子重编程事件发生在生殖细胞发育过程中的胚胎原始生殖细胞(Primordial germ cell,PGC)时期,当PGC 迁移到生殖嵴后会经历基因组DNA去甲基化、组蛋白修饰和失活X染色体重新激活。而胚胎重编程事件在受精后立即开始,持续到胚胎发育的囊胚阶段[15]。目前已有大量研究发现表观遗传可以调控后代的生长发育,而环境因素会影响体细胞和生殖细胞中特定表观遗传模式的形成和维持,并在配子产生和胚胎发育过程中调控组蛋白修饰[16],改变后代的DNA甲基化水平和后代发育进程[17]。妊娠期是胎儿发育的关键可塑性阶段,在此过程中胎盘是将发育中的胎儿连接到母体环境的中央器官,妊娠环境改变会导致胎盘和宫内胎儿发育产生适应性变化,通过表观遗传调控“重编程”效应影响胎儿的生长。
3.1 孕期母代的代谢健康
长期营养摄入失衡引起的食物能量转化异常是导致代谢综合征的主要原因。在过去几十年,全球肥胖流行导致代谢性疾病患病率急剧增加,表明非遗传环境因素是导致疾病风险的主要原因之一[18]。流行病学数据和动物实验模型证明生命早期是发育可塑性的关键阶段,对成年后的代谢健康至关重要。研究发现我国部分省市妊娠期及备孕妇女超重、肥胖或高血糖发生率接近25%[19],西方国家孕妇肥胖的患病率徘徊在30%左右,其中约40%的妇女在怀孕期间体重增加过多[20]。伴随着育龄期女性超重和肥胖人口数量迅速增加,妊娠期代谢性疾病的发生率显著提高,而妊娠期代谢性疾病是导致后代肥胖和2型糖尿病发生发展的重要因素之一[6, 21]。极端的孕期体重会给母亲带来健康风险,并通过改变相关酶活性或表观遗传底物的可用性影响表观遗传模式,导致后代代谢性疾病的发病率升高。通常妊娠期糖尿病会增加葡萄糖代谢相关基因启动子的DNA甲基化水平,导致子代组织中靶基因的表达降低,影响后代的葡萄糖耐受水平与胰岛素分泌[22]。因此,表观遗传修饰可能是环境诱导的代谢性疾病遗传的潜在分子机制,在后代代谢功能发育过程中起到重要的编程作用。
3.2 妊娠期宫内环境
宫内环境稳态是胎儿发育阶段的重要影响因素。在此过程中,胎盘向胎儿输送营养物质和氧气,同时将外源性环境信号传递给胎儿,影响其在宫内的生长发育过程,保持代际之间的“通讯”,这是胎儿重编程效应的关键步骤(图1)。研究表明,胎盘可以在形态和功能上适应以优化底物供应,在不同发育阶段给胎儿提供特定的代谢底物与相对比例,从而在不利的宫内环境中优化胎儿的生长[23]。
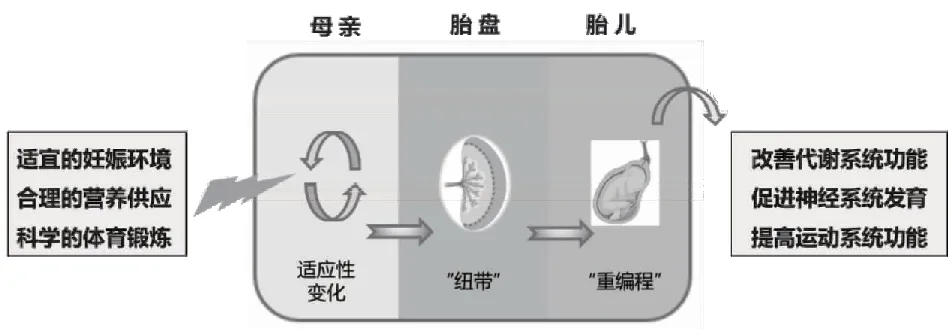
图1 母代通过胎盘与子代保持代际“通讯”效应
胎盘在妊娠期间暴露于各种环境信号中,导致胎盘的结构和功能发生适应性变化。当胎盘-胎儿生长受限时,胎儿基因组将通过胎盘对母体营养物质施加显著的获取驱动力,以维持自身的生长发育[24]。研究表明,在啮齿类动物怀孕前或怀孕期间食物摄入量将减少15%~50%,会导致胎儿和胎盘的平均重量与自由饮食组相比降低22%~26%[25],表明妊娠期间的母代能量摄入对胎盘发育和胎儿生长具有严格的稳态控制。胎儿宫内的生长发育不仅受到母体能量摄入的影响,子宫血流量以及氧气供应同样具有重要作用。研究表明,将动物放置在氧气含量较低的室内会抑制孕期母体胎盘和胎儿的发育[26],其原因可能是由于缺氧使血液过多流向胎盘,导致母体蜕膜滋养细胞侵袭增加,抑制母亲和胎儿之间的气体和营养交换。同时,胎盘除了维持胎儿与母体之间氧气和营养物质的交换外,还通过产生各种脂质激素和细胞因子影响胎儿生长发育过程中的表观遗传调控[27]。因此,宫内胎儿的生长发育对营养物质和氧气含量的变化具有高度敏感性和依赖性,妊娠期间的能量摄入以及血氧丰度可以通过改变宫内环境和胎盘的功能,直接影响胎儿的生长发育进程。
4 母代运动对子代的健康效应
父母的遗传因素、宫内及出生后环境对后代的生长发育具有深远的影响[28]。运动是一种健康且强有力的干预形式,不同时期的母代运动通过调控表观遗传修饰影响子代的生长发育及健康水平,并防止妊娠期并发症对后代健康造成的不利影响[29-30]。近年来,母代运动对子代的健康效应及其遗传学基础逐渐受到研究者的关注,本文通过总结母代运动对子代健康效应的相关研究,系统阐述母代运动通过表观遗传调控对子代的代谢水平、认知功能和运动倾向的影响,为深入研究母代运动对子代的健康效应以及代际间遗传提供一定的理论基础。
4.1 母代运动调控代谢相关基因甲基化水平改善子代代谢系统功能
母亲肥胖或代谢紊乱会通过影响相关酶活性调节卵母细胞的发育,改变表观遗传底物可用性,影响表观遗传模式。运动被认为是治疗肥胖和糖尿病健康有效的干预措施之一。临床研究表明有氧运动可以降低孕妇体重过度增加、妊娠期糖尿病和高血压发生的风险[31]。同时,妊娠期肥胖女性进行中等强度运动可以显著降低新生儿早期肥胖的发生率[32]。胎盘是连接发育中胎儿与母体环境的中央“纽带”,在清除胎儿代谢产物和母胎营养物质传输的过程中发挥了重要作用[26]。研究发现,母代运动会激活胎盘中调节子代生长和代谢系统发育的信号通路,逆转高脂饮食诱导的 5' 腺苷酸活化蛋白酶(Amp-activated protein kinase,AMPK)、蛋白激酶B(Protein kinase B,PKB)、细胞外信号调节激酶(Extracellular signal regulated kinase,ERK)和胰岛素受体底物1(Insulin receptor substrate 1,IRS1)的下调[33],改善孕妇高脂饮食引起的胎盘功能障碍和胎儿的生长发育。
肝脏是全身葡萄糖稳态的主要调节器官,母代运动可改善高脂饮食对肝脏功能的不利影响,减少后代肝细胞中葡萄糖的产生,并上调参与线粒体生物发生和后代肝脏中脂肪酸代谢相关基因的表达,保护后代免受肝脏脂肪变性的影响[28]。最新的研究发现,母代运动通过促进胎盘维生素D受体介导的超氧化物歧化酶3(Superoxide dismutase 3,SOD3)的表达和分泌,激活胎儿肝脏中的AMPK-IDH-αKG-TET信号轴,提高后代葡萄糖代谢相关基因的表达,并改善肝脏功能和葡萄糖耐受水平[30]。此外,棕色脂肪组织是消耗能量和葡萄糖的重要器官之一,提高棕色脂肪水平有望成为肥胖和相关代谢疾病的有效预防手段[34]。研究发现,Prdm16基因启动子DNA去甲基化水平的升高在增强棕色脂肪生成和白色脂肪细胞向棕(米)色脂肪细胞转化的过程中发挥了重要作用,母代运动诱导胎盘Apelin合成和分泌增加,促进Prdm16基因启动子的DNA 去甲基化和胎儿棕色脂肪发育,并抑制高脂饮食诱导的后代肥胖,提高了后代小鼠的产热功能和代谢健康[35]。
综上所述,妊娠期母亲对环境变化的适应与胎儿代谢系统的正常发育息息相关。胎盘是一种运动敏感器官,会随着宫内环境的改变产生适应性变化。运动通过改善胎盘功能,促进胎盘因子的分泌影响表观遗传水平,调控葡萄糖代谢相关基因的表达和棕色脂肪组织的生成,在后代代谢系统的发育过程中起到了重要作用。
4.2 母代运动促进子代神经系统发育提高其认知记忆水平
已有研究报道脑源性神经营养因子(Brain derived neurotrophic factor,BDNF)是大脑可塑性的主要调节剂,除了对中枢神经系统的作用外,还通过减少食物摄入,增加胰岛素作用于机体外周系统的敏感性,将代谢调节相关的中枢与外周循环相互关联[36]。研究表明,短期运动可以增强啮齿类动物海马和皮质尾部区域的BDNF基因表达,同时影响神经生长因子(Nerve growth factor,NGF)、血管内皮生长因子(Vascular endothelial growth factor,VEGF)和成纤维细胞生长因子2(Fibroblast growth factor 2,FGF-2)的水平[37]。此外,运动会提高血液中胰岛素样生长因子(Insulin like growth factor,IGF)透过血脑屏障与IGF-1受体结合并激活相关信号级联反应,抑制神经元和成纤维细胞凋亡[38]。
“胎儿期”是大脑发育的关键阶段,母代运动可以对后代大脑发育产生持久且积极的影响。妊娠期母体营养不良会损害胎儿大脑结构和功能的发育,表现为脑血管化和树突数量减少,引起局部缺氧和炎症损伤,导致后代记忆障碍和认知能力下降[39]。研究发现,妊娠期有氧运动通过提高BDNF水平和海马神经发生,改善后代学习和记忆能力,防止新生儿由于缺血缺氧引起的海马神经元丢失,改善营养不良后代的神经发育延迟,延缓晚年认知功能的下降[40]。同时,妊娠期规律的体育运动与合理的膳食搭配可以调节脑内抗氧化剂的活性,提高线粒体质量和生物发生,调节子代的突触可塑性与学习记忆能力[41]。孕期锻炼引起胎儿海马细胞增殖水平上升,所以后代在成年期表现出整体海马DNA甲基化水平的降低[40],表明母亲规律的身体活动会影响新生儿的海马发育,上调可塑性基因的表达并增强记忆能力。
虽然已有大量的研究表明母代运动可以改善子代的突触可塑性和学习记忆水平,但啮齿类动物实验表明强迫运动(例如跑步机训练、强迫游泳)是一种“强烈的压力源”,可以激活下丘脑-垂体-肾上腺(HPA)轴,引起肾上腺类固醇的释放[42],导致母代运动的积极影响被压力效应降低或抑制。所以,母代运动虽然对后代大脑发育和认知水平具有积极效应,但是要注意运动期间的强度控制,避免由于超量负荷导致的应激反应对胎儿发育产生负面影响,同时结合合理的产后膳食搭配及健康的子代生长环境以促进后代认知学习能力的提高。
4.3 母代运动通过影响子代骨骼肌发育提高其运动能力
规律的运动通过增加线粒体的生物活性、骨骼肌毛细血管密度,提高骨骼肌质量,改善骨骼肌的工作能力[43],表明机体会通过改变能量储备、代谢酶的种类和数量等影响骨骼肌对体力活动的适应。同时,长时间耐力训练后引起的基因表达变化幅度逐渐下降,而差异去甲基化区域数量和参与表观遗传调控的相关蛋白酶的多态性显著增加,以保持相对较低的DNA甲基化水平[44],增强骨骼肌对运动的早期适应。
胎儿时期骨骼肌的生长发育对成年阶段的活动水平与骨骼肌功能具有重要作用。已有研究表明,母亲肥胖或营养不良使宫内胎儿骨骼肌发育受损,线粒体含量和氧化酶活性下降,导致出生后胎儿骨骼肌代谢功能障碍,增加了后代罹患代谢性疾病的风险[45]。AMPK是机体能量代谢的主要调节因子,也是表观遗传修饰的重要介质,其通过上调DNA去甲基化所需的限速辅助因子α-酮戊二酸(α-KG)浓度提高DNA去甲基化水平[46]。研究发现,母代运动可以改善妊娠期母亲肥胖引起的AMPK和α-KG活性下降,促进胎儿肌肉发育过程中的肌源性分化,保护后代免受母亲肥胖导致的骨骼肌功能障碍[29]。
怀孕期间母亲进行日常锻炼可以通过促进胎盘因子的分泌(图2),诱导子代骨骼肌中血管含量和氧化型肌纤维比例增加,有效地提高了子代骨骼肌的疲劳阈值。妊娠期母代运动导致胎盘缺氧,刺激血管内皮细胞增殖分化,提高胎盘迷路区和循环Apelin水平,诱导PGC-1α基因去甲基化水平升高,上调其在胎儿骨骼肌中的表达并促进线粒体生物发生,抑制骨骼肌特异性泛素蛋白酶及肌抑素的表达[29, 47],调节宫内胎儿骨骼肌的生长发育。脂联素(Adiponectin)是一种脂肪细胞来源的激素,其通过促进脂肪酸氧化和胰岛素敏感性,抑制肝脏糖异生,在调节脂质和葡萄糖代谢中发挥了重要作用[48]。母代运动可以促进脂联素分泌和胎盘营养转运正常化,改善由于母代肥胖引起的胎盘胰岛素和mTORC1信号传导抑制引起的胎儿过度生长及出生后的脂肪积累[49],并提高循环Irisin浓度,激活基于绒毛和绒毛外滋养细胞的分化,为胎儿骨骼肌发育提供丰富的营养物质[50],改善后代成年期的骨骼肌健康水平和工作能力。
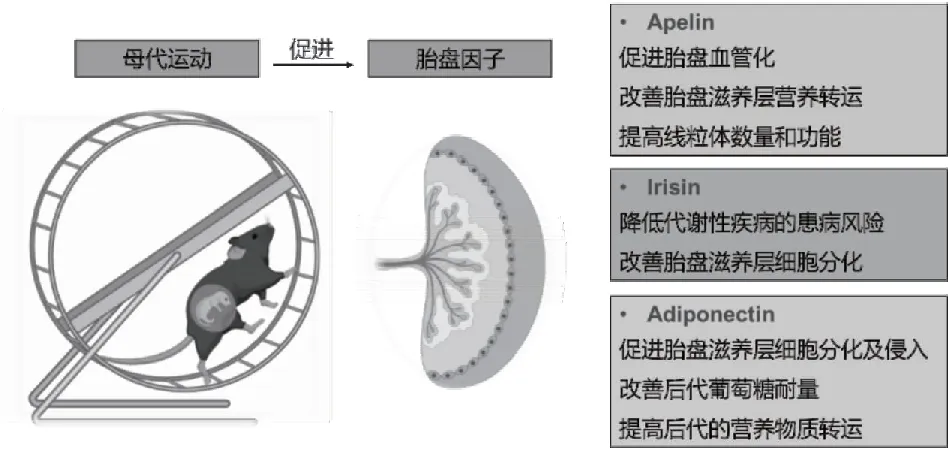
图2 母代运动促进胎盘因子的分泌增加
母亲肥胖或营养不良会增加胎儿出生后骨骼肌代谢功能障碍的风险,影响胎儿骨骼肌的生长发育。母代运动可以通过改善骨骼肌线粒体生物活性和代谢稳态,对其终生身体活动倾向产生积极效应,并且可能对改善由于缺乏身体活动或超重肥胖导致全球范围内的流行病具有重要意义。
5 母代运动对子代健康效应研究的难点及思考
不良的母体环境会直接影响胎儿宫内发育及出生后的身体健康,并作用于后代的整个生命周期。规律的运动对孕产妇和胎儿的积极效应已经得到了广泛的研究,且主要集中于母代运动可以有效的减少孕期孕妇体重增加及妊娠期代谢性疾病的发生,并提高新生儿代谢系统的功能和神经认知水平,降低了先天性疾病风险和青年时期肥胖的发生。但是,由于代际间环境的改变和社会学因素的影响,导致母代运动对子代健康效应可否跨代遗传的相关研究难以开展,且临床试验和长期流行病学调查相对匮乏,使我们对母代运动健康效应的时限性和稳定性知之甚少。此外,不同运动形式、运动强度对表观遗传调控位点的影响是否存在差异也有待进一步探索。因此,我们需要继续研究表观遗传在母代运动对子代健康效应的调控机制,明确表观遗传的调控位点和影响因素,为母代运动改善子代生长发育的相关研究提供更详尽的理论基础,以期为母代运动提供更客观的指导。
6 总结
胎儿的生长发育受遗传调控以及外源性环境的影响。妊娠期是胎儿发育的关键可塑期,胎盘是连接母代健康状况与子代生长发育的关键“纽带”,妊娠期母亲的生活方式以及身体的健康状态都会通过影响胎盘功能以及胎盘因子的分泌,作用于胎儿并产生长期影响。同时,母代运动通过调控表观遗传学变化,增加葡萄糖代谢相关基因以及BDNF启动子区域的去甲基化水平,促进棕色脂肪生成和产热增加,降低后代罹患代谢性疾病的风险并改善后代的神经认知功能。综上所述,母代运动对子代健康的效应是全面且复杂的,我们应该充分把握妊娠阶段这一独特的“窗口期”,开展积极的健康行为,确保孕产妇及后代拥有更健康的生命周期。
