Amide-AlCl3类离子液体催化苯与苯酐酰基化反应
2022-03-11王圆超王桂荣赵新强王延吉
王圆超, 王桂荣, 闫 云, 赵新强, 王延吉
(河北工业大学 化工学院,天津 300130)
苯与苯酐反应是典型的Friedel-Crafts酰基化反应,其产物邻苯甲酰苯甲酸是苯酐法合成蒽醌的中间体,而蒽醌是重要的化工原料,在染料、造纸、农药、医药等行业中应用十分广泛[1-2]。尤其以蒽醌为原料可以合成400多种染料,且随着染料品种及类别的增多,蒽醌的需求量不断增加[3]。

类离子液体又称离子液体类似物,是一类新兴的绿色溶剂,自2002年被发现以来,已在有机催化、材料合成、选择性分离等领域展示出巨大优势[14]。类离子液体不仅拥有与离子液体相似的物化特性,还具有合成简便、原料廉价易得、生物降解性好和环境友好等一系列独特的优点,是一类良好的催化剂与溶剂[15]。其中,金属配位型类离子液体是由金属卤化物和有机配体反应得到的具有金属阴离子、金属阳离子与中性配合物的离子液体类似物[16],并在Friedel-Crafts酰基化反应[17]、烷基化反应[18]和烯烃齐聚反应[19]中表现出了优异的催化性能。笔者对金属配位型类离子液体Amide-AlCl3的合成与表征,及其对苯与苯酐酰基化反应的催化性能及反应机理进行研究,以期为类离子液体催化酰基化反应提供参考。
1 实验部分
1.1 原料和试剂
苯、苯酐,AR,北京百灵威科技有限公司产品;乙酰胺(AcA)、N-甲基乙酰胺(NMA)、N,N-二甲基乙酰胺(DMA)、N,N-二甲基甲酰胺(DMF)、五甲苯(PMB),AR,上海阿拉丁试剂有限公司产品;尿素(Urea),AR,天津市登峰化学品有限公司产品;无水AlCl3,AR,国药集团化学试剂公司产品;二氯甲烷,AR,天津市康科德科技有限公司产品。
1.2 实验方法
1.2.1 Amide-AlCl3类离子液体的制备
DMA-2AlCl3合成方法:将13.34 g AlCl3(0.1 mol)加入到N2保护的三口烧瓶,启动搅拌装置,将4.65 mL DMA(0.05 mol)缓慢滴加到三口烧瓶中,室温下搅拌30 min;然后升至100 ℃后再继续搅拌反应3 h,得到黄色透明的DMA-2AlCl3液体,存放于手套箱中备用。
其他Amide-AlCl3类离子液体DMA-1.8AlCl3、DMA-1.5AlCl3、DMA-1.0AlCl3、NMA-2AlCl3、DMF-2AlCl3、AcA-2AlCl3和Urea-2AlCl3按上述DMA-2AlCl3液体合成方法进行,其对应原料摩尔比分布为:n(AlCl3)∶n(DMA)=1.8∶1,n(AlCl3)∶n(DMA)=1.5∶1,n(AlCl3)∶n(DMA)=1∶1,n(AlCl3)∶n(NMA)=2∶1,n(AlCl3)∶n(DMF)=2∶1,n(AlCl3)∶n(AcA)=2∶1,n(AlCl3)∶n(Urea)=2∶1。
1.2.2 邻苯甲酰苯甲酸的合成
苯与苯酐合成邻苯甲酰苯甲酸(BBA)反应式如式(1)所示。

(1)
合成BBA反应在三口烧瓶中进行。实验步骤为:依次向N2保护的三口瓶中加入苯(0.15 mol)、苯酐(0.025 mol)与类离子液体(0.05 mol);在室温下搅拌10 min,升温至反应温度并反应一定时间。反应结束后冷却至室温,用稀硫酸处理后静置一段时间,收集析出的固体BBA,采用液相色谱进行定量分析。
采用外标法对产物BBA进行定量分析,BBA的收率(y,%)按式(2)计算:
(2)
式中:m1为产物中BBA的质量,g;m0为BBA的理论生成质量,g。
1.3 表征与分析
采用德国Bruker公司生产的VECTOR22型傅里叶红外光谱仪对类离子液体进行基团和结构的分析,仪器分辨率4 cm-1;扫描速率0.2 cm/s;扫描次数10;波数范围4000~400 cm-1。采用英国Renishaw公司生产的inVia Reflex型激光显微拉曼光谱仪,选择可见光波长为532 nm的固体激光作为激光源,对类离子液体进行检测,波数范围300~360 cm-1。采用PerkinElmer公司生产的PerkineLmer Lambda750型紫外分光光度计,在250~550 nm范围扫描,25 ℃下测定紫外-可见吸收光谱,并与Hammett指示剂联用测定不同类离子液体的酸强度。采用515型双泵高效液相色谱仪对产物进行定量分析,紫外光检测波长为254 nm,色谱柱TurnerC18(φ4.6 mm×150 mm),流动相为甲醇-水-冰醋酸(体积比为600∶400∶0.4),流速为0.8 mL/min。
2 结果与讨论
2.1 催化剂的筛选及UV-vis分析
文献[8]表明,氯铝酸离子液体对苯与苯酐酰基化反应的催化效果较好。因此,合成了5种不同酰胺阳离子的氯铝酸类离子液体NMA-2AlCl3、DMA-2AlCl3、DMF-2AlCl3、AcA-2AlCl3和Urea-2AlCl3,并分别用于催化苯与苯酐酰基化反应,其对BBA收率的影响结果如图1所示。由图1可知:5种类离子液体对苯与苯酐酰基化反应都具有较好催化活性,但其阳离子不同时,BBA的收率也略有不同;分别以NMA-2AlCl3、DMA-2AlCl3为催化剂时,BBA收率相对较高;而AcA-2AlCl3、Urea-2AlCl3催化反应时,BBA收率相对较低。
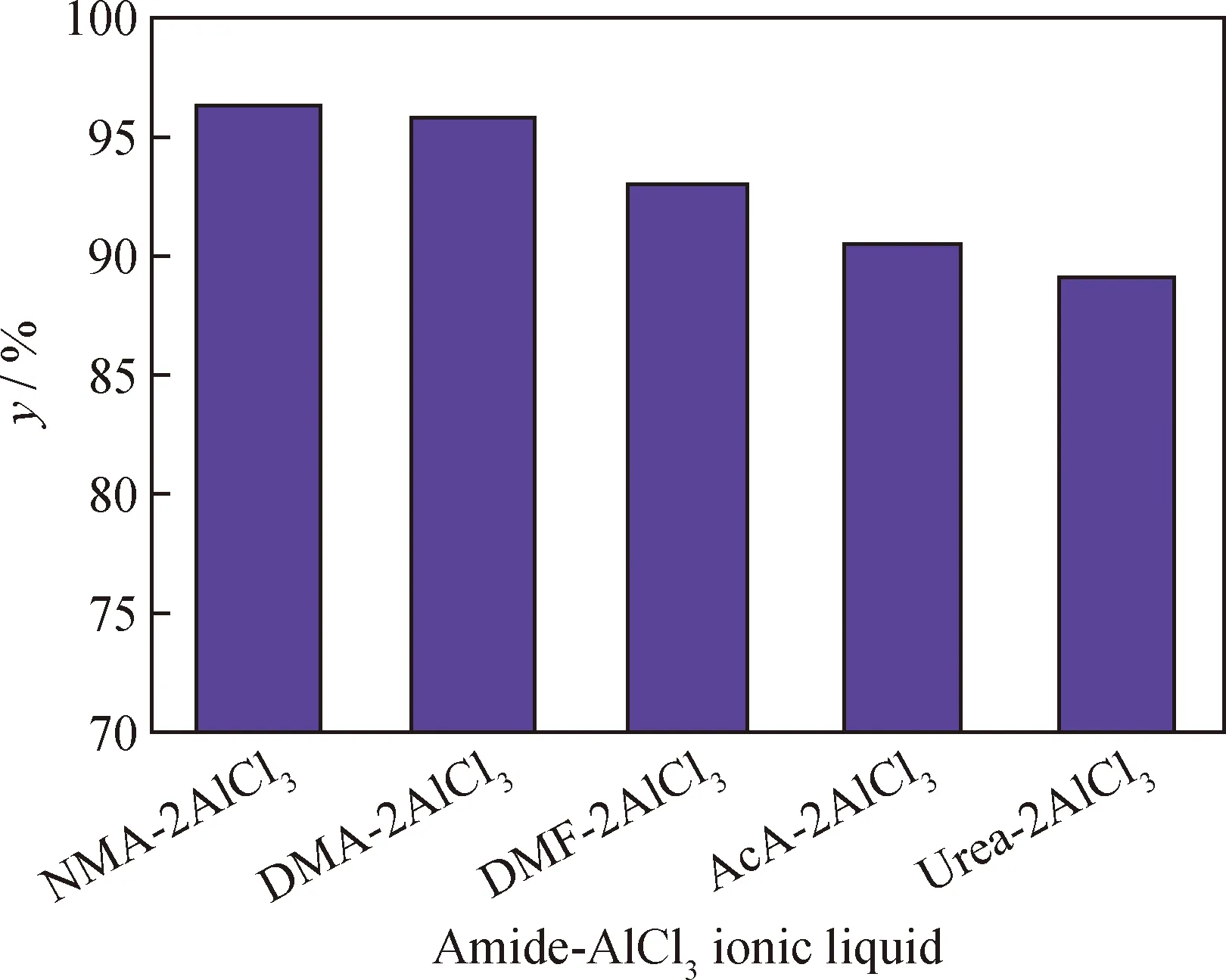
图1 不同Amide-AlCl3类离子液体(ILs)对BBA收率的影响Fig.1 Effect of different Amide-AlCl3ionic liquids on BBA yieldReaction conditions: n(Benzene)∶n(ILs)∶n(PHA)=10∶2∶1;T=40 ℃; t=4 h
不同Amide-AlCl3类离子液体的催化活性不同,可能是因为其酸强度不同导致的。因此,以五甲苯(PMB)为指示剂,二氯甲烷为溶剂,分别配制一定摩尔浓度的类离子液体-五甲苯-二氯甲烷溶液(ILs:0.04 mmol/L; PMB:3.5 mmol/L),并测其紫外吸收光谱,如图2所示。将测得的紫外吸光度数据代入酸强度(H0)函数公式H0=pKa+lg(x([I])/x([IH+]))(pKa—五甲苯指示剂的电解常数(-15.0);x([I])—未被质子化的五甲苯的摩尔分数(以未被质子化的五甲苯的紫外吸光度值在原五甲苯的紫外吸光度值中的占比计),%;x([IH+])—已被质子化的五甲苯的摩尔分数,%)[20-21],计算类离子液体的酸强度H0,结果见表1。

图2 不同Amide-AlCl3与五甲苯(PMB)混合后的紫外-可见吸收光谱图Fig.2 UV-Vis absorption spectra of different amides-AlCl3mixed with pentatoluene (PMB)

表1 不同Amide-AlCl3类离子液体(ILs)的酸强度(H0)Table 1 The acid strength (H0) of different amide-AlCl3 (ILs)
由图2可知,加入类离子液体后的五甲苯指示剂,在271 nm处的紫外吸收强度均比未加入类离子液体时小,说明加入类离子液体后一部分五甲苯发生质子化,形成了IH+,故未被质子化的五甲苯的摩尔浓度降低。分别加入相同物质的量的NMA-2AlCl3、DMA-2AlCl3、DMF-2AlCl3、AcA-2AlCl3及Urea-2AlCl3后,五甲苯的吸收峰强度逐渐增大,说明其未质子化程度不断增大,因此上述类离子液体的酸强度依次减小。
由表1亦可知,5种酰胺类离子液体的酸强度从大到小的顺序依次为NMA-2AlCl3、DMA-2AlCl3、DMF-2AlCl3、AcA-2AlCl3、Urea-2AlCl3。可见,NMA-2AlCl3、DMA-2AlCl3与DMF-2AlCl3的酸强度较大,这是因为NMA、DMA、DMF与AlCl3均是双齿配位,有利于AlCl3的不对称裂分,产生酸性更强的铝离子物种[22],故其催化性能也较好(见图1);而AcA、Urea与AlCl3均为单齿配位,故催化性能略差(见图1)。
鉴于DMA基类离子液体催化合成BBA的收率较高,且DMA毒性小、廉价易得,因此,选择DMA-xAlCl3作为苯与苯酐酰基化反应的催化剂。
2.2 DMA-xAlCl3的合成条件对其催化性能的影响
2.2.1 不同DMA-xAlCl3的催化性能及表征
不同DMA-xAlCl3类离子液体分别用于催化苯与苯酐酰基化反应,其对BBA收率的影响如图3所示。由图3可知:随着DMA-xAlCl3中AlCl3的摩尔比(x)增大,BBA的收率增加;当x=2时,BBA收率达到95.8%;继续增大x,BBA收率变化不大。这可能与x不同时类离子液体的酸强度不同有关,因为氯铝酸类离子液体是典型的可调离子液体,其酸强度可以由AlCl3的含量来调节[23]。

图3 不同AlCl3含量的DMA-xAlCl3对BBA收率的影响Fig.3 Effect of different DMA-xAlCl3 on BBA yieldReaction conditions: n(Benzene)∶n(DMA-xAlCl3)∶n(PHA)=10∶2∶1;T=40 ℃; t=4 h
对不同AlCl3含量的DMA-xAlCl3进行Raman分析,如图4所示。Raman信号峰315 cm-1处归属于[Al2Cl7]-的特征峰[16],350 cm-1处属于[AlCl4]-的特征峰[16]。由图4可知:当x小于2时,类离子液体中存在[AlCl4]-和[Al2Cl7]-2种阴离子,且随着x增大,[AlCl4]-的峰强度逐渐减弱,[Al2Cl7]-的峰强度逐渐增强;当x=2时,[AlCl4]-的特征峰消失,说明此时类离子液体中阴离子几乎只有[Al2Cl7]-。综合文献[22]与上述分析可知:由于酰胺DMA的作用,AlCl3发生不对称裂分,产生分子配合物铝物种[AlCl3·n(DMA)]、阳离子铝物种[AlCl2·n(DMA)]+和阴离子铝物种[AlCl4]-;随着AlCl3含量增多,[AlCl4]-会进一步与AlCl3反应生成[Al2Cl7]-;随着[Al2Cl7]-增多,类离子液体的酸强度也逐渐增大,直至x=2时,[AlCl4]-完全转化为[Al2Cl7]-,此时DMA-2AlCl3的酸强度也最高,且表现出强酸性[23],催化剂活性最高。

图4 不同DMA-xAlCl3的拉曼光谱图Fig.4 Raman spectra of different DMA-xAlCl3
2.2.2 DMA-2AlCl3的合成温度对其催化性能的影响
DMA-2AlCl3用于催化苯与苯酐酰基化反应,其合成温度对其催化性能的影响见图5所示。由图5可知:随着DMA-2AlCl3的合成温度从60 ℃升高至100 ℃,BBA的收率增加;当其合成温度达到100 ℃时,BBA收率达96.6%;再升高其合成温度,BBA收率略有下降。这是由于酰胺与AlCl3合成类离子液体是放热反应,合成温度过高不利于类离子液体的生成。因此,DMA-2AlCl3的较适宜合成温度为100 ℃。

图5 合成温度(Ts)对DMA-2AlCl3催化性能的影响Fig.5 Effect of temperature (Ts) for synthesizing DMA-2AlCl3on its catalytic performanceReaction conditions: n(Benzene)∶n(DMA-2AlCl3)∶n(PHA)=10∶2∶1;T=40 ℃; t=4 h
2.2.3 DMA-2AlCl3的合成时间对其催化性能的影响
DMA-2AlCl3用于催化苯与苯酐酰基化反应,其合成时间对其催化性能的影响见图6所示。由图6 可知:随着DMA-2AlCl3的合成时间由1 h延长至3 h,BBA的收率增加;当其合成时间为3 h时,BBA收率达到97.1%;再延长其合成时间,BBA收率基本不变。这是因为合成类离子液体的时间过短时,AlCl3反应不完全,会有少量固体沉积在三口烧瓶底部或悬浮在类离子液体中,参与合成反应的AlCl3减少,导致类离子液体的酸强度降低,催化活性降低。因此DMA-2AlCl3较适宜的合成时间为3 h。

图6 合成时间(ts)对DMA-2AlCl3催化性能的影响Fig.6 Effect of time (ts) for synthesizing DMA-2AlCl3on its catalytic performanceReaction conditions: n(Benzene)∶n(DMA-2AlCl3)∶n(PHA)=10∶2∶1;T=40 ℃; t=4 h
综上可知,当AlCl3与DMA摩尔比为2,100 ℃下反应3 h时,可以得到具有较高催化活性的类离子液体DMA-2AlCl3。
2.3 苯与苯酐酰基化反应条件优化
2.3.1 苯与苯酐反应温度对BBA收率的影响
DMA-2AlCl3用于催化苯与苯酐酰基化反应,考察反应温度对BBA收率的影响见图7。由图7可知:随着苯与苯酐酰基化反应温度由20 ℃升高至40 ℃,BBA收率增加,当反应温度为40 ℃时,BBA收率达到97.1%;随后再升高反应温度,BBA收率下降。这是因为低温时,升高反应温度,反应速率增大,收率增加;但苯与苯酐酰基化反应是放热反应,温度过高反而不利于BBA的生成,因此,苯与苯酐较适宜的反应温度为40 ℃。

图7 苯与苯酐反应温度(T)对BBA收率的影响Fig.7 Effect of reaction temperature (T) of benzene andphthalic anhydride on BBA yieldReaction conditions: n(Benzene)∶n(DMA-2AlCl3)∶n(PHA)=10∶2∶1;t=4 h
2.3.2 DMA-2AlCl3用量对BBA收率的影响
DMA-2AlCl3用量对BBA收率的影响见图8。由图8可知,随着DMA-2AlCl3用量的增加,BBA的收率增大,当n(DMA-2AlCl3)∶n(PHA)=2∶1时,BBA收率达到97.1%,再增大催化剂DMA-2AlCl3用量,BBA收率基本不变。由于进行酰基化反应时,会有一部分DMA-2AlCl3与酰化试剂苯酐形成配合物,所以DMA-2AlCl3用量不应小于酰化试剂用量。因此,当n(DMA-2AlCl3)∶n(PHA)=2∶1时,催化剂用量较优。

图8 DMA-2AlCl3用量对BBA收率的影响Fig.8 Effect of the amount of DMA-2AlCl3 on BBA yieldReaction conditions: n(Benzene)∶n(PHA)=10∶1; T=40 ℃; t=4 h
2.3.3 苯与苯酐反应时间对BBA收率的影响
DMA-2AlCl3用于催化苯与苯酐酰基化反应,考察反应时间对BBA收率的影响见图9。由图9可知:随着苯酐酰基化反应时间延长,BBA的收率增加;当苯酐酰基化反应5 h时,BBA收率达到最高98.2%,随后再延长反应时间,BBA收率基本不再变化。所以,苯与苯酐适宜的反应时间为5 h。

图9 苯与苯酐反应时间(t)对BBA收率的影响Fig.9 Effect of reaction time (t) of benzene andphthalic anhydride on BBA yieldReaction conditions: n(Benzene)∶n(DMA-2AlCl3)∶n(PHA)=10∶2∶1;T=40 ℃
2.3.4 物料摩尔比对BBA收率的影响
DMA-2AlCl3用于催化苯与苯酐酰基化反应,考察苯与苯酐摩尔比对反应的影响见图10。由图10可知:随着苯与苯酐物料摩尔比的增大,BBA收率增大;当n(Benzene)∶n(PHA)=6∶1时,BBA收率达96.4%;继续增大苯与苯酐摩尔比至n(Benzene)∶n(PHA)=10∶1时,BBA收率增至98.2%,但增幅不大。

图10 物料配比对BBA收率的影响Fig.10 Effect of material ratio on BBA yieldReaction conditions: n(DMA-2AlCl3)∶n(PHA)=2∶1;T=40 ℃; t=5 h
综上可知,当n(Benzene)∶n(DMA-2AlCl3)∶n(PHA)=6∶2∶1、40 ℃、苯与苯酐反应5 h时,BBA收率为96.4%。在n(Benzene)∶n(DMA-2AlCl3)∶n(PHA)=10∶2∶1、40 ℃、苯与苯酐反应5 h时,BBA收率可达到98.2%。
2.4 DMA-2AlCl3催化苯与苯酐酰基化反应机理
2.4.1 DMA-2AlCl3与苯的相互作用分析
分别对外购新鲜苯、新制备类离子液体DMA-2AlCl3及其混合物(苯与DMA-2AlCl3按照n(Benzene)∶n(DMA-2AlCl3)=3∶1的比例混合均匀,在40 ℃下搅拌5 h)进行FT-IR及UV-vis表征,结果如图11和图12所示。

(1) n(Benzene)∶n(DMA-2AlCl3)=3∶1, T=40 ℃;(2) DMA-2AlCl3; (3) Benzene图11 苯、DMA-2AlCl3及其混合物的红外光谱图Fig.11 FT-IR spectra of benzene,DMA-2AlCl3 and their mixture

(1) Benzene; (2) DMA-2AlCl3;(3) n(Benzene)∶n(DMA-2AlCl3)=3∶1, T=40 ℃图12 苯、DMA-2AlCl3及其混合物的紫外光谱图Fig.12 UV-vis spectra of benzene,DMA-2AlCl3 and their mixture
由图11可知,在苯的红外谱图中,1959和1815 cm-1处出现的特征峰归属于苯环C—C弯曲振动,在1479 cm-1处出现的特征峰归属于苯环C—C伸缩振动,在675 cm-1处出现的特征峰是由苯环上C—H面外弯曲振动引起的[24-25]。在DMA-2AlCl3的红外光谱图中,3050、2980 cm-1处出现的振动峰为CH3的对称与反对称伸缩振动峰;1633、1270、1040、521 cm-1处出现的振动峰分别为C=O、C—N、C—C与Al—Cl键的伸缩振动峰[24]。DMA-2AlCl3与苯混合物的红外谱图中,苯环的C—C伸缩振动特征峰由1479 cm-1处向低频位移至1467 cm-1处,这可能是因为DMA-2AlCl3的酸性阳离子物种[AlCl2·n(DMA)]+与苯环产生共轭效应,苯环上的6个C原子周围电子云密度发生变化,伸缩振动力常数减小,导致吸收频率向低频位移[24-25]。另外,由于苯环上电子云密度发生变化,导致C—H面外弯曲振动频率向高频位移[24-25],从675 cm-1处移至692 cm-1处。综上说明DMA-2AlCl3在40 ℃条件下会对苯环π电子产生影响。
由图12可见:苯在255 nm处出现紫外吸收特征峰,此峰与π→π*芳环跃迁有关[26-27];DMA-2AlCl3在305 nm处出现紫外吸收峰,此峰归属于配位O原子与金属Al原子间的电荷跃迁[27-28]。而DMA-2AlCl3与苯的混合物,在255 nm处的吸收强度比苯的有所增强,这可能是DMA-2AlCl3对π电子作用的结果[26-27]。另外,混合物的Al—O紫外吸收峰出现在325 nm处,与DMA-2AlCl3的出现在305 nm处相比,发生了向低频移动。并且在425 nm 处出现1个新峰,这可能是因为DMA-2AlCl3的酸性阳离子物种[AlCl2·n(DMA)]+与苯环的π-环电子相互作用,导致苯环上的π电子被活化[26-27],进而引起紫外吸收峰的变化。
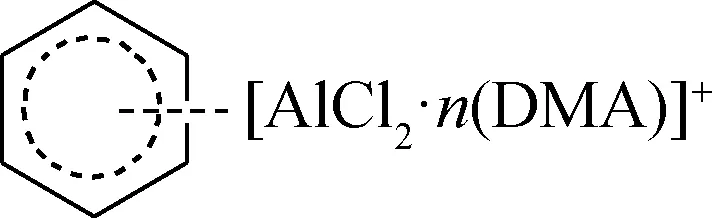
2.4.2 DMA-2AlCl3与苯酐的相互作用分析
对外购新鲜苯酐、新制备DMA-2AlCl3及其混合物(DMA-2AlCl3与苯酐按照n(DMA-2AlCl3)∶n(PHA)=2∶1 的比例混合均匀,在40 ℃下搅拌5 h)进行FT-IR及UV-vis表征,结果见图13和图14。

(1) n(DMA-2AlCl3)∶n(PHA)=2∶1, T=40 ℃;(2) DMA-2AlCl3; (3) Phthalic anhydride图13 DMA-2AlCl3、苯酐及其混合物的红外谱图Fig.13 FT-IR spectra of DMA-2AlCl3,phthalic anhydride and their mixture


(3)


(1) DMA-2AlCl3; (2) n(DMA-2AlCl3)∶n(PHA)=2∶1, T=40 ℃图14 DMA-2AlCl3及其与苯酐混合后的紫外光谱图Fig.14 UV-vis spectra of DMA-2AlCl3 andits mixture with phthalic anhydride

2.4.3 DMA-2AlCl3催化苯与苯酐合成BBA的反应机理
综上分析可知,DMA-2AlCl3中存在酸性阳离子物种与酸性阴离子物种,二者分别与苯或苯酐相互作用,存在协同催化作用;该催化反应遵循碳正离子机理。反应机理如图15所示。

图15 DMA-2AlCl3催化苯与苯酐酰基化反应机理图Fig.15 Mechanism of acylation of benzene and phthalic anhydride catalyzed by DMA-2AlCl3

(2)DMA-2AlCl3的酸性阳离子[AlCl2·n(DMA)]+与苯环的π-环电子相互作用,从而使苯环上的π电子活化,形成(B)。
(3)含酰基正离子的(A)作为亲电试剂进攻(B)中被活化的苯环大π键,并形成σ-配合物(C)。

3 结 论
(1)合成了5种不同阳离子的Amide-AlCl3类离子液体催化剂,其酸强度从大到小顺序为NMA-2AlCl3、DMA-2AlCl3、DMF-2AlCl3、AcA-2AlCl3、Urea-2AlCl3。其中,DMA-2AlCl3具有较高的酸强度及催化活性和较低毒性,是适宜的酰基化反应催化剂。
(2)DMA-xAlCl3是由分子配合物铝物种AlCl3·n(DMA)、阳离子铝物种[AlCl2·n(DMA)]+与阴离子铝物种[AlCl4]-及[Al2Cl7]-构成。在n(AlCl3)∶n(DMA)=2∶1、100 ℃下反应3 h,所合成DMA-2AlCl3的催化性能较好。在n(Benzene)∶n(DMA-2AlCl3)∶n(PHA)=10∶2∶1、40 ℃下反应5 h时,BBA的收率达98.2%。

