牛膝多肽对N-甲基-D-天冬氨酸(NMDA)介导的视网膜光感受器细胞损伤的保护作用△
2022-03-11张芳玲
张芳玲 章 聪 邵 蔚
视网膜色素变性、年龄相关性黄斑变性是可以引起视力损害的常见眼病,它们的共同特点是视网膜光感受器细胞的凋亡,引起视力不可逆性丧失,目前尚无有效的治疗方法。因此,寻找合适的药物预防、阻断或逆转凋亡是治疗此类疾病的关键环节,也是目前研究的热点之一。中医药是中华民族的瑰宝,传统植物中药中不乏具有视网膜保护作用的药物,它们具有多靶点、毒副作用小、协同效果好等优势而被广泛应用于临床研究,并取得一定的效果,牛膝多肽(ABPP)是从传统中药牛膝浸出液中提取的一种活性多肽,何春娇等[1]研究发现,牛膝活性成分对大鼠短时间脑缺血具有保护作用,Peng等[2]发现在体内或体外的帕金森症模型中,ABPP对多巴胺能神经元凋亡具有保护作用,基于以上研究,我们假设ABPP对视网膜光感受器细胞具有保护作用。本研究采用RGC-5细胞系,运用N-甲基-D-天冬氨酸(NMDA)诱导损伤模型,进一步观察ABPP对视网膜感光细胞是否具有保护作用及其存在的可能机制。
1 材料与方法
1.1 材料RGC-5 购自美国ATCC公司,ABPP由南通大学提供。NMDA、地卓西平(MK-801)、四甲基偶氮唑蓝(MTT)、Hoechst 33258、碘化丙啶(PI)(美国Sigma公司),引物(江苏默乐生物科技有限公司),Annexin V-FITC流式检测试剂盒(美国BD公司),逆转录试剂盒(美国GeneCopoeia公司),Fluo-4/AM(美国Sigma公司)。
1.2 方法
1.2.1 RGC-5 培养将RGC-5接种于DMEM 培养液中(体积分数为10%胎牛血清),置于培养箱中培养(体积分数5%CO2、37 ℃),每 2~5 d消化传代1次(使用2.5 g·L-1胰蛋白酶)。
1.2.2 MTT法检测细胞活性将RGC-5以1×105个·mL-1接种在 96孔板培养皿内,待细胞贴壁后将其分为NMDA组、 ABPP组(设定5个不同浓度的亚组)和 MK-801组,同时设立正常组,每组分别设6个复孔。 ABPP组分别加入含 ABPP的完全培养液,使其终浓度分别为 0.05 mg·L-1、0.10 mg·L-1、0.50 mg·L-1、1.00 mg·L-1、5.00 mg·L-1;MK-801组加入含MK-801的完全培养液,使其终浓度为10 μmol·L-1;正常组和NMDA组分别加入等量的完全培养液;置于体积分数5%CO2、37 ℃细胞培养箱内培养10 h。取出后吸净培养液,PBS 冲洗3次。除正常组外,其余各组分别加入NMDA和甘氨酸作用20 min,使他们的终浓度分别为0.10 mmol·L-1和0.01 mmol·L-1,PBS冲洗3次后,放置到原始的培养环境。36 h后,每孔加入新鲜的MTT 20 μL ,使其终浓度为5 g·L-1,持续4 h。离心后,吸净每孔内的液体,每孔添加DMSO 120 μL充分振荡,使沉淀充分溶解。在波长490 nm处用酶标仪检测光密度(D),计算生存率。生存率(%)=(实验组-空白孔)/(正常对照组-空白孔)×100% 。
1.2.3 Hoechst 33258/PI双染检测细胞凋亡将细胞在盖玻片上培养,按上述方法处理后(依据MTT法检测结果,ABPP组选用0.50 mg·L-1药物浓度),分成3组:ABPP组(0.50 mg·L-1)、NMDA组、MK-801组,多聚甲醛(40 g·L-1)固定,PBS洗3次,培养细胞中加入Hoechst 33258染液,使其终浓度为5 mg·L-1。37 ℃条件下避光染色15 min后继续加入PI染液(终浓度15 mg·L-1)。4 ℃条件下避光反应15 min后漂洗封片,荧光显微镜下观察。随机选取6个视野计数,确定细胞凋亡率。细胞凋亡率=凋亡细胞数/总细胞数。
1.2.4 流式细胞仪检测细胞凋亡将细胞培养在6孔板内,用2.5 g·L-1胰蛋白酶消化后收集各组细胞于离心管中,用预冷(4 ℃)的PBS冲洗2次,用250 μL结合缓冲液重新悬浮上述细胞,调节细胞浓度为1×106个·mL-1,取100 μL的上述液体于5 mL流式管中,加入10 μL 20 mg·L-1PI和5 μL Annexin V-FITC的溶液,摇匀后于室温避光静置15 min,然后加入400 μL PBS,最后用流式细胞仪分析。
1.2.5 钙离子内流测定3组细胞接种于96孔板,培养1~2 d。吸去培养液,用PBS洗1次,每孔加入120 μL 内含Fluo-4/AM 的Locke液,调整Fluo-4/AM终浓度为0.005 mmol·L-1。室温下静置30 min。吸去上清,用PBS洗2次,再用Locke液孵育15 min,然后将96孔板放于测定小室内,选择负载良好的细胞,静息状态下用氩激光(激发波长488 nm,吸收波长515~565 nm)对目标细胞扫描3 min,获得基准值。快速加药,向培养孔加入100 μL Locke液(内含NMDA,甘氨酸),持续扫描15 min。钙离子成像观察细胞内钙离子变化,随机选取每个视野的6个细胞作为目标细胞,进行数据分析。
1.2.6 实时荧光定量PCR检测提取各组细胞总RNA(采用Trizol一步法) ,通过逆转录得到 cDNA,以2 μL cDNA为模板,按照实时荧光定量PCR(RT-PCR)试剂盒提供的步骤进行扩增。Bcl-2上 游引物:5’-CTTTGAGTTCGGTGGGGTC-3’,下游引物:5’-CCCAGCCTCCGTTATCCT-3’; Bax 上游引物:5’-GCAAACTGGTGCTCAAGGC-3’,下游引物:5’-GGGGTCCCGAAGTAGGAGA-3’。GAPDH上游引物:5’-CCATGTTCGTCATGGGTGTGAACCA-3’,下游引物:5’-GCCAGTAGAGGCAGGGATGATGTTC-3’,每组实验至少重复检测3次。RT-PCR检测各组细胞Bcl-2、Bax mRNA表达情况。实验结束后,电脑自动分析并自动输出每个cDNA模板标本的Ct值、扩增曲线等参数。利用Ct值进行统计学分析。
1.3 统计学分析采用Stata 18.0统计学软件分析,计量数据用均数±标准差表示,多组间比较采用单因素方差分析,检验水准:α=0.05。
2 结果
2.1 细胞形态学观察正常组RGC-5传代初期有较短的突起,呈单层生长,细胞的边缘较清晰,胞体透亮有光泽,逐渐生长后,突起之间互相接触(图1A)。NMDA组在NMDA损伤30 min后胞体皱缩变圆,透亮度下降,仅极少数细胞保留较短突起(图1B)。MK-801组和ABPP组细胞出现皱缩变形,总体损伤程度较轻,较多仍能维持正常细胞的形态(图1C、 1D)。
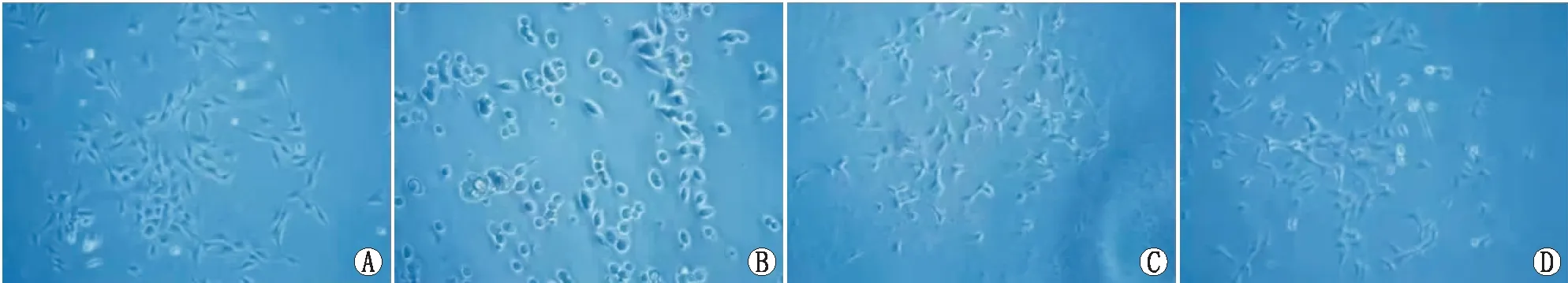
A:正常组;B:NMDA组;C:MK-801组;D:ABPP组。 图1 倒置相差显微镜下细胞形态(×100)
2.2 MTT检测细胞活性MTT检测结果(图2)显示,经NMDA处理20 min后,恢复原始的培养环境24 h,NMDA组细胞生存率较正常组明显下降(P<0.01),ABPP组细胞生存率较NMDA组提高,其中0.10 mg·L-1、0.50 mg·L-1和1.00 mg·L-1ABPP组细胞生存率与NMDA组比较差异均有统计学意义(均为P<0.05),但0.05 mg·L-1和5.00 mg·L-1ABPP组与NMDA组之间细胞生存率差异均无统计学意义(均为P>0.05);与0.10 mg·L-1ABPP组比较,0.50 mg·L-1ABPP组细胞生存率显著升高(P<0.05)。此外,MK-801组细胞生存率也明显高于NMDA组(P<0.05),与0.50 mg·L-1ABPP组比较差异无统计学意义(P>0.05)。因此,在后续的实验中选择0.50 mg·L-1为ABPP组的有效药物浓度。
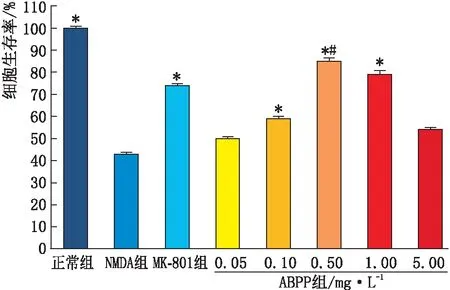
与NMDA组比较,*P<0.05;与0.10 mg·L-1 ABPP组比较,#P<0.05。图2 MTT检测细胞生存率
2.3 Hoechst 33258/PI双染检测细胞凋亡利用荧光显微镜,在紫外光下观察细胞Hoechst 33258染色,存活细胞核形状为椭圆形,发出均质的蓝色荧光,凋亡细胞核发生固缩,发出亮蓝色颗粒块状荧光。在绿光下坏死细胞和晚期凋亡细胞核呈红色。图像叠加后活细胞核呈蓝色,凋亡细胞呈弱红色强蓝色荧光,死亡细胞呈强红色弱蓝色荧光 (图3A)。双染后正常组、NMDA组、ABPP组、MK-801组凋亡细胞百分比分别为(4.80±1.06)%、(39.08±4.54)%、(12.13±1.30)%、(12.96±0.91)%,正常组、ABPP组、MK-801组凋亡细胞百分比与NMDA组比较差异均有统计学意义(均为P<0.05)。
2.4 流式细胞仪检测细胞凋亡流式细胞仪检测结果显示,正常组细胞凋亡率为(5.240±1.076)%,NMDA组细胞凋亡率增加至(37.12±0.96)%,ABPP组和MK-801组细胞凋亡率分别为(13.92±1.54)%和(14.64±1.05)%,正常组、ABPP组、MK-801组细胞凋亡率与NMDA组比较差异均有统计学意义(均为P<0.05)(图3B)。
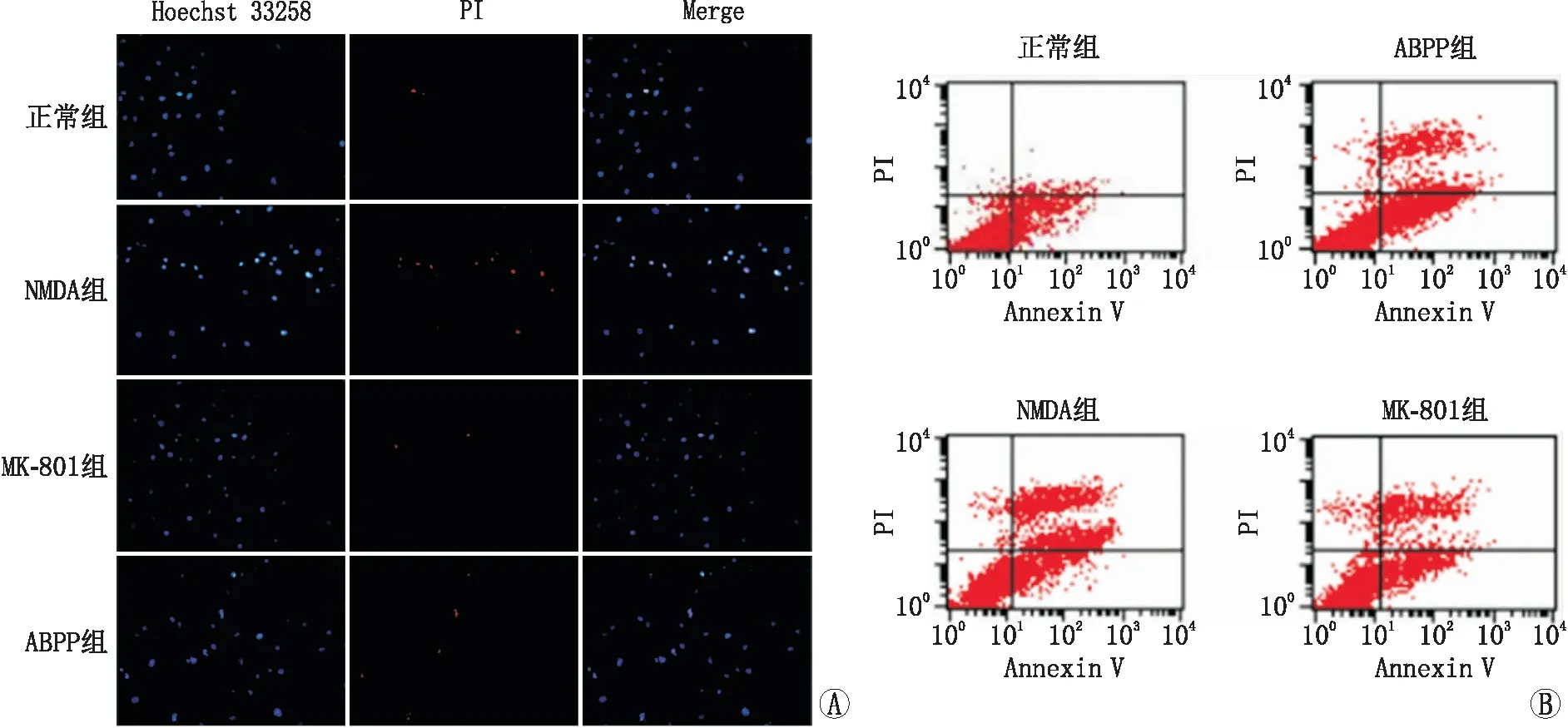
A:各组细胞Hoechst 33258/PI双染;B:流式细胞仪检测各组细胞凋亡。图3 各组细胞凋亡检测结果
2.5 钙离子内流测定NMDA组、ABPP组和MK-801组在加入NMDA前,钙离子荧光强度较低,加入NMDA后细胞内荧光强度迅速增强,NMDA组增加至基线值的(25.448±0.990)倍,ABPP组和MK-801组分别增加至基线值的(2.055±0.404)倍和(3.637±0.272)倍,ABPP组、MK-801组细胞内钙离子荧光强度与NMDA组比较差异均有统计学意义(均为P<0.05) (图4),表明ABPP能有效抑制钙内流。
2.6 RT-PCR检测各组细胞Bcl-2和Bax mRNA表达RT-PCR检测结果显示,Bcl-2和Bax mRNA均参与ABPP对RGC-5的保护作用,与NMDA组比较,ABPP组细胞Bcl-2 mRNA的表达增加,Bax mRNA的表达降低。正常组、ABPP组、MK-801组各组细胞Bcl、Bax mRNA表达与NMDA组比较差异均有统计学意义(均为P<0.05)(图5)。
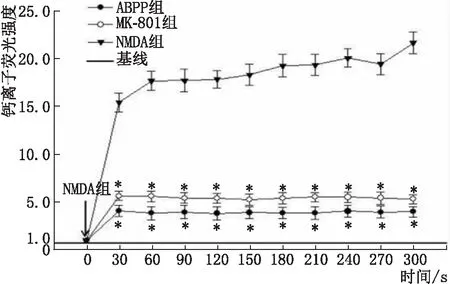
与NMDA组比较,*P<0.05。图4 各组细胞钙离子荧光强度统计学分析

与NMDA组比较,*P<0.05。图5 RT-PCR检测各组细胞Bcl-2、Bax mRNA表达
3 讨论
年龄相关性黄斑变性以及视网膜色素变性等退行性疾病最终引起视网膜感光细胞损伤,造成患者视力受损,甚至失明。在感光细胞退行性改变过程中,细胞的凋亡是此类疾病的主要病理基础。感光细胞损伤后,多种因素可改变细胞生存的微环境,如兴奋性递质的释放和蓄积,钙离子超载、缓激肽、神经营养因子的剥夺和基因异常等,诱导感光细胞发生继发性凋亡,从而引起视力不可逆性损害[3]。在众多继发性凋亡通道中,谷氨酸兴奋性毒性诱导的感光细胞的凋亡日益引起人们的重视,NMDA 受体在此通路中起关键性作用,NMDA受体是Glu受体的一种亚型,在病理状态下,NMDA受体被激活,从而引起光感受器细胞的凋亡,MK-801是一种非竞争性拮抗剂, 它能够阻断 NMDA 受体介导的视网膜细胞钙离子内流,从而促进其功能的恢复,保护视网膜神经元。 但MK-801 有较强的神经毒性, 会诱导急性神经元空泡形成,临床应用时会出现呼吸抑制、升压反射等不良反应,故尚难以应用于临床[4]。
长期以来,RGC-5 被认为来源于大鼠的视网膜细胞,和原代培养的大鼠的RGC生物学行为基本相似[5],近年来其来源引起争议,被认为和661W同源,是一种视网膜感光细胞[6]。很多学者使用RGC-5验证各种因素对感受器细胞的损伤的保护作用[7-8]。因此,我们选择RGC-5检测ABPP 的保护作用, 既可以确切了解ABPP 在体外对视网膜感光细胞的保护作用,又避免了原代培养的感光细胞分离纯化困难等弊端。
中医药是祖国传统医学的宝库,牛膝及其活性成分日益受到人们的重视。牛膝为苋科植物牛膝的干燥根,具有调节免疫、抗炎、抗肿瘤及镇痛等多种药理作用。ABPP是从牛膝浸出液中分离提取出一种活性成分,目前已对其进行了一系列研究,Pan等[9]发现,ABPP通过抑制谷氨酸电流对海马神经元起保护作用;Hu等[10]发现,ABPP的保护作用是通过抑制大鼠海马神经元的NMDA受体实现的。本实验证实,当ABPP达一定浓度(0.10 mg·L-1)时, RGC-5存活率可明显提高, NMDA诱导的细胞凋亡可明显减少,继续增加药物浓度至0.50 mg·L-1、1.00 mg·L-1,保护作用持续存在,当提高到5.00 mg·L-1,不再有保护作用。此结果与Yu等[11]的研究结果基本一致,一般来说药物浓度越高,毒副作用越大,所以,我们选择0.50 mg·L-1为最佳药物浓度,用于后续的实验。
在视网膜组织中,兴奋毒性的主要形式是通过过度刺激谷氨酸受体的NMDA亚型介导的,NMDA受体是合氨酸受体的一种亚型,在病理状态下,NMDA受体被激活,引起细胞内的过量钙内流,从而引起视网膜感光细胞的凋亡[12]。NMDA诱导的细胞损伤与过度刺激NMDA受体引起的钙离子增加成正比[13]。因此,维持适当的钙稳态可能有效地防止NMDA诱导的视网膜感光细胞的进展。本研究结果显示,NMDA刺激RGC-5引起急性和持续的钙离子荧光强度升高。ABPP预保护12 h后再接受NMDA刺激,观察到升高的钙离子荧光强度显著降低。说明ABPP减弱NMDA诱导的钙离子荧光强度升高,从而发挥保护感光细胞的作用。
钙超载是细胞凋亡的始动环节,有学者进行了钙超载后如何激活凋亡下游通路的研究,并发现了一种重要的促凋亡蛋白——钙调神经磷酸酶(CaN)[13]。CaN是一种蛋白磷酸酶,对钙离子高度敏感,并广泛存在于哺乳动物体内,可以被钙离子激活,它又可以激活下游的促凋亡基因Bad。Bad基因是Bcl-2基因家族的凋亡前元件,它可结合并抑制抗凋亡蛋白Bcl-2和Bcl-xL的功能促进细胞凋亡发生。Bcl-2和Bcl-xL是Bcl-2家族的成员,目前已知Bcl-2家族大约有15个成员,既包括抑凋亡基因(Bcl-2、Bcl-l、Bag、Bcl-w等),也包括促凋亡基因(Bax、Bcl-xs、Bak、Bad、Bid等),这两类基因蛋白以异二聚体的形式存在,其存在的状态决定细胞是存活或凋亡。本研究发现,在正常细胞中这两种基因均有表达,NMDA损伤后,Bcl-2 mRNA表达下降,Bax mRNA表达增加,ABPP保护后能逆转这种变化,和Yu等[11]研究结果一致。
本研究利用 NMDA 介导建立视网膜感光细胞的受损模型,并证实其机制与抑制钙内流及上调Bcl-2 mRNA表达、下调Bax mRNA的表达有关,为进一步的体内研究和临床应用提供一定的理论依据。
