细胞骨架相关蛋白 2(CKAP2)在db/db小鼠视网膜组织中的表达及其与HIF-1α/VEGF信号通路的关系△
2022-03-11贺梦霞孟倩丽
贺梦霞 崔 颖 谢 洁 吕 正 孟倩丽
糖尿病是目前威胁人类健康最重要的慢性非传染性疾病[1]。当前我国约有1.16亿糖尿病患者[2],位居全世界首位。糖尿病及其并发症正在严重威胁我国人民的健康及生存质量。糖尿病视网膜病变(DR)作为糖尿病患者最主要的微血管并发症,是全球20~74岁成年人失明及视力受损的主要原因[3]。糖尿病患者中约34.6%合并DR,6.8%合并糖尿病性黄斑水肿[4],严重影响患者的视觉质量。目前,针对严重DR和糖尿病性黄斑水肿的治疗方法主要包括视网膜激光光凝术,玻璃体内注射抗血管内皮生长因子(VEGF)或皮质类固醇药物,玻璃体切割术等[5]。然而,各种治疗方法均存在较多的局限性或并发症,治疗效果并不理想。因此,进一步阐明DR的发病机制,积极探索DR的干预靶点具有重要临床意义。
我们前期通过全外显子组测序和生物信息分析发现,细胞骨架相关蛋白 2(CKAP2)基因在增生型DR患者中的突变频率显著高于不伴有视网膜病变的糖尿病患者[6]。进一步研究发现,CKAP2在增生型DR患者视网膜纤维增殖膜及玻璃体液中的表达显著高于特发性黄斑前膜患者黄斑部视网膜前膜及玻璃体液中的表达水平。体外实验发现,CKAP2在高糖培养下的人视网膜微血管内皮细胞中表达上调[7-8],并与VEGF存在相互作用关系。基于此,本研究拟利用2型糖尿病动物模型,观察CKAP2在db/db小鼠视网膜组织中的表达及分布特点,分析其与缺氧诱导因子1α(HIF-1α)/VEGF信号通路的关系。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组雄性db/db糖尿病小鼠(db/db组)及同窝正常野生型wt/wt小鼠(wt/wt组)各选15只,24周龄,购自江苏集萃药康生物科技有限公司。
1.1.2 试剂及仪器RNA提取试剂、逆转录试剂盒、SYBR®Green Premix Pro Taq HS qPCR Kit 试剂盒(湖南艾科瑞生物工程有限公司),CKAP2、HIF-1α、VEGF、β-actin引物(广州艾基生物技术有限公司),CKAP2抗体(美国Santa Cruz 公司&英国Abcam公司),α-tubulin抗体(美国CST公司),HIF-1α抗体(美国CST公司&美国BD公司),VEGF抗体(英国Abcam公司),正置显微镜(日本Nikon公司),共聚焦显微镜(德国ZEISS公司),实时荧光定量PCR仪(德国Analytik Jena公司),电泳仪(美国BIO-RAD公司)。
1.2 方法
1.2.1 标本采集采用100 g·L-1水合氯醛5 μL·g-1腹腔注射后处死小鼠,摘出眼球。在立体显微镜下从赤道部剪开眼球,去除眼前节,仔细剥取视网膜。
1.2.2 小鼠视网膜石蜡切片制作及HE染色将眼球放入眼球固定液固定48 h后洗涤脱水、浸蜡包埋,制作石蜡切片。切片脱蜡水化后行HE染色,脱水后用中性树胶封片,在正置显微镜下观察拍照。
1.2.3 免疫荧光染色取切片脱蜡水化后置于装有 EDTA 抗原修复缓冲液的修复盒中,于微波炉内进行抗原修复,PBS洗涤后用免疫组化笔画圈,30 g·L-1牛血清白蛋白溶液封闭30 min,滴加一抗(HIF-1α:1800稀释;CKAP2:1100稀释;VEGF:1200稀释)后4 ℃过夜。PBS洗涤后滴加二抗,于室温避光孵育50 min,PBS洗3次,滴加 DAPI 染液,避光室温孵育 10 min。加入自发荧光淬灭剂 5 min,流水冲洗 10 min,抗荧光淬灭封片剂封片,在共聚焦显微镜下观察并拍照。
1.2.4 实时荧光定量PCR检测目的基因表达采用RNA提取试剂提取视网膜组织总RNA,使用Evo M-MLV RT Premix试剂盒逆转录为cDNA。引物序列如下:β-actin引物,正向序列为5’-CCAGCCTTCCTT-CTTGGGTAT-3’、反向序列为5’-GGGTGTAAAACGCAGCTCAG-3’;HIF-1α引物,正向序列为5’-ACCTTCATCGGAAACTCCAAAG-3’、反向序列为5’-CTGTTAGGCTGGGAAAAGTTAGG-3’;CKAP2引物,正向序列为5’-CGGCCTTCCGAGAACAAAGA-3’、反向序列为5’-TGGACCCGATCCTCAGATGT-3’;VEGF-A引物,正向序列为5’-GCACATAGAGAGAATGAGCTTCC-3’、反向序列为5’-CTCCGCTCTGAACAAGGCT-3’。使用SYBR Green 实时荧光定量PCR法扩增cDNA。通过2-ΔΔCt法计算目的基因CKAP2、HIF-1α和VEGF的相对表达量。
1.2.5 Western blot检测目的蛋白表达收集视网膜组织,加入适量裂解液RIPA后研磨,4 ℃裂解15 min,12 000 r·min-14 ℃下离心15 min,提取上清液后采用BCA法测蛋白浓度,97 ℃变性10 min后上样。行SDS-PAGE电泳后转移至PVDF膜。50 g·L-1脱脂奶粉室温封闭60 min,一抗在4 ℃摇床孵育过夜(α-tubulin:11000稀释;HIF-1α:1500稀释;CKAP2:11000稀释;VEGF:11000稀释)。TBST洗3次,二抗在4 ℃摇床孵育2 h,加入ECL发光液暗室曝光显影。采用ImageJ图像处理软件分析结果。
1.3 统计学分析采用SPSS 25.0软件及 Graphpad Prism 8 软件进行数据统计和绘图,实验数据以均数±标准差表示,两组间比较均采用独立样本t检验。检验水准:α=0.05。
2 结果
2.1 两组小鼠体重及血糖情况wt/wt组小鼠体重为(30.43±0.70)g,db/db组小鼠体重为(47.42±0.39)g,两组比较差异有统计学意义(P<0.05)。db/db组小鼠随机血糖均大于33.3 mmol·L-1,wt/wt 组小鼠随机血糖均正常。
2.2 两组小鼠视网膜组织HE染色结果与wt/wt组相比,db/db组小鼠视网膜神经纤维层断裂,各层细胞排列紊乱,内核层及外核层变薄、细胞密度减少(图1)。
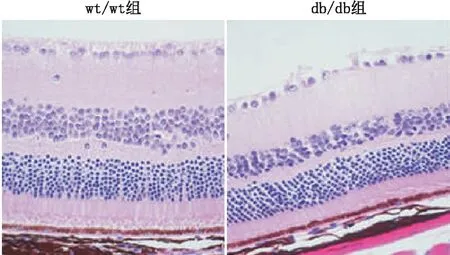
图1 两组小鼠视网膜组织HE染色结果(×400)
2.3 两组小鼠视网膜组织中CKAP2、HIF-1α和VEGF mRNA的表达实时荧光定量PCR结果显示,db/db组小鼠视网膜组织中CKAP2 mRNA相对表达量为2.27±0.74,HIF-1α 为2.68±0.21,VEGF为2.12±0.61,均显著高于wt/wt组(均为P<0.05)。
2.4 两组小鼠视网膜组织中CKAP2、HIF-1α和VEGF 蛋白的表达Western blot检测结果显示,db/db组小鼠视网膜组织中CKAP2、HIF-1α和VEGF的蛋白表达量均显著高于wt/wt组(均为P<0.05)(图2)。
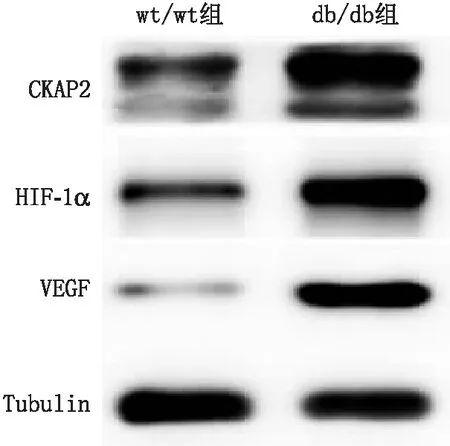
图2 两组小鼠视网膜组织中CKAP2、HIF-1α和VEGF的蛋白表达情况
2.5 两组小鼠视网膜组织中CKAP2、HIF-1α和VEGF的定位与共表达免疫荧光染色结果显示,与wt/wt组相比, db/db组小鼠视网膜组织CKAP2、HIF-1α和VEGF表达的荧光强度较高,且三者主要分布在内层视网膜。免疫荧光双染显示,db/db组小鼠视网膜组织CKAP2与HIF-1α、CKAP2与VEGF、HIF-1α与VEGF存在一定程度的共表达,提示CKAP2在糖尿病小鼠视网膜组织中的表达可能与HIF-1α/VEGF通路有关(图3)。
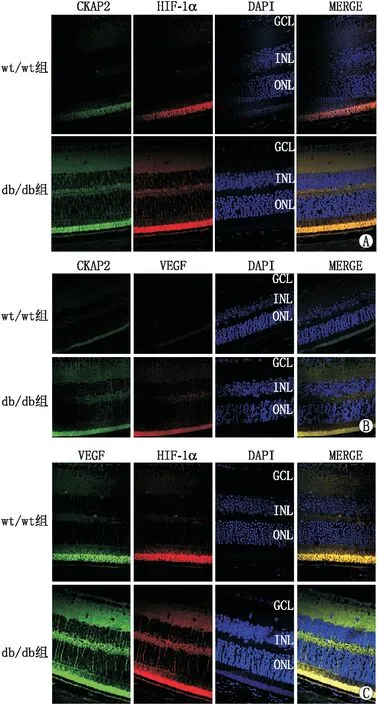
A:CKAP2与HIF-1α共染色;B:CKAP2与VEGF共染色;C: HIF-1α与VEGF共染色。图3 两组小鼠视网膜免疫荧光染色结果(×400)
3 讨论
目前,诱导糖尿病动物模型较常应用的化学试剂为链脲佐菌素,由于其诱导周期较长、稳定性较差,导致它在DR研究中的应用受到限制[9]。1966年Hummel等[10]发现位于4号染色体的瘦素受体基因缺陷可诱导自发性2型糖尿病小鼠(db/db小鼠)。瘦素受体基因(OB-R)又称糖尿病基因(db),瘦素受体(Lepr)与肥胖、高血压、糖尿病、脂代谢紊乱等之间存在密切关系。db/db小鼠在4~8周时出现高血糖和肥胖[11],16~24周时神经退行性病变明显[12]。由于该动物模型相对稳定,在糖尿病及其并发症的研究中逐渐被广泛应用。
CKAP2又称LB1及肿瘤相关微管蛋白,是一种与有丝分裂密切相关的蛋白,主要表达于增殖活跃的细胞;在细胞增殖,特别是在有丝分裂期间发挥重要作用[13-14]。其基因位于染色体13q14中,该区域重排可导致多种肿瘤发生[15]。我们前期研究发现,CKAP2在增生型DR患者眼组织及高糖培养的人视网膜微血管内皮细胞中高表达,并发现CKAP2可以影响高糖下人视网膜血管内皮细胞的增殖、迁移及成管能力[7-8]。本研究发现,CKAP2 mRNA和蛋白表达水平在db/db小鼠视网膜组织中显著升高,同时HIF-1α和VEGF存在平行表达上调的趋势,且三者在内层视网膜中存在不同程度的共表达,进一步证实了CKAP2可能通过HIF-1α/VEGF通路参与DR的发生发展。
HIF-1α/VEGF通路在DR发病中的重要作用已得到广泛证实[16-17]。HIF-1α是一种可以感知细胞中氧含量并据此调节细胞代谢活动的转录因子。缺氧状态下,HIF-1α与其靶基因结合后会产生一系列重要的功能,主要包括血管形成、细胞增殖、诱导凋亡及促进炎症反应等[18]。VEGF(VEGF-A)作为HIF-1α信号通路中的关键分子是血管内皮细胞特异性最高的有丝分裂原,通过与相应的受体结合,激活一系列下游信号,发挥促血管内皮细胞增殖、迁移、增加血管渗透性等生物学效应,从而促进病理性新生血管形成[19-21]。有研究发现,HIF-1α与VEGF在高糖培养下的人视网膜微血管内皮细胞以及db/db小鼠视网膜中表达增加[17],这与本研究结果相一致。我们在体外细胞实验中发现,给予外源性VEGF刺激可上调CKAP2的表达,而阻断VEGF后CKAP2表达下调[8]。因此,推测CKAP2与HIF-1α/VEGF信号通路之间可能存在相互作用关系。进一步探讨三者之间的作用关系,将有利于阐明DR的发病机制,为寻求DR的干预靶点提供新的途径。
本研究利用糖尿病动物模型观察CKAP2在视网膜组织中的表达与定位,这对我们既往实验结果进行了有益补充。但CKAP2是否参与DR的病理改变,如血-视网膜屏障破坏、病理性新生血管形成等,则需要通过基因沉默、过表达等实验以及氧诱导视网膜病变动物模型进行深入探讨。
