植物乳杆菌NMGL2胞外多糖对其生长特征及发酵乳加工特性的影响
2022-03-10赖田甜姚梦柯杨贞耐
赖田甜,赵 华,姚梦柯,朱 晨,张 敏,杨贞耐*
(北京工商大学 北京食品营养与健康高精尖创新中心 北京市食品添加剂工程技术研究中心,北京 100048)
乳酸菌胞外多糖(exopolysaccharides,EPS)是乳酸菌代谢产生的以紧密结合于菌体表面或松散附着的粘液形式分泌于细胞外的高分子聚合物[1]。乳酸菌EPS具有多种生理活性,如抗氧化[2]、抗肿瘤[3]、调节免疫[4-5]等;同时,作为一种天然高分子化合物还具有良好的稳定性和增稠性。产EPS乳酸菌在发酵乳制品加工中得到了越来越广泛的应用。
发酵乳是以鲜乳为原料,经巴氏杀菌后,添加发酵剂发酵而制成的发酵乳制品[6]。利用功能性乳酸菌作为发酵剂可以改善发酵乳的功能特性和发酵性能。HAN X等[7]研究发现,以产EPS乳酸菌作为发酵剂可以获得具有良好口感、质地及风味的发酵乳;BURNS P等[8-9]研究发现,将产EPS的发酵剂应用于发酵乳中可以有效提高其黏度和稳定性,能够抑制发酵乳凝胶断裂和乳清的析出,提高凝乳的持水性。
前期研究表明,植物乳杆菌(Lactobacillus plantarum)NMGL2具有良好的耐低温、耐酸、耐胆盐以及抑菌特性,并产生EPS[10]。利用该菌株制备发酵乳,其在冷藏过程中可有效地保持菌株的活性及产品的功能性[11]。本研究进一步针对植物乳杆菌NMGL2产的EPS,通过提取获得此多糖,研究其对菌株NMGL2的生长、菌体形态和稳定性的影响;并在此基础上,将EPS应用于植物乳杆菌NMGL2发酵乳加工中,研究其对发酵乳加工特性的影响,为植物乳杆菌NMGL2应用于发酵乳制品的生产提供技术依据。
1 材料和方法
1.1 材料与试剂
植物乳杆菌(Lactobacillus plantarum)NMGL2:分离自传统内蒙古干酪;鲜牛奶:北京三元食品股份有限公司;脱脂乳粉:新西兰恒天然集团;MRS肉汤培养基:北京奥博星生物技术有限公司;琼脂粉(生化试剂):国药集团化学试剂有限公司;氯化钠(分析纯):西陇科学股份有限公司;硫酸亚铁、氯化锌、甲醇、三氯乙酸、无水乙醇、氯化钙(均为分析纯):福晨化学试剂有限公司。
1.2 仪器与设备
HITACHI扫描电子显微镜(scanning electron microscope,SEM):日立高新技术公司;EDC均质机:上海依肯机械设备有限公司;BCN-1360B超净工作台:北京东联哈尔仪器制造有限公司;HZQ-Q恒温培养箱:上海一恒科学仪器有限公司;MLS-3750高压蒸汽灭菌锅:日本Sanyo公司;Master光学法微流变仪:法国Formulaction公司;iCinac乳品发酵检测仪:法国AMS-alliance公司;Brookfield CT3质构仪:美国Brookfield公司;CR21Ⅲ低温冷冻离心机:美国Bio-Rad公司;Infinite M200 PRO NanoQuant酶标仪:瑞士Tecan公司;MS3000马尔文粒度粒径分析仪:美国布鲁克仪器公司;R30A电动搅拌器:南京庚辰科学仪器有限公司;Beta 1-8 Ldplus冷冻干燥机:德国Marin Christ公司。
1.3 方法
1.3.1 植物乳杆菌NMGL2胞外多糖的制备
将保存于-80 ℃甘油管的植物乳杆菌NMGL2在室温下融化,按2%(V/V)的接种量接种到已灭菌的MRS液体培养基中,37 ℃静置培养12 h作为活化菌液;按2%(V/V)接种量进行传代培养,37 ℃培养12 h,发酵完成后将发酵液于4 ℃冰箱冷藏备用。
EPS的提取方法参照WANG J等[12]稍作改动。采用4%三氯乙酸对植物乳杆菌NMGL2发酵液(1 L)进行处理,离心(9 500 r/min,30 min,4 ℃)去除细胞和蛋白。加入两倍体积体积分数为95%的乙醇,4 ℃沉淀、离心(9 500 r/min,30 min,4 ℃)、透析(截留分子质量8 000~14 000 Da,4 ℃)、浓缩、冷冻干燥获得EPS,于4 ℃冰箱冷藏备用。
1.3.2 胞外多糖EPS对植物乳杆菌NMGL2生长、形态及稳定性的影响
将植物乳杆菌NMGL2活化菌液按2%(V/V)的接种量接种到100 mL MRS液体培养基中,分别添加2%和4%的EPS,设置为EPS-2组和EPD-4组,以不添加EPS为对照组,37 ℃静置培养。
(1)菌株生长的测定:每隔2 h取样,测定菌体OD600nm值,连续测定32 h。采用平板菌落计数法,选取适宜的稀释梯度,计算样品培养24 h时的活菌数。
(2)形态观察:以EPS-4为实验组,不添加EPS为对照组,37 ℃培养24 h后,采用MIN W H等[1]方法,并略有改动,使用扫描电子显微镜(SEM)对植物乳杆菌NMGL2的形态进行观察。在样品中加入质量分数2.5%、pH6.8的戊二醛溶液进行固定,4 ℃冷藏过夜,置于液氮中冷冻,取出后用刀片切断横截面,并用pH6.8的磷酸盐缓冲液(phosphate buffer saline,PBS)冲洗3次,每次10 min。采用体积分数分别为30%、50%、70%、80%、90%、100%的乙醇进行梯度脱水,每次10 min。用氯仿脱脂2 h,同时间间隔振荡,以叔丁醇置换乙醇,用无水乙醇冲洗10 min,无水乙醇∶叔丁醇=1∶1(体积比)冲洗6 min,纯叔丁醇冲洗6 min。真空冷冻干燥,选择要观察的面进行固定,镀金后进行SEM观察。
(3)Zeta电位分析:以EPS-4为实验组,不添加EPS为对照组,37 ℃培养24 h后,取10 μL溶于40 mL相同pH的去离子水中,加入马尔文Zeta电位分析仪的电极杯中润洗2次,运行程序5个循环,选取循环测定时电位正负值稳定的结果记录,每个样品测定3次[13]。
1.3.3 植物乳杆菌NMGL2发酵乳的制备
鲜牛乳(蛋白质3.1%、脂肪3.7%)预热至60~75 ℃,分别加入2%和4%的EPS,设置为EPS-2组和EPS-4组,以未加EPS为对照,40 MPa条件下均质,95 ℃杀菌5 min,冷却至37 ℃,并按5%(V/V)的接种量将植物乳杆菌NMGL2接入鲜牛乳中,于37 ℃条件下发酵至pH4.5,迅速置于冷水中冷却至4 ℃,并置于4 ℃冷藏备用。
1.3.4 发酵乳指标的测定
pH值的测定:将样品转移至iCinac乳品发酵监控仪中,37 ℃下对发酵过程中pH的变化进行监测,每隔1 h记录一次样品的pH值。
微流变特性指标的测定:采用微流变仪在37 ℃条件下监测发酵凝胶形成过程中微流变学参数即弹性指数(elasticityindex,EI)、宏观黏度指数(macroscopic viscosity index,MVI)及流动性指数(fluidity index,FI)随时间的变化情况,每隔1 h记录一次数据。
质构指标的测定:发酵乳样品于4 ℃冰箱储存24 h后,用Brookfield CT3质构仪测定发酵乳的硬度、黏性和内聚性。测定条件为:采用TA10平底柱形探头,直径2.5 cm,测定速度1.0 mm/s,刺入深度10 mm,返回速度1.0 mm/s。
1.3.5 统计学分析
每个样品至少测定3次,实验数据采用Origin2018作图,结果以“平均值±标准差”表示。采用方差分析检验各样本间的显著性差异,P<0.05表示差异显著。
2 结果与分析
2.1 胞外多糖对植物乳杆菌NMGL2的影响
2.1.1 胞外多糖对植物乳杆菌NMGL2生长的影响
胞外多糖对植物乳杆菌NMGL2生长的影响见图1。

图1 胞外多糖添加量对植物乳杆菌NMGL2 OD600nm值(a)及活菌数(b)的影响Fig.1 Effect of exopolysaccharides addition on OD600nm value (a) and the viable counts (b) of Lactobacillus plantarum NMGL2
发酵液在波长600 nm处的吸光度值反映了细菌的生长状况,与发酵液中菌体总数成直线正相关关系[14]。由图1a可知,随着培养时间的延长,植物乳杆菌NMGL2在不同EPS添加量的培养基中生长趋势大致相同,均经历了迟缓期、对数生长期及稳定期[15]。在培养4~10 h时,EPS的添加量与菌株NMGL2的生长速率呈正相关,分析原因可能是EPS能被植物乳杆菌NMGL2利用,为菌株的生长繁殖提供物质基础,从而一定程度上促进菌株生长[16]。由图1b可知,添加EPS的培养基中的活菌数显著高于对照组(P<0.05),且当EPS添加量为4%时,活菌数最高,达4.3×109CFU/mL,表明EPS可以显著改善植物乳杆菌NMGL2的存活能力[16],与之前有关植物乳杆菌YW11 EPS促进菌株存活作用的研究结果一致[17]。为了更好地观察实验结果,后续均采用EPS-4为实验组。
2.1.2 胞外多糖对植物乳杆菌NMGL2形态特征的影响
胞外多糖对植物乳杆菌株NMGL2形态特征的影响见图2。

图2 扫描电镜观察胞外多糖对植物乳杆菌NMGL2菌体形态的影响Fig.2 Effects of exopolysaccharides on the morphology of Lactobacillus plantarum NMGL2 by scanning electron microscopy
通常乳酸菌产生的EPS具有一定的黏性,依据其产量的高低对菌株的自聚集具有不同程度的影响[18]。由图2可知,植物乳杆菌NMGL2呈杆状,菌体边缘清晰,分布均匀,形态规则;而添加EPS后在菌体表面形成黏稠层,菌体之间出现黏连现象,并导致细胞形态发生不规则变化。早期研究报道了不同植物乳杆菌菌株产的EPS具有不同的微观结构,并具有较高的黏性及持水能力,对菌体形态具有不同的影响[1,12,19]。进一步采用高放大倍数SEM观察,发现空白组的菌体间存在一定的间隙,而添加EPS后菌体排列紧凑,EPS填充在细胞间隙中,分布极不均匀。这表明EPS对菌株自聚集性具有促进作用,与之前有关唾液乳杆菌(Lactobacillus salivarius)EPS促进菌体聚集的研究结果一致[18]。除EPS外,菌株自聚集性还与菌体表面特性有关。如约氏乳杆菌(Lactobacillus johnsonii)EPS的产生和菌体自聚集呈负相关,当EPS产量下降使菌体覆盖层减少时,菌体表面潜在蛋白暴露,从而提高菌株自聚集[20]。
2.1.3 胞外多糖对植物乳杆菌NMGL2稳定性的影响
通过Zeta电位分析可以推测胶状分散体中分散系的稳定性,Zeta电位数值的绝对值越大,体系的稳定性越好[21]。与胶体悬浮液中惰性颗粒表面相比,细菌细胞的表面复杂,细胞表面物质、培养基及其pH和离子强度等多种因素会影响菌体的Zeta电位及菌体稳定性[22]。胞外多糖EPS对植物乳杆菌NMGL2稳定性的影响见图3。
由图3可知,植物乳杆菌NMGL2及其胞外多糖EPS均具有相对较高的Zeta电位绝对值,但是将EPS添加于植物乳杆菌NMGL2菌株体系,此混合体系的Zeta电位绝对值降低,表明EPS添加降低了菌株体系的稳定性。这可能由于EPS覆盖在菌体表面上,屏蔽了部分的表面电荷,从而降低了Zeta电位[23-24]。并且过量的胞外多糖分子可能会造成的空间位障,削弱体系中粒子之间的静电相互作用,进而造成体系稳定性降低[25-26]。

图3 Zeta电位分析胞外多糖对植物乳杆菌NMGL2稳定性的影响Fig.3 Effect of exopolysaccharides on the stability of Lactobacillus plantarum NMGL2 by Zeta potential
2.2 胞外多糖对发酵乳的影响
2.2.1 胞外多糖对发酵乳发酵过程中pH变化的影响
胞外多糖对发酵乳发酵过程中pH变化的影响见图4。

图4 不同胞外多糖添加量对发酵过程中发酵乳pH变化的影响Fig.4 Effect of different exopolysaccharides addition on pH of fermented milk during fermentation
由图4可知,对于不同EPS添加量的各组样品,相同时间点的pH值略有差异,但是整体上各组样品pH变化趋势大致相同,都是先下降后趋于平衡。在发酵前期,菌株生长处于迟缓期,pH缓慢降低,分析原因可能是菌株自身进行生长繁殖,还没有大量产酸;到5 h左右,pH下降加快,此时菌株生长进入对数期,在快速生长的同时也大量产酸;到12 h左右,随着营养物质的消耗,菌体的生长和代谢水平下降,pH下降趋于平缓,此时菌株进入稳定期和衰亡期[27]。因此,不同添加量的EPS对于植物乳杆菌NMGL2发酵过程中pH的变化趋势的影响不明显。
2.2.2 胞外多糖对发酵乳发酵过程微流变特性变化的影响胞外多糖对发酵乳发酵过程中微流变特性变化的影响见图5。
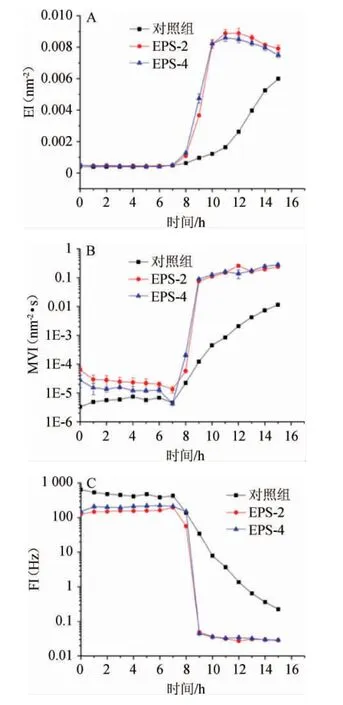
图5 不同胞外多糖添加量对发酵过程中发酵乳弹性指数(A)、宏观黏度指数(B)、流动性指数(C)的影响Fig.5 Effect of different exopolysaccharides addition on elasticity index (A),macroscopic viscosity index (B) and fluidity index(C) of fermented milk during fermentation
由图5可知,添加EPS组发酵乳的EI、MVI、FI变化整体趋势相同,但是和对照组之间存在较大的差异。在发酵前期,菌株几乎不产酸,pH下降缓慢,此时样品处于低弹性、低黏度、高流动的状态;当菌株开始大量产酸,pH开始急速下降时,发酵乳的黏度和弹性开始上升,流动性开始下降,逐渐开始形成高弹性、高黏度、低流动的稳定的凝胶体系。
由图5A可知,与对照组相比,添加EPS组发酵乳的弹性上升速度较快,且EPS-4组酸乳弹性上升速度最快;发酵结束后,EPS-4组样品的弹性介于对照组和EPS-2组之间,表明适量添加EPS可以增加酸乳的弹性。但蔡淼等[28]研究发现,植物乳杆菌EPS-YW11的添加会降低酸乳弹性。这可能与不同菌株胞外多糖的特性不同有关,在发酵过程中EPS与乳蛋白之间相互作用时对凝胶特性产生不同的影响[29]。
由图5B可知,在发酵过程中,随着乳酸菌大量地增殖产酸,pH不断降低,发酵乳中的蛋白质分子表面活性降低,形成微小的亚胶体分子团,进而增加液体的黏度。添加EPS组发酵乳的黏度高于对照组,可能是因为EPS填充于酪蛋白网络空隙,使发酵乳组织结构更加致密,增加了发酵乳的凝聚力。发酵过程MVI变化趋势与前述EI变化大致相同。发酵结束后,EPS-4组样品的黏度介于对照组和EPS-2组之间,表明适当的EPS添加量可以提高酸乳样品的黏稠度。
由图5C可知,对照组发酵乳的流动性始终要高于添加EPS组,可能是因为EPS使发酵乳中蛋白交联作用加强。但不同添加量的EPS对发酵乳的流动性影响差异不大。因此,推测EPS和植物乳杆菌NMGL2能够协同促进发酵乳凝胶结构的稳定。
2.2.3 胞外多糖对植物乳杆菌NMGL2发酵乳质构特性的影响
胞外多糖对植物乳杆菌NMGL2发酵乳质构特性的影响见表1。

表1 不同添加量的胞外多糖对植物乳杆菌NMGL2发酵乳质构特性的影响Table 1 Effect of different exopolysaccharides addition on the texture of fermented milk with Lactobacillus plantarum NMGL2
由表1可知,与对照组相比,EPS-2和EPS-4组发酵乳样品的硬度分别下降7.11%和8.33%,黏性分别提高23.64%和42.66%,内聚性均提高了7%。EPS-2和EPS-4组发酵乳样品的内聚性差异不显著(P>0.05),达0.46左右。这与发酵乳杆菌(Lactobacillus fermentium)Lf2和植物乳杆菌YW11胞外多糖对发酵乳质构影响的研究结果一致[28,30],分析原因可能主要与胞外多糖和乳基质中蛋白质之间的相互作用有关[31],EPS降低了蛋白质分子之间相互作用引起的大分子聚集,改善发酵乳的质构特性[32]。
3 结论
植物乳杆菌NMGL2胞外多糖与菌株NMGL2混合培养促进了菌株的生长,显著提高了活菌数。扫描电镜观察发现添加胞外多糖后菌体之间出现黏连现象,细胞形态发生不规则变化,且EPS附着在菌株NMGL2菌体细胞表面,降低了体系Zeta电位及稳定性。将植物乳杆菌NMGL2应用于发酵乳加工,在发酵过程中,不同添加量的胞外多糖对菌株NMGL2的产酸及发酵乳的内聚性影响不显著(P>0.05),但能显著提高发酵乳的弹性和黏性,显著降低流动性和硬度(P<0.05)。本研究结果表明产EPS植物乳杆菌NMGL2对发酵乳加工特性的有效改善作用,具有良好的应用前景。
