脉冲电磁场对骨代谢的分子细胞学作用机制研究进展
2022-03-08邓叶龙孔令俊刘朝辉李兴国杨德龙王晨亮黄晓焱袁剑陈文丽
邓叶龙 孔令俊 刘朝辉 李兴国 杨德龙 王晨亮 黄晓焱 袁剑 陈文丽
1. 甘肃中医药大学,甘肃 兰州 730000 2. 甘肃省中医院,甘肃 兰州 730050
骨质疏松症(osteoporosis,OP)是一种骨骼疾病,其特征是骨丢失和骨微结构破坏,伴随着骨脆性增加和脆性骨折的风险增加[1]。骨吸收与形成之间的不平衡导致骨密度和骨质量降低,最终导致OP甚至脆性骨折的发生[2],随着人口老龄化日益加剧,OP成为了全球的公共健康问题。目前治疗OP的方法包括药物、手术、物理疗法等。长期使用抗骨质疏松药物可能会导致胃肠道不适、颌骨骨坏死和股骨头坏死等副作用[3]。脉冲电磁场(pulsed electromagnetic fields ,PEMFs)是一种非侵入性的骨骼疾病物理疗法,因其见效快、操作简便、无副作用而得到广泛应用[4]。PEMFs能够在组织中诱导生物电流,产生特殊的生物效应[5],其频率范围从5~500 Hz[6],不同频率、波形、强度的电磁场对特定的骨细胞产生不同的生物效应。有研究表明[7],当PEMFs的频率为7.5~15 Hz或50~75 Hz,强度为0.40~1.55 mT或3.8~ 4 mT时,PEMFs能够促进成骨细胞的增殖;0.9~4.8 mT和45~60 Hz的正弦电磁场,以及0.1~0.4 mT或400 mT的静态磁场,可以促进成骨细胞的分化和成熟。然而,由于各种细胞和分子可以受到具有各种参数的电磁场的影响,PEMFs对骨细胞的精确生物效应和潜在机制仍然不清楚。本文拟就PEMFs对骨代谢的作用及机制研究进展进行综述。
1 PEMFs对骨代谢的分子细胞学作用机制
1.1 PEMFs对骨髓间充质干细胞的影响
有研究[8-10]报道PEMFs能促进骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMSC)的增殖,然而也存在PEMFs对BMSC的增殖具有抑制作用的报道。这种差异与初始接种培养物的密度不同有关,高接种密度的BMSC抑制了其自身的扩散,BMSC的成脂化和成骨化受到影响。因此初始接种密度在PEMFs疗法确定诱导哪种分子机制分化过程中具有重要作用。脂肪细胞(adipocytes)和成骨细胞来源于BMSC,其分化由PPAR-γ和Runx 2转录因子的控制。PPAR-γ是一种主要在脂肪细胞中特异表达的转录因子,它促进BMSC向脂肪细胞而不是成骨细胞的分化,导致骨髓脂肪增加、骨密度降低和骨折风险增加。Runx 2的表达可以控制基质金属蛋白酶细胞的分化,刺激骨的形成和抑制脂肪生成[11]。
PEMFs如何影响BMSC成骨分化的详细机制尚不完全清楚,存在许多假说。PEMFs可通过调节碱性磷酸酶(ALP)活性和Runx 2/Cbfa1的表达,诱导BMSC成骨标志物的早期表达[12-13];PEMFs还能增强矿化,抑制成脂基因AP-2的表达[14];PEMFs联合骨形态发生蛋白2(BMP-2)有利于BMSC的成骨分化[15];BMSC在成骨分化过程中可以表达A2A和A2B腺苷骨活性物质受体[16]。由这两种腺苷受体调节的环磷酸腺苷的上调能够介导成骨相关基因的表达Runx 2和Osterix[17],表明这些受体可以参与成骨;PEMFs还可能通过哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)途径诱导BMSC向成骨细胞谱系的转移[18-19]。mTOR参与多种细胞类型的调节,如成骨细胞和脂肪细胞。PEMFs可以消除mTOR诱导的细胞外基质矿化的减少,抑制mTOR信号通路可能刺激成骨细胞分化并降低成脂潜能;PEMFs可以通过激活TGF-β信号通路和刺激BMSC中miR21-5p的表达来调节其对骨代谢的影响。
1.2 PEMFs对成骨细胞的影响
PEMFs对成骨细胞增殖和分化的影响存在矛盾的结果,研究发现[20]在成骨样MC3T3细胞系中,ALP活性通过PEMFs(15 Hz和7 mT)处理显著增加,认为PEMFs能增强成骨细胞活性,导致细胞分化增加。也有研究报道[21],当新生小鼠颅骨骨细胞暴露于PEMFs(15 Hz和2 mV/cm)时,ALP活性可能被抑制,认为PEMFs可以刺激成骨细胞增殖,但对分化没有影响。产生这些矛盾结果的原因可能在于所使用的细胞类型、PEMFs的频率和强度、分析选择的时间点不同。
PEMFs能上调BMP2、转化生长因子(TGF-β)、骨保护素(OPG)、骨桥蛋白、Runx 2/Cbfal、ALP、基质金属蛋白酶1和3(MMP-1和MMP-3)、核因子κB(nuclear factor kappa-B,NF-κB)配体,表明PEMFs能直接刺激骨母细胞的成骨分化[22-23]。此外,PEMFs能上调大鼠骨量和TGF-β浓度,降低白细胞介素6(IL-6)的浓度[24],这可以有效地抑制骨损失。PEMFs不仅能上调与骨和基质成分形成相关的多种基因,还能调节与细胞外基质降解相关的多种基因[25],如下调与骨形成相关的重要基因(HOXA10、AKT1)、转导水平的基因(CALM1、P2RX7)、细胞骨架成分(FN1、VCL)、细胞外基质(MMP-11,DUSP4)降解相关基因,上调胶原(COL1A2)和非胶原(SPARC)基质成分。PEMFs能增强IGF-II和TGF-β分泌,减少前列腺素E2 (PGE2)的分泌,并刺激骨组织的形成[26]。PEMFs上调Ccnd 1和Ccne 1的表达,导致成骨作用增强[27]。PEMFs可以通过增加一氧化氮(NO)的合成来刺激成骨细胞的增殖和分化,低NO水平与成骨细胞增殖和分化有关,而高浓度的NO则抑制了成骨细胞的增殖和分化[28]。细胞内钙瞬变在成骨细胞增殖和分化中起重要作用[29],这可以通过PEMFs处理来实现。
目前关于PEMFs如何影响成骨细胞的机制有多种假设。典型Wnt/β-catenin信号通路在调节骨量平衡中起着关键作用[30],能刺激成骨细胞的生成和活性。Wnt蛋白通过细胞外Wnt配体触发,最初与细胞膜上的Frizzled和LRP5/6受体结合,导致Wnt靶向基因的上调。PEMFs在体内和体外均可增加Wnt/β-catenin信号通路相关基因的表达,如Wnt1a、Wnt3a、Lrp5和Lrp6。此外,PEMFs还下调Dickkopf相关蛋白1 (DKK1),拮抗Wnt/β-catenin信号通路[27]。PEMFs可能通过BMP2信号通路刺激成骨细胞功能,促进BMP2-catenin的分泌。因此,更多的BMP2-catenin与其受体结合,受体磷酸化,触发细胞内信号分子Smad 1/5/8的激活[31],导致转录因子Runx2和Osterix的表达上调,影响骨形成[32]。PEMFs能抑制参与基质降解的基因,如下调基质MMP-11和DUSP4,这些基因可以参与抑制成骨细胞的分化和增殖。此外,PEMFs可以影响C-myc和C-fos的表达,以及触发细胞外调节蛋白激酶(ERK)1/2分子途径,这对成骨细胞增殖和分化的有积极作用[33]。
1.3 PEMFs对破骨细胞的影响
据报道,PEMFs对破骨细胞生成、凋亡及骨吸收具有影响,PEMFs可以抑制来源于OVX大鼠的原代骨髓细胞的破骨细胞生成,肿瘤坏死因子(TNF-α)、IL-1β和IL-6的浓度降低可能是造成这一结果的原因[34]。胞核因子KB受体活化因子/细胞核因子KB受体活化因子配体/骨保护因子(RANK/RANKL/OPG)系统在破骨细胞的活化、发育、成熟过程中起关键性作用[35]。骨细胞和成骨细胞主要表达RANKL,这是一种细胞表面蛋白,与位于破骨细胞膜上的特异性受体RANK结合,刺激破骨细胞生成。源自成骨细胞的OPG抑制破骨细胞成熟,阻断破骨细胞生成。PEMFs可能通过OPG/RANK/ RANKL信号通路在破骨细胞形成的调节中发挥抑制作用。PEMFs抑制RANKL的表达,同时增强OPG的表达,导致OPG/RANKL比率增加,PEMFs不仅上调OPG的表达,而且抑制IL-1β诱导的NF-kB p65亚单位的活性[36]。细胞内活性氧(ROS)是破骨细胞分化和形成的关键因素,用二苯基氯化碘降低细胞内ROS可显著抑制RANKL诱导的破骨细胞分化,表明PEMFs可通过清除细胞内ROS抑制RANKL诱导的破骨细胞生成[37]。PEMFs还可以下调碳酸酐酶II(CA II)的表达,这是破骨细胞吸收活性的原因[38]。此外,破骨细胞分化可能受Ca2+/钙调神经磷酸酶-NFATc1信号通路的调节,使用FK506钙调神经磷酸酶活性抑制剂,可抑制骨吸收,同时降低NFATc1和CTSK的表达[39]。此外,在硝苯地平或FK506存在的情况下,PEMFs进一步降低NFATc1自身扩增和CTSK的表达。这表明PEMFs对Ca2+/钙调神经磷酸酶-NFAT信号通路有重要影响[40]。
1.4 PEMFs对骨细胞的影响
关于PEMFs对骨细胞影响的研究较少,PEMFs刺激不影响骨细胞样细胞(MLO-Y4) 的增殖但能持续上调MLO-Y4的总PGE2和总TGF-β1,PEMFs还可以诱导NO2的产生[41]。PGE2在成骨细胞分化中起关键作用,细胞外基质合成受TGF-β1刺激,NO2能抑制成骨细胞活性刺激细胞凋亡,促进骨吸收。PEMFs降低了骨坏死的风险,并降低了空骨细胞腔隙率[42]。以上提示PEMFs可通过刺激骨细胞调节骨代谢。
2 PEMFs在调节骨代谢中的作用
骨细胞作为成骨细胞的阳性调节因子,通过间隙连接(GJs)、NO和PGE2影响成骨细胞,并通过硬化素(SOST)和DKK1作为成骨细胞活性的阴性调节因子[43]。此外,破骨细胞与骨细胞的关系主要依赖于旁分泌信号和GJs。骨细胞也分泌OPG和TGF-β来影响破骨细胞生成。凋亡的骨细胞是RANK的受体激活剂的主要来源能促进破骨细胞吸收。骨细胞可以调节骨矿化,而BMSC可以根据不同的刺激分化为成骨细胞和破骨细胞。PEMFs能刺激BMSC分化为成骨细胞,并通过不同的机制增强成骨细胞的功能。此外,PEMFs对破骨细胞生成、凋亡和骨吸收有明显的影响。PEMFs可以通过下调RANKL和上调OPG来抑制破骨细胞生成。PEMFs刺激诱导骨细胞的细胞因子如PGE2、TGF-β1和Cx43的产生,影响其他细胞类型之间的通讯。见图1。
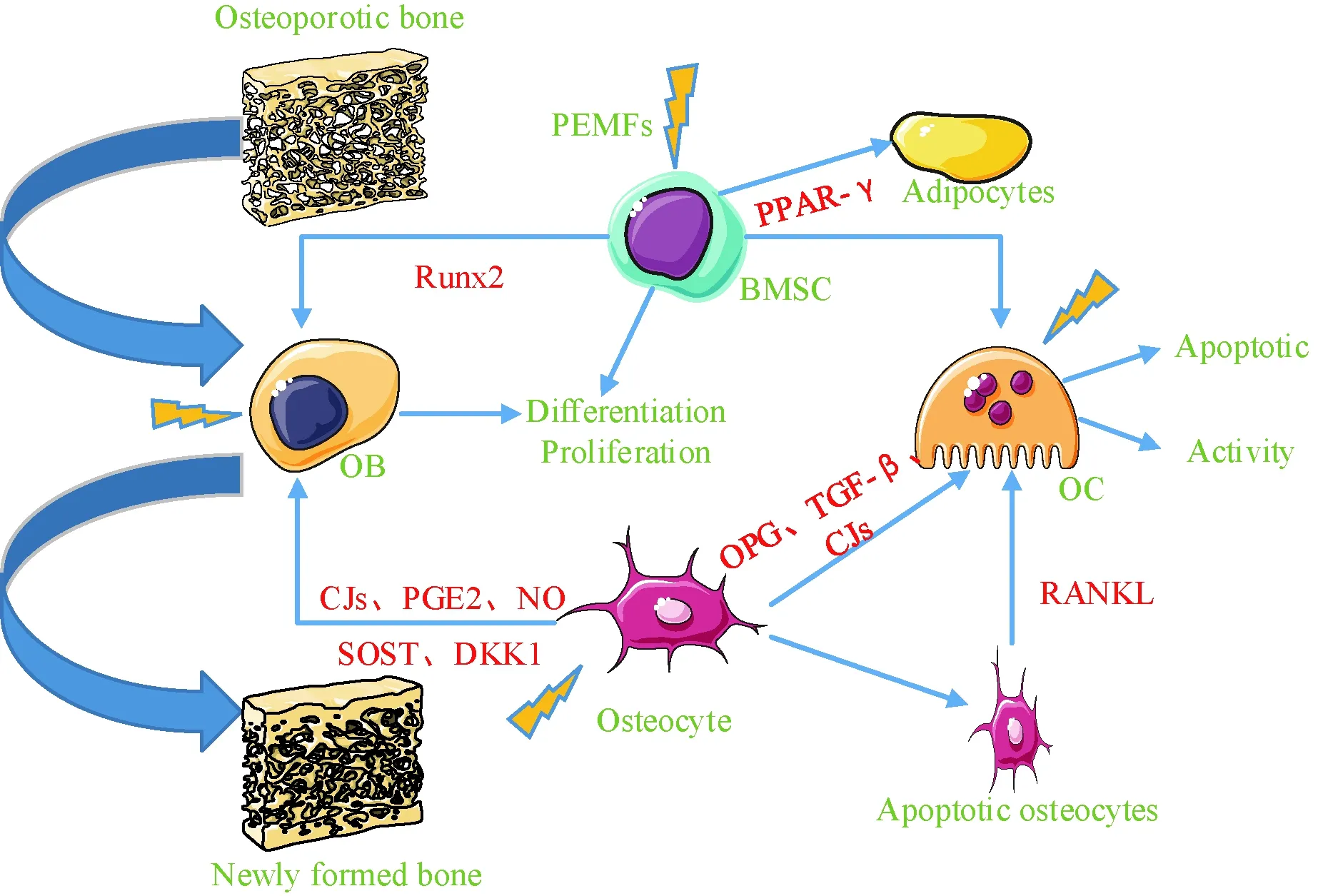
图1 PEMFs对细胞的影响Fig.1 Effect of PEMFs on cells
3 小结
本文通过对文献的综述,总结了PEMFs对BMSC、成骨细胞、破骨细胞、骨细胞的影响及其分子信号通路的最新进展。对于BMSC,多种基因的表达和分子细胞通路会受到PEMFs的影响,如PPAR-γ、Runx2、AP-2、BMP-2、A2A、A2B、TGF-β、miR21-5p等;对于成骨细胞,PEMFs影响BMP2、TGF-β、OPG、Runx2、Cbfal、ALP、MMP-1、MMP-3、NF-KB、Wnt/β-catenin、Smad 1/5/8等;对于破骨细胞,PEMFs影响OPG、RANK、RANKL、CA II、NFATc1、CTSK等;对于骨细胞,PEMFs影响PGE2、TGF-β1等。需要更多高质量的工作来探索PEMFs对骨细胞/骨骼的详细影响和潜在机制,以优化PEMFs在骨骼疾病中的应用。值得注意的一点是,PEMFs对骨代谢的影响具有窗口效应,即不同频率、波形、强度及作用时间等相关参数不同,实验结果也不同,一项关于四种电动势[低频(1~100 Hz)、低频(100~3 000 Hz)、高频(3 000~50 000 Hz)和高频(1~50 000 Hz)]对去卵巢(OVX)小鼠骨质疏松症影响的研究发现[44],作用3周后与OVX相比,1~100 Hz和100~3 000 Hz显著增加血清骨形成标志物和成骨相关基因表达;3 000~50 000 Hz显著降低了血清骨形成和再吸附标志物以及成骨和破骨细胞生成相关基因的表达;1~50 000 Hz具有明显增加骨形成和降低骨吸收活性的累积效应。Li等[45]通过比较50 Hz 0.6 Mt低频脉冲电磁场(PEMFs)和50 Hz 1.8 Mt正弦交变电磁场(SEMFs)对尾部悬吊大鼠骨丢失的预防作用发现,50 Hz 0.6 mT PEMFs和50 Hz 1.8 mT SEMFs能有效提高尾部悬吊大鼠的骨密度和生物力学值,提高大鼠血液中成骨标志物的浓度,通过影响PTH水平激活cAMP通路,从而进一步增加成骨细胞的含量,尤其是PEMFs能阻止尾吊大鼠骨密度和最大负荷值降低50 %左右,并通过促进骨形成增加尾吊大鼠的骨量,但需进一步研究。所以对于最佳的PEMFs刺激参数需要进一步探索。
4 展望
基于对PEMFs在调节骨代谢中潜在作用的研究,其可能被推荐用于骨骼疾病如OP的治疗。已有文献[46-47]报道PEMFs用于临床治疗OP,还没有关于长期应用PEMFs的不利影响相关报道,但是大多数临床研究样本量少,PEMFs治疗OP效果的证据等级不高。因此,需要高质量、随机对照试验、大样本量和长期随访的更可靠证据来验证PEMFs治疗OP的临床效果。此外,使用基因敲除小鼠来确定PEMFs治疗OP的特定靶点值得更多的关注。
