利用Label-free技术筛选MC3T3-E1细胞中miR-381-3p介导的靶蛋白和差异蛋白生物学功能分析
2022-03-08陈锦成朱国涛秦晓飞陈彦丞罗骏余博飞吴宜璟徐杰
陈锦成 朱国涛 秦晓飞 陈彦丞 罗骏 余博飞 吴宜璟 徐杰*
1.福建中医药大学中医骨伤及运动康复教育部重点实验室,福建 福州 350122 2.福建省立医院骨二科,福建医科大学,福建 福州 350001
肌少症(sarcopenia)与骨质疏松症(osteoporosis,OP)在临床上关系紧密,但是联系两者间的机制尚未完全阐明。microRNA被证实密切参与骨骼肌肉代谢,有望成为联系两者间的新桥梁。本项目前期研究中发现miR-381-3p在肌少-骨质疏松症(sarco-osteoporosis,SO)与OP患者中存在显著的差异性表达(10.57倍)[1],其可能参与肌少症患者罹患OP的发生发展过程[2]。在细胞实验中初步证实了miR-381-3p可以通过介导ERK1/2/ETS1信号通路因子抑制MC3T3-E1细胞成骨分化的机制,但是上述机制尚不能很好的解释miR-381-3p调控机体骨代谢机制的全部内容。
miRNA作为骨质疏松症和肌少症的发生发展过程中重要的调控分子;成熟的miRNA通过形成沉默复合体,再通过完全或不完全配对与特定靶基因的3’UTR结合,起到抑制mRNA 翻译或是直接降解mRNA 的作用,从而影响了靶点基因的表达水平。综合miRNA调控机制存在多靶点与涉及广泛信号通路因子的复杂性,本课题采用小鼠前成骨细胞(MC3T3-E1),基于慢病毒转染技术成功构建miR-381-3p在MC3T3-E1细胞中实验组(MC3-E1-in)与对照组(MC3-E1-NC-in)细胞模型,创新性运用非标记蛋白质组学技术筛选miR381-3p在体外细胞中实验组与对照组的差异蛋白质谱,目的是尽最大可能鉴定出miR381-3p可能涉及的相关的分子信号通路或重要的转录因子以揭示其介导成骨分化与骨形成过程更多的调控机制。本实验蛋白质组学筛选数据为课题组后续开展SO的更进一步研究提供了参考靶蛋白与相关的信号通路信息及理论依据。
1 材料与方法
1.1 材料
1.1.1实验试剂和耗材:Bradford试剂购自于碧云天;二硫苏糖醇(DTTred,货号:D9163-25 G)、碘代乙酰胺(IAM,货号:I6125-25 G)、碳酸氢铵(货号:5330050050)、三乙基碳酸氢铵缓冲液(货号:T7408-500 ML)、氨水(货号:221228-500 ML-A)均购自于Sigma;尿素和十二烷基硫酸钠(SDS)均购自于国药;质谱级胰酶(货号:V5280)购自于Promega;LC-MS级超纯水(货号:W6-4)、LC-MS级乙腈(货号:A955-4)、LC-MS级甲酸(货号:A117-50)均购自于Thermo Fisher Chemical;丙酮(货号:11241203810051)购自北京化工厂。
1.1.2实验仪器:EASY-nLC 1200TM(型号:LC140)、Q ExactiveTMHF-X质谱仪、酶标仪均购自Thermo Fisher;低温离心机(型号:D3024R)购自于Scilogex;冷冻干燥机(型号:Scan Speed 40)购自 Labogene;电泳仪、电泳槽均购自Bio-Rad;电子天平(型号:BSA124 S)购自Sartorius;涡旋混合器(型号:HY-6B)购自光合;制冰机购自雪科;超声波细胞破碎仪(型号:JY92-11 N)购自宁波新芝。
1.2 方法
1.2.1MC3T3-E1成骨细胞总蛋白提取:MC3T3-E1成骨细胞慢病毒转染成功并试试荧光定量PCR验证转染效率后,将细胞样品冻存于- 80 ℃ 冰箱中;正式实验时从- 80 ℃冰箱取出细胞样品,冰上操作,根据冻存时的细胞计数所得的细胞量加入一定体积的蛋白裂解液(100 mmol/L碳酸氢铵、8 mol/L尿素、0.2 % SDS,pH=8),涡旋并振荡混匀,超声5 min使充分裂解;迅速转移至预冷好的1.5 mL离心管中,于4 ℃、12 000g离心15 min,取上清加入终浓度10 mmol/L DTTred于56 ℃反应1 h,之后加入适量的IAM,于温箱37 ℃避光孵育1 h。加入4倍体积的预冷好的丙酮于- 20 ℃环境下沉淀处理2 h,于4 ℃、12 000g至少离心15 min,收集沉淀。之后加入1 mL预冷好的丙酮重悬处理,随后清洗沉淀样品,于4 ℃、12 000g离心15 min,收集沉淀,风干,最后加入一定体积的蛋白溶解液(6 mol/L尿素、100 mmol/L TEAB,pH=8.5)以溶解蛋白沉淀。
1.2.2成骨细胞总蛋白质量控制和酶解:使用碧云天蛋白质定量试剂盒进行BCA定量和测量蛋白样品浓度[3],按照试剂盒的说明书先在1.5 mL离心管中配制好BSA标准品的蛋白溶液,使其浓度梯度范围为0~ 0.5 μg/μL。按照说明设置不同浓度梯度的标准蛋白溶液和稀释一定倍数的待测样品试剂逐个加入96孔板中,用PBS补足每孔体积至20 μL,每个梯度需设置复孔3个。最后加入180 μL G250染色液工作液,室温反应5 min,酶标仪上测定吸光度并在excel表格中运用标准曲线的公式计算每组待测样品的蛋白总浓度。随后每组取40 μg样品进行10 % SDS-PAGE凝胶电泳,其中上层胶电泳条件为80 V跑30 min,下层胶电泳条件为110 V跑80 min;电泳结束后将条带用考马斯亮蓝染色进行验证。为了进行蛋白水解,在37 ℃下于2.5 μg胰蛋白酶中将100 μg蛋白质/样品水解4 h(蛋白质:酶比= 40∶1)。然后以相同比例再次添加胰蛋白酶,并在37 ℃下继续酶解8 h。接下来,使用Strata X柱将水解的肽脱盐,并在真空下干燥。
1.2.3液质检测:流动相A液体(100 %水+0.1 %甲酸)和B液(80 %乙腈+0.1 %甲酸)预配置。使用A液10 μL溶解冻干粉末,随后4 ℃离心机中14 000g离心20 min,取上清1 μg实验样品上样,进行液质检测。使用EASY-nLC 1200TM的UHPLC系统,预柱为自制预柱(2 cm×75 μm,3 μm),其中分析柱为自制分析柱(15 cm×150 μm,1.9 μm),根据试剂使用说明书操作液相色谱的洗脱程序,在Q ExactiveTMHF-X质谱仪上机,生成质谱检测原始数据(文件格式.raw)[4]。
1.2.4蛋白质数据库搜索和差异表达蛋白的功能分析:使用 Interproscan软件进行GO功能注释(涉及Pfam、PANTHER、ProDom、ProSite、SMART等数据库),COG和KEGG对鉴定到的蛋白质进行功能蛋白家族及通路分析[5]。针对具有DEPs进行火山图分析、聚类热图分析以及GO和KEGG的通路富集分析[6],并使用STRING DB软件[7]预测可能的蛋白质-蛋白质相互作用(http:// STRING.embl.de/)。
1.3 生物信息学分析
对鉴定到的蛋白进行GO数据库、KEGG数据库和亚细胞定位等常见功能数据库注释;针对筛选出来的DEPs结果运用火山图与表达聚类图进行整合分析,然后进行GO功能富集、KEGG功能富集分析、DEPs亚细胞定位分析和蛋白质-蛋白质相互作用网络分析等DEPs功能分析。
2 结果
2.1 miR-381-3p转染效率实时荧光定量PCR验证
在MC3T3-E1细胞中转染对照组(MC3-E1-NC-in)和实验组(MC3-E1-in)对应的病毒,并且经过嘌呤霉素筛选后构建成稳转株,采用实时荧光定量PCR验证这两组的miR-381-3p表达水平;对照组和实验组相比,差异倍数0.74倍(P<0.05),证明miR-381-3p表达水平被抑制;两组中miR-381-3p转染效率经实时荧光定量PCR验证达到预期结果(图1),细胞实验模型构建成功。

图1 实验组与对照组MC3T3-E1细胞慢病毒转染效率(*P<0.05)Fig.1 Lentiviral transfection efficiency of MC3T3-E1 cells in experimental group and control group (*P<0.05)
2.2 定量差异蛋白质谱筛选结果
在实验组(MC3-E1-in)组与对照组(MC3-E1-NC-in)中共筛选出了4 764种差异表达蛋白,其中527种差异显著并具有统计学意义,表达上调的有357种,有170种则是表达下调,见表1。对显著DEPs绘制了火山图,见图2。
2.3 GO富集结果分析
为了评估所有鉴定出的蛋白质的功能意义,使用 interproscan 软件进行GO注释分析。结果显示这些DEPs参与多个生物学过程(BP),主要的代谢过程为细胞代谢过程、核酸代谢过程、细胞蛋白修饰过程和蛋白质磷酸化通路;DEPs参与的主要分子功能(MF)为蛋白质结合、ATP结合、转移酶活性和甲基转移酶活性;DEPs的细胞组分(CC)分析显示主要由细胞骨架部分、微管细胞骨架和外泌体组成;DEPs主要定位于膜的整体组分、膜上和胞质。GO富集柱状图见图3。

表1 差异表达蛋白质谱Table 1 Differentially expressed protein profile
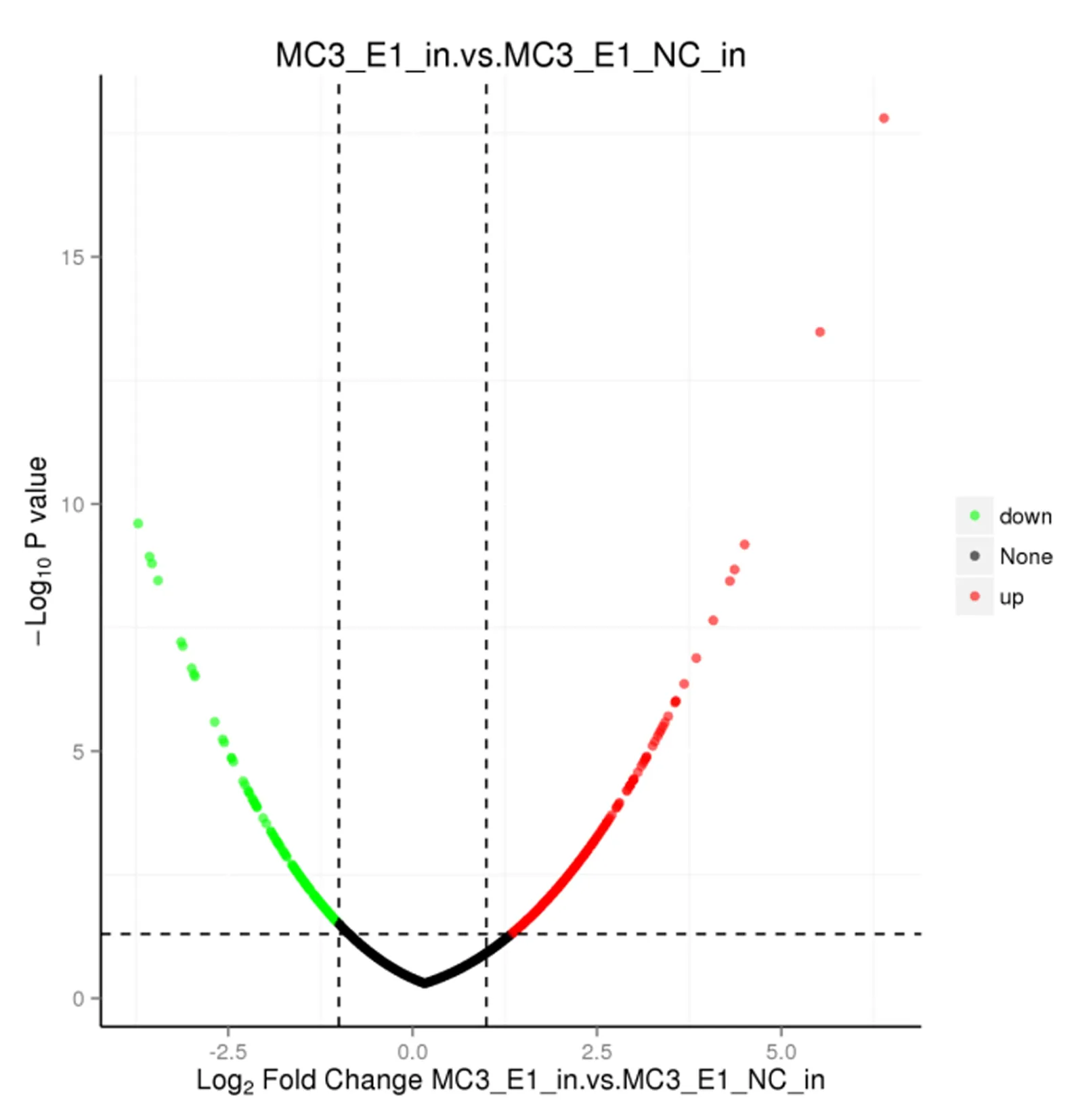
图2 鉴定细胞样品中的差异蛋白火山图Fig.2 Identify the difference protein volcano plot in the cell sample注:X轴表示蛋白质差异(log2转换的倍数变化);Y轴则表示相应的- log10转换的P值;红点表示蛋白上调显著;绿点表示蛋白下调显著;灰点表示没有明显变化的蛋白。
2.4 KEGG通路富集分析
课题组进行了KEGG通路[8-9]分析,以进一步表征已鉴定DEPs的生物学功能。结果表明,DEPs涉及549条信号通路,差异蛋白富集结果中排名最高的20种生物学功能如图4所示,主要通路是细胞周期通路(14种)、丝裂原活化蛋白激酶(MAPK)信号通路(9种)、Ras信号通路(7种)和过氧化物酶体增殖剂激活受体(PPAR)信号通路(6种)。在这些途径中,“细胞周期通路、MAPK信号通路和PPAR信号通路”富含丝氨酸/苏氨酸-蛋白激酶PLK、脂滴包被蛋白2、Ras相关蛋白、转化生长因子-β的进化保守信号中间物2型受体和其他蛋白质,这些蛋白质的表达随年龄增加而增加;另一方面,在本次成骨细胞样本中检测到的各种DEPs中也丰富了一些氧化代谢过程,尤其是一些与成骨和成肌代谢有关的过程。
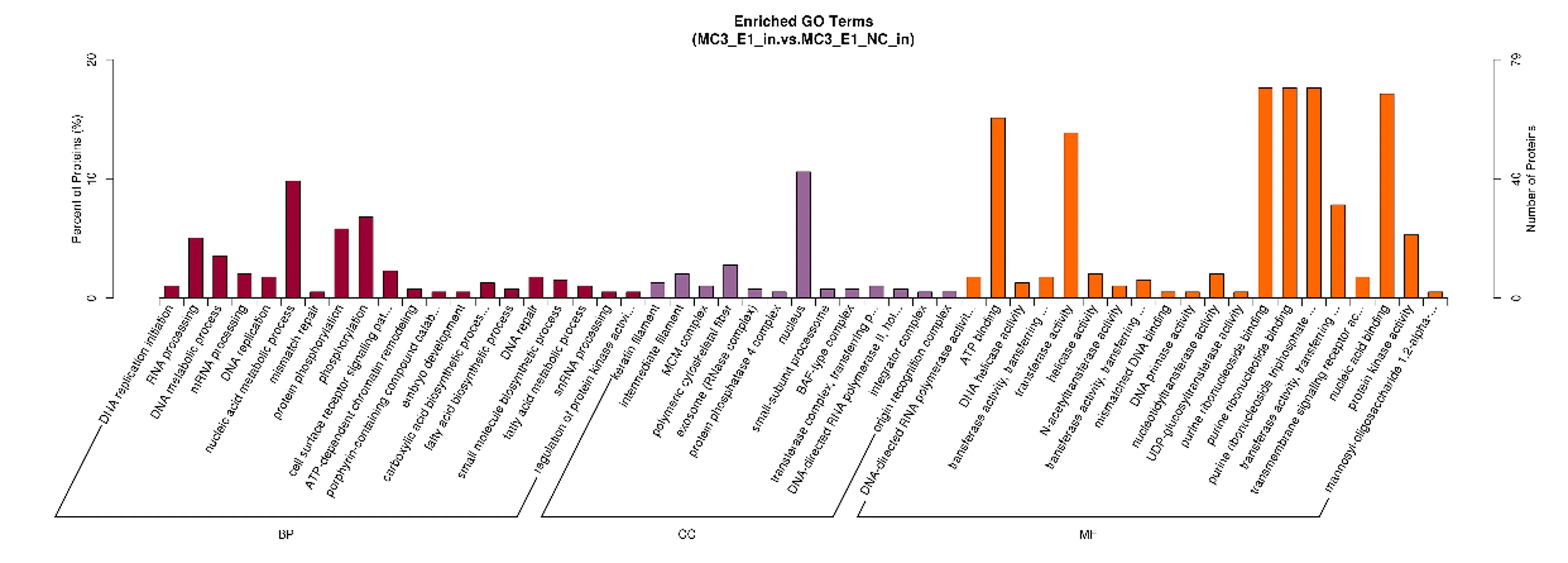
图3 所有已鉴定细胞样品蛋白的功能性GO分类Fig.3 Functional GO classification of all identified cell sample proteins注:X轴表示GO三个大类(细胞组分、分子功能、生物过程)的富集结果;Y轴为与该GO相关的差异蛋白数目占GO注释的所有差异蛋白数目的百分比。

图4 差异蛋白KEGG富集的前20条途径Fig.4 Top 20 pathways enriched by differential protein KEGG注:X轴表示富集因子(Ratio),即注释到每个途径的差异蛋白的数目除以注释到同一途径的所有鉴定的蛋白质;值的大小表示注释到每个路径的DEPs的比例大小;点大小代表注释到每个路径的差异蛋白数量。
2.5 DEPs中与SO相关的蛋白
在发现的DEPs中,筛选出己糖激酶2、驱动蛋白样蛋白22、cAMP调节的磷酸化蛋白19和脂滴包被蛋白2等4个SO相关蛋白,蛋白互作网络图见图5。

图5 差异蛋白的PPI网络图Fig.5 PPI network diagram of differential proteins注:红色和蓝色节点分别表示DEPs上调和下调;圆圈的大小指示节点度。
3 讨论
本实验研究运用Label-free定量蛋白质组技术构建出小鼠前成骨细胞实验组与对照组的差异表达蛋白质谱,用T-test检验对蛋白质定量结果进行统计分析,将实验组(MC3-E1-in)和对照组(MC3-E1-NC-in)之间定量差异显著的蛋白质(FC≥2.0,同时P≤0.05时,标记为上调表达蛋白;当FC≤0.50,同时P≤0.05时,标记为下调表达蛋白) 定义为DEPs。结合文献梳理结果并初步筛选出己糖激酶2、驱动蛋白样蛋白22、cAMP调节的磷酸化蛋白19和脂滴包被蛋白2等OP相关蛋白,分析这些DEPs,紧密结合课题组前期SO高通量测序发现肌肉和骨组织样品中显著差异表达miR-381-3p等临床实验发现,并通过本项目的细胞层面蛋白质组学研究为进一步阐明SO的内在分子机制提供更多基础研究依据。
己糖激酶2(hexokinase-2,HK2)在正常的机体骨代谢过程中发挥重要调控作用,国内外研究者研究发现,HK2不仅在糖酵解中起重要作用,而且在细胞存活中也起重要作用;Miyamoto 等[10]研究发现HK2是骨骼肌和脂肪组织等胰岛素敏感组织中的主要同工型的酶,其上调表达有助于自噬反应,其机制可能是HK2充当从糖酵解到自噬的分子转换,以确保机体在一定条件下的细胞能量稳态,以实现保护肌细胞的目的。
驱动蛋白样蛋白22(kinesin-like protein 22,KIF22)属于微管依赖性分子运动蛋白,可与微管和染色体结合,转运细胞器,蛋白质和mRNA[11]。郭晓强等[12]研究发现驱动样蛋白作为重要地的分子马达,其重点调控肌肉细胞和非肌肉细胞的机体运动,此外,驱动样蛋白可与动力蛋白搭配后沿着微管运动在细胞内负责进行物质运输,其在细胞有丝分裂、细胞骨架动力学以及减数分裂中染色体分离过程充当重要角色[13];Faire等[14]的研究还发现在成肌分化过程中,许多细胞器会重新定位,并在肌管的整个生命周期内保持不对称分布,而驱动样蛋白超家族的成员可能负责这些微管依赖性运动中的一些或全部,在研究者后续鉴定过程中同样证实了驱动蛋白样蛋白在所有阶段的成肌细胞中以及在各种大鼠组织中普遍表达。在小鼠前成骨细胞实验组与对照组对比中发现KIF22处于高表达水平,提示驱动蛋白样蛋白22可能作为有效转录因子参与老年性肌肉-骨骼系统疾病发生发展过程。
Yoshikawa等[15]在鉴定大鼠骨骼肌的失神经萎缩差异基因表达研究中发现,cAMP调节的磷酸化蛋白19(cAMP-regulated phosphoprotein 19,ARPP19)处于高表达水平。众所周知,cAMP对L-型钙通道功能具有重要的调控作用。李芳萍[16]研究成骨细胞Ros 17/2.8中肌动蛋白对cAMP调节的L-型钙通道的作用及其分子机制时,发现肌动蛋白可以通过改变L-型钙通道动力学特征以调节L-型钙通道的活性, 研究者深入研究发现机体肌动蛋白状态可以显著影响L-型钙通道的功能,而cAMP可以介导肌动蛋白4与L-型钙通道的相互作用来调控L-型钙通道的功能。
脂滴包被蛋白2(perilipin-2,Plin2)是一种与细胞内脂质小滴(LDs)代谢相关的蛋白质[17],其过表达会影响肌肉减少症、骨质疏松症等多种代谢和与年龄有关的疾病的进程,这表明该蛋白可能在这些病理状态下起作用;Conte等[18]的研究则在老年人和不运动的人群中发现了Plin2与较低的肌肉质量和力量之间的密切关系,但其在骨骼肌中的功能仍不清楚,Conte等研究者通过后续实验研究了Plin2在肌肉中的作用,实验数据表明Plin2是控制肌肉质量的关键介质。Vasuri F等[19]的研究发现Plin2表达随年龄增长而增加,以Plin2包被的脂质滴形式存在于骨骼肌中的脂肪沉积会随着年龄的增长而增加,并且与肌肉强度和厚度的降低有关,其机制可能是通过IGF-1和p53依赖性调控的[20]。
本研究采用非标记定量蛋白质组学技术并结合文献阅读筛选出己糖激酶2、驱动蛋白样蛋白22、cAMP调节的磷酸化蛋白19和脂滴包被蛋白2等可能在miR-381-3p介导肌-骨系统代谢过程起到调控作用的特异性靶蛋白。课题组后续研究将综合miR-381-3p在成肌细胞中的蛋白质谱检测数据,综合分析miR-381-3p在成骨细胞和成肌细胞中蛋白质与蛋白质相互作用网络关系以便发现肌少-骨质疏松症密切联系的共同转录因子。并且在本实验蛋白质组学筛选数据的基础上课题组后续开展重要靶蛋白与相关的信号通路信息的干预处理及机制分析,针对有特定意义的蛋白将通过动物基因敲除及细胞层面的荧光素酶报告基因验证,以更好地说明所鉴定到的靶蛋白在研究肌少-骨质疏松症疾病发生、发展中的意义。
