宫颈浸润性复层产黏液性癌1例临床病理分析及文献复习
2022-03-08孙国敏张琴琴巫永志徐国祥刘银华
孙国敏,张琴琴,巫永志,徐国祥,刘银华
(皖南医学院第一附属医院 弋矶山医院 病理科,安徽 芜湖 241001)
宫颈浸润性复层产黏液性癌(invasive stratified mucin-producing carcinoma,ISMC)由Lastra等提出并命名[1],其认为ISMC为复层产黏液性上皮内病变(stratified mucin-producing intraepithelial lesion,SMILE)的侵袭性形式。SMILE在2000年由Park等首次提出[2],在女性生殖系统肿瘤中被WHO分类于宫颈原位腺癌(adenocarcinoma in situ,AIS)亚型[3]。有学者认为,宫颈浸润性鳞癌的前驱病变是高级别鳞状上皮内病变(high-grade squamous intraepithelial lesion,HSIL),而浸润性腺癌的前驱病变则是AIS[4-5]。2018年国际子宫颈腺癌分类标准(IECC)将ISMC归为HPV相关黏液型腺癌[6]。现将弋矶山医院的1例ISMC报道如下,对该患者的临床病理资料进行分析,并学习总结相关文献,提高病理医生对该疾病的认知。
1 资料与方法
1.1 临床资料 患者女性,51岁,因不规则子宫出血5月余就诊。盆腔核磁共振检查显示宫颈重度糜烂,其余未见明显异常。于宿松县人民医院行宫颈活检+诊刮术,为进一步治疗,2021年3月于我院行广泛全子宫+双侧附件+所属淋巴结切除。
1.2 方法 标本经10%中性福尔马林液固定后,常规脱水、石蜡包埋、厚度为4 μm的切片、HE染色及免疫组化染色,最后在显微镜下观察。一抗试剂均购自福州迈新生物技术开发有限公司。特殊染色项目为黏液卡红(PAS)及阿辛蓝(AB)。结果判定阳性表达物质为棕色,P16、P40、P63及Ki67均为细胞核阳性,CK7及CK5/6细胞质阳性,CEA细胞膜/质阳性;肿瘤细胞着色定义为阳性,无着色则为阴性。
2 结果
2.1 肉眼观察 广泛全子宫+双侧附件+所属淋巴结切除标本,宫颈6~12点见一溃疡凹陷区,面积2.8 cm×2.1 cm(图1)。

图1 ISMC大体图像
2.2 镜检 低倍镜下,肿瘤呈浸润性生长并伴有促纤维结缔反应;高倍镜下,瘤细胞排列成复层实性巢状或假腺腔样(图2A);宫颈鳞柱移行区鳞状上皮示细胞层次增多、极性紊乱,细胞圆形或卵圆形,胞质嗜酸性;部分区域胞质内含淡蓝色黏液及空泡(图2B);细胞核异型性明显,可见核分裂象及凋亡小体(图2C);癌巢周围可见浆细胞、淋巴细胞及中性粒细胞浸润。
2.3 免疫表型 瘤细胞CEA、P16、CK7及CK5/6弥漫阳性(图2D),P40及P63均呈基底部细胞核阳性(图2E),Ki67约50%阳性。
2.4 特殊染色 PAS及AB均显示少数肿瘤细胞阳性(图2F)。
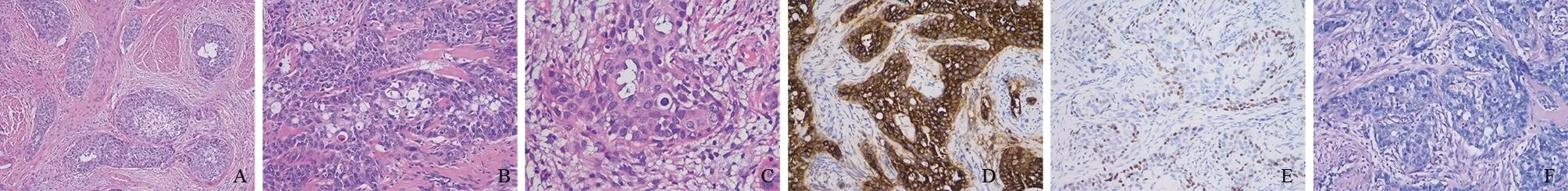
A.瘤细胞呈浸润性生长,排列成实性巢团状、假腺腔样,并伴有促纤维结缔反应(HE,×100);B.部分区域胞质内含黏液及空泡(HE,×400);C.病灶中可见凋亡小体及核分裂象(HE,×400);D.CEA呈弥漫强阳性(×200);E.P40呈局灶基底细胞核阳性(×200);F.PAS黏液染色示肿瘤细胞胞质中含少量黏液(×200)。
3 讨论
3.1 临床特征及流行病学 目前国内外有关ISMC个案报道20余例,国内对于该疾病的首次个案报道由于丽丽等[7]在2017年发表。根据目前相关文献总结:ISMC患者的发病年龄为34~66岁,平均年龄44.9岁;其临床表现多为不规则阴道出血或细胞学检查异常。本研究患者51岁,因异常阴道出血而就诊。
3.2 病理特点 ISMC可伴有SMILE、HSIL或AIS等上皮内病变,也可与其他类型的癌共存[1,8]。其表现为“非鳞亦非腺”的生长模式,瘤细胞呈巢团状、实性片状及筛孔样生长;癌巢内细胞排列成复层,癌巢周围细胞则排列成栅栏状。胞质丰富含黏液,根据黏液量的不同可分为黏液细胞丰富型和少黏液细胞型。细胞核深染,可见核分裂象及凋亡小体。大多数的病例中病灶内可见中性粒细胞浸润[1]。本研究患者最终诊断为ISMC,少黏液细胞型;周边部分区域呈高级别上皮内病变(CINⅢ),累及腺体。本研究患者未行HPV检测,故无法与文献所提及的数据进行比较。
3.3 免疫组化、特殊染色及电镜特征 ISMC与SMILE的免疫组化表达类似,肿瘤细胞P16、CK7、CEA呈弥漫强阳性,增殖指数较高。P40、P63常常不表达或表达仅局限于基底部,CK5/6阴性或者仅局灶弱阳性[8-9]。IMP3(胰岛素生长因子Ⅱ蛋白的一个成员)在ISMC中部分区域阳性表达数为3/3,而在SMILE中的表达数则为9/12[9],这表明IMP3的表达可能有助于反应性/良性病变、上皮内病变以及浸润性癌的鉴别诊断,但对于IMP3在ISMC中的表达情况仍需要进一步研究[3]。PAS和AB染色可显示胞质中的黏液[9-10]。本研究患者免疫组化表达与文献报道相符,比较有特点的是P40及P63在癌灶周边与间质交界处形成点灶状阳性,似勾露出癌灶的形状;而在癌灶中央区的表达却为阴性,这一表现也提示ISMC没有鳞状上皮分化。同时,对于超微结构的研究,Onishi等[8]发现,SMILE和ISMC的瘤细胞有丰富的线粒体和表面微绒毛,但缺乏张力丝,提示ISMC与宫颈腺癌关系更密切,但由于研究例数过少,具体结果有待于进一步证实。
3.4 鉴别诊断 ①腺鳞癌:该肿瘤形态学上同时具有腺癌和鳞癌的成分,如分化良好的腺腔及细胞间桥、角化珠等,且两种成分均不少于10%。免疫组化特征性表达腺癌及鳞癌的标记,如鳞癌区域P40及P63弥漫强阳性表达。②腺样基底细胞癌:该肿瘤由基底样细胞组成,呈管状、巢片状或筛状。胞质内无黏液以及P40、P63弥漫阳性可与ISMC鉴别。③伴少许黏液细胞的鳞状细胞癌:明显的鳞癌成分及表达鳞状上皮标记可与之鉴别,且黏液细胞多呈局灶分布;免疫组化显示P40、P63及CK5/6弥漫阳性[7-11]。④其余需要鉴别的疾病:腺样基底细胞癌、黏液表皮样癌、腺样囊性癌及黏液性癌(印戒细胞型)等[9]。
3.5 治疗与预后 ISMC的治疗方法与其他浸润性宫颈癌的治疗方法相似[1],一般以根治性手术切除为主,术后依据临床分期选择辅以放、化疗或者生物治疗等[12]。根据肿瘤的浸润深度、大小、有无脉管内癌栓及淋巴结转移、远处转移等判断疾病的预后。由于目前对于ISMC的报道病例数有限,具体的治疗方案及预后随访有待于进一步更新[9]。本研究患者按照浸润性宫颈癌的治疗方法,行广泛性全子宫+双侧附件+淋巴结清扫,目前患者已随访4个月,情况良好,继续随访中。
