支气管镜管腔内活检出血风险与肺癌患者血脂水平的相关性研究
2022-03-08汪向海王寒黎陈兴无
汪向海,王寒黎,邢 敏,陈兴无
(皖南医学院第一附属医院 弋矶山医院 呼吸内科,安徽 芜湖 241001)
肺癌患者是支气管镜检查的主要对象。目前,支气管镜管腔内活检(endobronchial biopsy,EBB)在支气管内外生性病变的组织病理学诊断中是必不可少的[1]。EBB被用于诊断肺部疾病已有40多年的历史,并且至今仍是最广泛使用的活检方式之一[2]。但是,出血是EBB的常见并发症。恶性病变比良性黏膜病变更容易在活检时出血[3]。肺癌患者的EBB出血率超过30%[4],EBB引起的大量出血可能会危及生命[5]。EBB过程中出血的危险因素包括有创机械通气、免疫抑制、血小板减少、使用抗凝剂或抗血小板药物、严重的肝肾疾病、心力衰竭和肺动脉高压[5-6]。然而,这些危险因素是否与EBB出血有关仍有待探讨[7]。多项研究表明,患者血脂异常与蛛网膜下腔出血[8]、高血压性脑出血[9]、淀粉样血管病和血管性痔疮[10]的风险增加有关。这些疾病的出血风险增加,可能归因于患者血脂表达异常。目前尚未有研究报道血脂水平与肺癌患者EBB出血风险之间的关系。因此,本研究的目的是探讨血脂水平与肺癌患者EBB出血风险之间的关系。
1 资料与方法
1.1 研究对象 对2019年2月~2021年2月在弋矶山医院接受EBB确诊为肺癌患者的病历进行回顾性分析。入选标准:①接受管腔内活检的支气管内外生性病变患者;②被诊断患有原发性肺癌的患者。具有以下危险因素的患者被排除在研究之外,包括出血倾向、活动性出血、血小板<50×109/L、持续抗凝或(和)抗血小板治疗、严重肝肾疾病、心力衰竭、机械通气、肺动脉高压、肺移植。
将患者分为两组:出血组(在EBB期间或术后接受止血操作的患者)和非出血组(在EBB期间和术后不需要进行止血操作或未出血的患者)。收集以下详细信息:年龄,性别,收缩压(systolic blood pressure,SBP),舒张压(diastolic blood pressure,DBP),病变位置(中心气道为气管、左主支气管、右主支气管;周围支气管为左、右肺叶支气管),组织学类型,TNM癌症分期(Ⅰ和Ⅱ期为早期,Ⅲ和Ⅳ期为晚期),合并症[慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)、冠心病(coronary heart disease,CHD)、高血压和糖尿病]。血液检查包括总胆固醇(cholesterol total,CHOL)、甘油三酯(Triglycerides,TG)、低密度脂蛋白(low density lipoprotein cholesterol,LDL)、高密度脂蛋白(high density lipoprotein cholesterol,HDL)。
1.2 研究方法 支气管镜检查在2%利多卡因局部麻醉下进行。在EBB过程中,使用活检钳对每位患者在病变的相同位置进行3~5次活检,但是在第1次活检后支气管内病变明显出血时,仅进行1次活检。术中给予稀释的肾上腺素和术后给予酚磺乙胺、氨甲苯酸等药物止血。
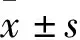
2 结果
2.1 一般情况 在连续的106例患者中,有41例在EBB期间出血,并且进行了止血操作(术中给予稀释的肾上腺素和术后给予酚磺乙胺、氨甲苯酸等药物)。65例没有记录到严重出血的情况。非出血组的血清LDL、CHOL水平高于出血组,差异均有统计学意义(P<0.01),见表1。

表1 106例患者的基本特征
2.2 多因素Logistic回归分析 根据单因素分析结果,按照P<0.10的标准,共有2个变量进入多因素Logistic回归模型。结果显示,CHOL升高(OR=0.161,95%CI:0.073~0.353)可能是EBB出血的保护因素(P<0.05),见表2。
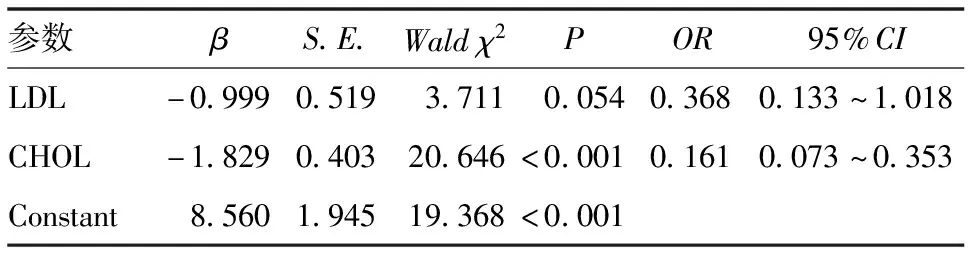
表2 EBB出血风险多因素Logistic回归分析
2.3 利用广义可加模型评估CHOL与EBB出血之间的非线性数量关系 随着CHOL水平的增高,EBB出血的风险逐渐下降(P<0.01,图1)。
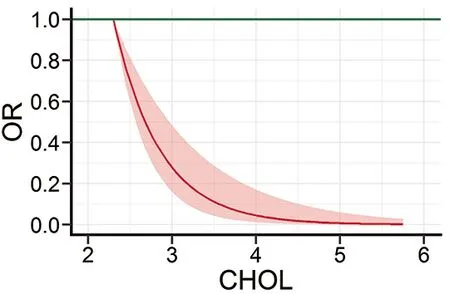
图1 EBB出血风险与CHOL水平之间的关联
2.4 ROC曲线分析CHOL预测EBB出血的灵敏度与特异度 CHOL作为预测指标,其截点值为3.45 mmol/L,ROC曲线下面积为0.83(95%CI:0.76~0.91),灵敏度为70.73%,特异度为75.38%,表明CHOL可作为EBB出血较好的预测因子,见图2。
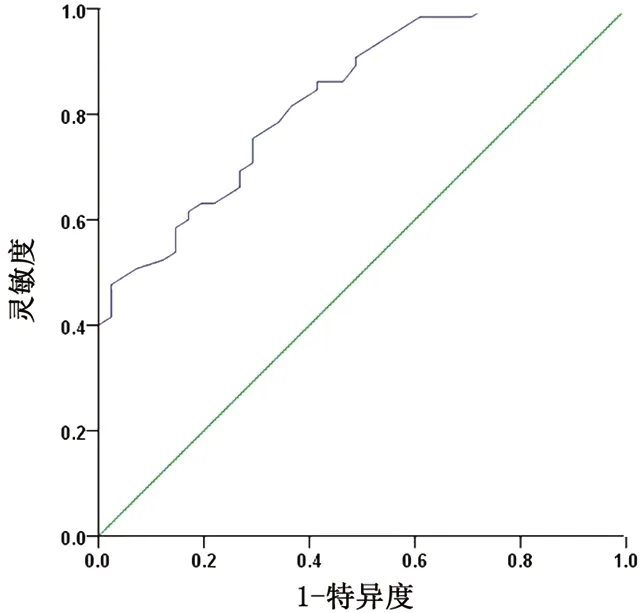
图2 CHOL水平预测EBB出血风险的ROC曲线
3 讨论
出血是支气管镜检查期间最常见的并发症,尤其是在进行EBB时。与良性黏膜病变相比,活检时恶性病变更容易出血,EBB术后更可能发生大量失血[11-12]。临床中已发现了一些与支气管镜检查出血有关的危险因素,包括免疫抑制、机械通气、高血压控制不佳、严重的肺动脉高压、血小板减少症、抗凝药和抗血小板药、肺移植、心力衰竭、肝肾疾病和出血倾向。然而,这些危险因素大多数缺乏直接支持证据,迄今为止尚无有效的指标可预测EBB引起出血的风险。
已有研究表明人体脂蛋白代谢在某些出血性疾病中起作用,例如高血压脑出血和蛛网膜下腔出血。血脂异常与淀粉样血管病和血管破裂的风险增加有关,会影响神经系统疾病中异常血管的形成[8-9]。此外,血脂会影响免疫调节和氧化状态,这可能与颅脑外伤和出血后的神经系统预后不良有关。
为了更清楚地了解EBB过程中出血的风险,我们研究了EBB诱发的肺癌患者出血。本研究表明,随着CHOL水平的升高,EBB期间出血的风险逐渐下降,当CHOL<3.45 mmol/L时,肺癌患者EBB出血风险增加,为了降低EBB引起的出血风险,在对肺癌患者进行EBB之前,建议维持血脂在正常范围的较高水平。多因素Logistic回归分析表明,CHOL与EBB出血关系密切,较低的CHOL提示有较高的EBB出血风险。EBB出血时CHOL如何参与其中我们尚不明确,可能CHOL是合成动脉管壁的重要成分之一,高CHOL有助于维持血管的结构完整性,如果其水平偏低则血管壁较薄,弹性降低,管腔内活检时易出血。有研究表明,患者CHOL过低易发生脑出血而引起住院病死率增加,稍高的CHOL反而有更低的出血性卒中率[13]。CHOL过低可引起机体产生特异性抗体,激活补体系统,并诱导发生一系列免疫反应,造成血管壁损伤。ROC曲线分析表明,CHOL可作为EBB出血风险预测因子有一定准确性,这与既往血脂异常与脑出血关系的研究结果相似[14]。
本研究揭示了肺癌患者血脂水平与EBB出血风险之间的关系。但是,本研究存在一些局限性。首先,在支气管镜检查中准确测量出血量仍然是一个挑战。在本研究中,我们无法提供活检引起的出血量的定量测量。将患者分为出血组或非出血组,仅基于他们在EBB期间是否接受过止血操作。因此,这种分类可能无法将出血最少的患者准确分组。其次,样本有限,以后将扩大样本量进一步展开前瞻性研究和基础研究,以全面评估其临床价值和涉及的机制。
总之,本研究表明,CHOL是EBB活检出血的保护因子,本研究揭示了CHOL与EBB出血的关系,可能对支气管镜检查之前的风险评估和预防EBB出血有所帮助。
