基于肠道菌群优化的当归芍药散抗AD的实验研究
2022-03-08庞振振杨玉芳洪宗元钟树志
庞振振,许 萍,杨玉芳,洪宗元,钟树志
(皖南医学院 1.组织学与胚胎学教研室;2.药理学教研室,安徽 芜湖 241002)
阿尔茨海默病(Alzheimer disease,AD)是以认知功能下降为主要临床表现的神经退行性疾病。AD的发病机制错综复杂,目前认为脑内Aβ沉积造成的神经元损伤和死亡是导致患者认知损害的根本原因。有研究表明,调节肠道菌群可以降低AD的风险并且能够减缓AD的进展[1];APP/PSN转基因小鼠肠道菌群与正常小鼠存在显著差异[2]。当归芍药散(Danggui Shaoyao San,DSS)可通过抗炎、抗氧化等作用,减少海马细胞的凋亡和保护神经元,改善AD大鼠的认知能力[3-4],DSS能否通过改善AD小鼠肠道菌群,发挥抗AD作用,目前未见报道。本研究拟对APP/PSN双转基因AD小鼠予以DSS灌胃,探究DSS对AD小鼠基于肠道菌群改变的认知功能改善机制。
1 材料与方法
1.1 动物与分组 2月龄APP/PSN转基因小鼠48只,体质量(25±3)g,购于南京大学模式动物中心[许可证号:SCXK(苏)2019-0001],适应性喂养1周后,随机分为AD模型组和DSS高、中、低剂量用药组,每组12只,用药组每天分别给予DSS 0.3 g/10 g、0.15 g/10 g、0.075 g/10 g剂量灌胃,连续给药2个月,另取SPF级2月龄、体质量(25±3)g C57BL/6小鼠12只[购于长沙市天勤生物技术有限公司,许可证号:SCXK(湘)2019-0014]作为正常对照,分笼饲养,保持12 h昼夜节律,室温(22±1)℃,自由进食饮水。实验动物喂养与使用均遵守实验动物学会《实验动物饲养与管理指南》。
1.2 主要试剂 Aβ1-42购自Sigma公司(批号BA0762)。DSS(每100克含当归13.6 g、白芍18.2 g、白术18.2 g、川芎13.6 g、茯苓18.2 g、泽泻18.2 g)购自芜湖北京同仁堂大药房,常规煎煮、浓缩、干燥制成浸膏粉,使用时用双蒸水配成相应浓度溶液,用药剂量根据成人每日用量换算,按生药量计。
1.3 Morris水迷宫实验 给药结束后进行Morris水迷宫实验,具体方法参照文献[5]。
1.4 Western blot检测小鼠脑海马区Aβ1-42 水迷宫实验结束后,小鼠颈椎脱臼处死,冰上取脑并分离海马组织,剪碎裂解后离心提取组织总蛋白,金属浴加热8 min,使蛋白充分变性,垂直电泳槽上样电泳,转膜后4℃一抗孵育过夜,TBST洗2次,每次15 min。二抗孵育后,放入PVDF膜封口,摇床摇动2 h,TBST洗2次,将显色工作液直接滴在膜上,显色时间3~10 min,扫描胶片并采用ImagJ软件进行半定量分析。
1.5 16S rRNA基因高通量测序 取各组小鼠肠内容物于离心管离心,收集肠道细菌DNA上清液。PCR扩增细菌16S rDNA产生DNA簇,将DNA解为单链并加入带有4种荧光标记的dNTP的DNA聚合酶,激光扫描读取每条单链模板序列聚合的核苷酸种类,切割“荧光基团”和“终止基团”,恢复3′端黏性,以此类推每次循环合成一个碱基;统计每轮收集到的荧光信号结果,获知模板DNA片段的序列。然后对序列进行质控过滤,再行拼接,拼接后的序列再次进行质控过滤,最终得到优化序列,然后进行OTU聚类分析和物种分类分析,对OTU进行多种多样性指数分析(alpha多样性分析)、群落结构统计分析。
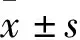
2 结果
2.1 DSS对AD模型小鼠认知功能的影响 如表1所示,与正常对照组相比,AD模型组小鼠在第1~7天寻找平台潜伏期均延长(P<0.01);与AD模型组相比,DSS中、高剂量用药组小鼠第1天寻找平台潜伏期均缩短(P<0.01);DSS各剂量用药组小鼠在第2~7天寻找平台时间均缩短(P<0.01)。如表2所示,与正常对照组相比,AD模型组小鼠在第1~7天目标象限逗留时间均缩短(P<0.01);与AD模型组相比,DSS低剂量用药组小鼠在第3、7天目标象限逗留时间均延长(P<0.05);DSS中、高剂量用药组小鼠在第1~7天目标象限逗留时间均延长(P<0.05)。

表1 DSS对AD小鼠在水迷宫实验中逃避潜伏期的影响

表2 DSS对AD模型小鼠在水迷宫实验中空间探索实验的影响
2.2 DSS对AD模型小鼠海马组织Aβ1-42表达的影响 如图1所示,与APP/PSN(+)+DSS(-)组相比,APP/PSN(+)+DSS(+)各剂量组和APP/PSN(-)+DSS(-)组Aβ1-42蛋白表达量均下调(P<0.05)。

与APP/PSN(+)+DSS(-)组比较,F=46.631,P=0.000。
2.3 DSS对AD模型小鼠肠道菌群结构的影响 由各组小鼠肠道菌群门、科水平热图(图2Ⅰ、Ⅱ)和门、科水平构成比柱状图(图2Ⅲ、Ⅳ)可知,AD模型组小鼠与正常对照组小鼠肠道菌群有显著改变,DSS用药组与AD模型组也有明显不同。如表3所示,正常对照组、AD模型组和用药组的厚壁菌门、拟杆菌门、乳杆菌科、胃瘤菌科、毛螺菌科、拟杆菌科和幽门螺杆菌间丰度差异均有统计学意义(P<0.05)。
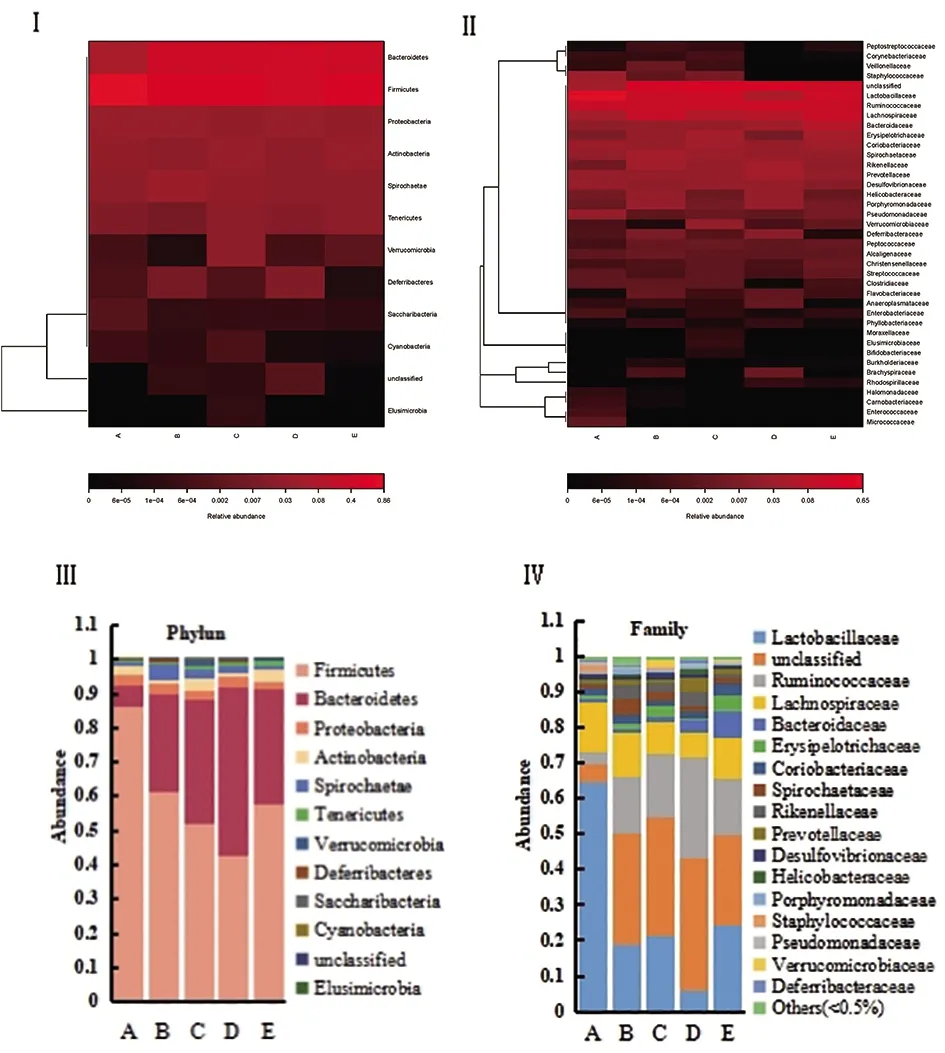
Ⅰ.各组小鼠门水平肠道菌群热图;Ⅱ.各组小鼠科水平肠道菌群热图;Ⅲ.各组小鼠门水平肠道菌群柱状图;Ⅳ.各组小鼠科水平肠道菌群柱状图。A.DSS高剂量用药组;B.DSS中剂量用药组;C.DSS低剂量用药组;D.AD模型组;E.正常对照组。

表3 DSS对AD模型小鼠肠道菌群丰度的影响
3 讨论
肠道微生物种群繁多,它们共生并相互作用,有些菌群可代谢肠道内物质,影响营养物质的消化和吸收,有些肠道菌群可通过释放代谢物质,进入血液,或与肠作用,影响人体多系统的生理机能。有研究表明,AD患者肠道菌群有显著改变。
本研究也证实,APP/PSN转基因AD模型小鼠肠道菌群与正常对照组有显著改变,AD模型小鼠肠道厚壁菌门、乳杆菌科、毛螺菌科丰度显著降低,拟杆菌、胃瘤菌科、幽门螺杆菌丰度显著升高;经DSS治疗后,小鼠肠道厚壁菌、乳杆菌、毛螺菌丰度显著升高,拟杆菌、胃瘤菌科、幽门螺杆菌丰度显著降低。DSS用药后,小鼠肠道菌群的改变多数具有剂量依赖性,但DSS对于乳杆菌和幽门螺杆菌的作用,低剂量反而比中剂量效果更明显,这可能与小鼠肠道菌群的个体差异以及统计的样本量过少有关(统计的样本数为3)。抑制肠道有害菌、促进益生菌生长,可能是DSS降低APP/PSN转基因小鼠脑内Aβ1-42水平,提高AD小鼠的认知能力的机制之一。
拟杆菌为革兰阴性、无芽孢、专性厌氧菌,种类庞杂,是肠道炎症、败血症的致病菌。有研究显示胃瘤菌与结肠炎的发生密切相关[6]。幽门螺杆菌可导致胃溃疡和胃癌[7],亦有研究显示,幽门螺杆菌可通过口-鼻-嗅觉途径进入大脑,引发神经变性,影响阿尔茨海默病的病程[8]。另有研究证实,幽门螺旋杆菌滤液能抑制海马树突棘成熟、增加海马和皮质中的Aβ1-42沉积、增加早老素-2水平,降低大鼠的认知功能[9]。幽门螺旋杆菌感染还能诱导免疫应答,由于共享同源表位与神经产生交叉反应,从而使神经退行性疾病的凋亡神经组织损伤永久化,包括AD[10]。本研究表明,DSS通过降低拟杆菌等有害菌在肠道的丰度,减轻有害菌对肠壁屏障的损伤,从而减少内毒素等有害物质进入血液和脑组织,减轻神经损伤,改善认知功能。
毛螺菌可产生短链脂肪酸,可产生短链脂肪酸的菌群水平和机体认知功能呈正相关[11]。有研究显示肠道乳酸菌的次级代谢产物有γ-氨基丁酸,并可能通过影响神经元突触释放神经递质或影响血脂水平发挥神经元保护作用[12]。也有研究证实,益生菌可以通过抑制三甲胺-N-氧化物的合成来缓解AD症状,降低海马Aβ的水平,保护神经元的完整性和可塑性[13]。
综上所述,DSS可能通过升高小鼠肠道厚壁菌、乳杆菌、毛螺菌等益生菌丰度,降低肠道拟杆菌、胃瘤菌、幽门螺杆菌等有害菌丰度,调节肠道菌群,从而下调AD模型小鼠海马区Aβ蛋白表达,改善AD模型小鼠的认知功能。DSS是通过方中多种成分发挥作用,还是某一特定药物单体发挥作用尚需进一步研究。
