常压下乙醇-空气-水汽液平衡常数的测定
2022-03-08陈志磊张秋香
陈志磊,赵 培,张秋香
(华东理工大学 化工学院,上海 200030)
乙醇作为经典绿色的有机中间体,在国防工业、医疗卫生和有机合成等产业都有广泛应用。目前乙醇需求量激增,我国乙醇产能出现紧缺[1],亟需寻求乙醇回收并循环再生的方法以增大产能。在制药、印刷和酿酒行业的生产过程中会产生大量乙醇蒸汽,如果对这部分乙醇加以回收,可避免溶剂损失和对环境造成安全隐患,因此回收空气中的乙醇极为重要。
工业上一般使用水吸收尾气中的乙醇,此时乙醇从汽相传质进入液相,再通过精馏或解吸的方法得到高浓度乙醇[2]。乙醇回收领域的精馏过程十分成熟,Kolbe等[3]已测得大量汽液平衡数据,可知常压(101.3 kPa,下同)下物质的量分数为0.891的乙醇与水在78.17 °C形成共沸物。Tsanas等[4]使用一定浓度1-丁基-3-甲基咪唑溴盐([BMIM][Br])、1-乙基-3-甲基咪唑溴盐([EMIM][Br])等离子液体作为萃取精馏的萃取剂,消除共沸,用于制备无水乙醇。但是以上数据是基于二元汽液平衡的实验方法,未考虑空气对体系平衡的影响,所以无法适用吸收过程。而吸收过程作为提高总回收率重要一环,直接影响该过程的乙醇-空气-水的平衡,相关数据尚未见报道,因此吸收平衡常数的测定对乙醇回收领域有重要研究意义。此外,市面上的汽液平衡装置以改进ROSE釜[5-7]为原型的汽液循环釜为主,无法对含有不凝性气体空气的多元体系进行平衡分析。
本文创新设计了适用于测定乙醇-空气-水体系汽液两相平衡的玻璃仪器来测定常压下不同温度的乙醇-空气-水的汽液两相平衡数据。基于此,比较Wilson、NRTL和UNIFAC模型与实验结果的的关联程度,使用Van Ness 点检验法的热力学一致性检验来验证实验数据的可靠性,并对吸收平衡常数与液相乙醇物质的量分数和温度的关系进行拟合,以得到平衡常数经验公式,为水吸收空气中的乙醇提供基础数据。
1 实验部分
1.1 试剂与仪器
无水乙醇,分析纯,纯度> 99.9%,上海泰坦科技股份有限公司;蒸馏水。
磁力搅拌器;250 μL阀门型气体取样针,上海高鸽工贸有限公司;精度0.1 mg电子天平,上海卓精电子科技有限公司。
1.2 实验装置
流动法和循环法是测定汽液平衡数据的普遍方法[8],但此类方法无法测定含有空气这一不凝性气体组成的平衡常数。吸收过程的平衡常数与操作的温度、压力和液相物质的量分数有关,实验过程保持常压,分别在不同温度下对不同液相浓度的体系进行分析,无需测量泡点温度,所以采用改进静态法进行分析,该方法具有平衡釜易制造、耐压且密封问题较易解决的优点,测量体系又无需真空脱气。本次实验对恒体积平衡釜进行了改造,定制如图1所示的实验装置。
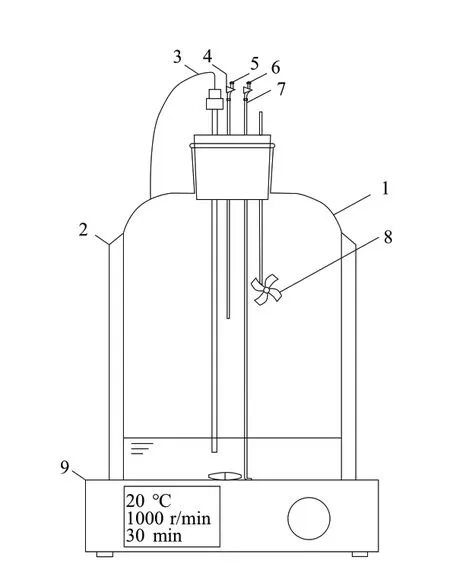
图1 汽液平衡釜示意Fig. 1 Schematic diagram of vapor-liquid equilibrium kettle
1.3 实验方法
平衡釜处于干燥状态,夹住乳胶管检查密封。从毛细管注入一定量的无水乙醇,注入无水乙醇的质量由注射器前后质量差计算得到;然后注入一定量的水,注入水的质量由注射器前后质量差计算得到,即配制成一定物质的量分数的乙醇溶液。为提高数据的准确性与适用性,将液相控制在中低浓度,模拟吸收过程的吸收液浓度。关闭夹子,打开磁力搅拌器使温度稳定在相应的实验温度,打开转子与风扇,增大汽液扰动,构成釜内汽液双循环,加快瓶内汽液平衡并使汽相混合均匀。约30 min后,分别用预热的1 μL微量进样器与250 μL阀门型气体进样针从液、汽相取样口分别抽取0.8 μL液相与200.0 μL的汽相,并连续抽取3次,将第3次样品送气相色谱分析。然后再分别取样若干次,相对标准偏差小于5%,计算平均值。改变液相物质的量分数与温度进行下一组实验。
1.4 分析方法
分析仪器采用舜宇恒平GC1120气相色谱。文献[9,10]使用外标法检测空气中乙醇含量,色谱柱为毛细管柱,用FID检测器。但对于溶液中含有大量的极性无机物水,会破坏毛细管柱中的极性填充物,且FID对无机物无响应,所以本次实验使用非极性的填充柱和TCD检测器进行检测,归一化法定量分析。两相乙醇的分析参数如表1所示。

表1 气相色谱分析参数Table1 Analysis parameters of gas chromatography
1.5 装置校验
为了验证汽液平衡装置的准确性,使用图1所示装置测定了丙酮-空气-水体系的汽液平衡数据,并与文献[11]数据比较,结果如图2所示,其中,x2为液相丙酮物质的量分数,y2为汽相丙酮物质的量分数。由图2可知,测得丙酮-空气-水体系在常压下的平衡数据与文献数据吻合较好,表明该装置测定汽液平衡数据具有较好准确性。
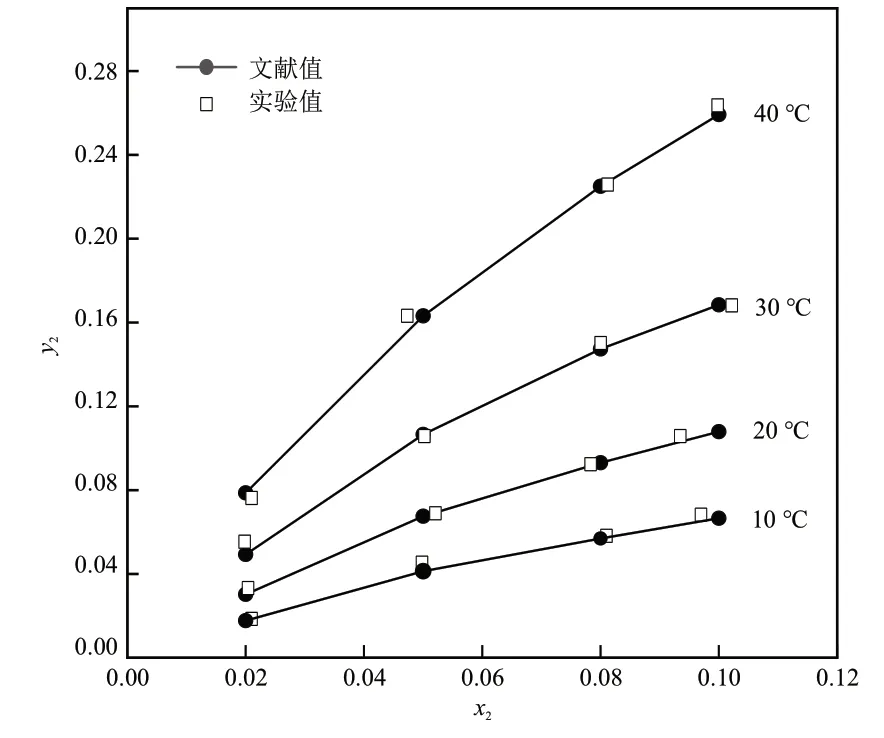
图2 常压下丙酮-空气-水体系中丙酮的y-x图Fig. 2 y-x diagram of acetone in acetone-air-water system at atmospheric pressure
2 实验结果与分析
2.1 气相色谱分析
2.1.1 汽相外标曲线测定
分别配制10组低物质的量分数的标准混合气,取200.0 μL气体进样,测定峰面积,每个物质的量分数重复测定3次,线性拟合图如图3所示。图中y1表示汽相乙醇的物质的量分数,线性拟合方程为y=3.0225 × 10-7x- 0.0015,R2= 0.9980,可知拟合程度好。变异系数(标准偏差与平均值之比)在4.62%~7.98%之间。同组数据离散程度小,实验数据重复性高。
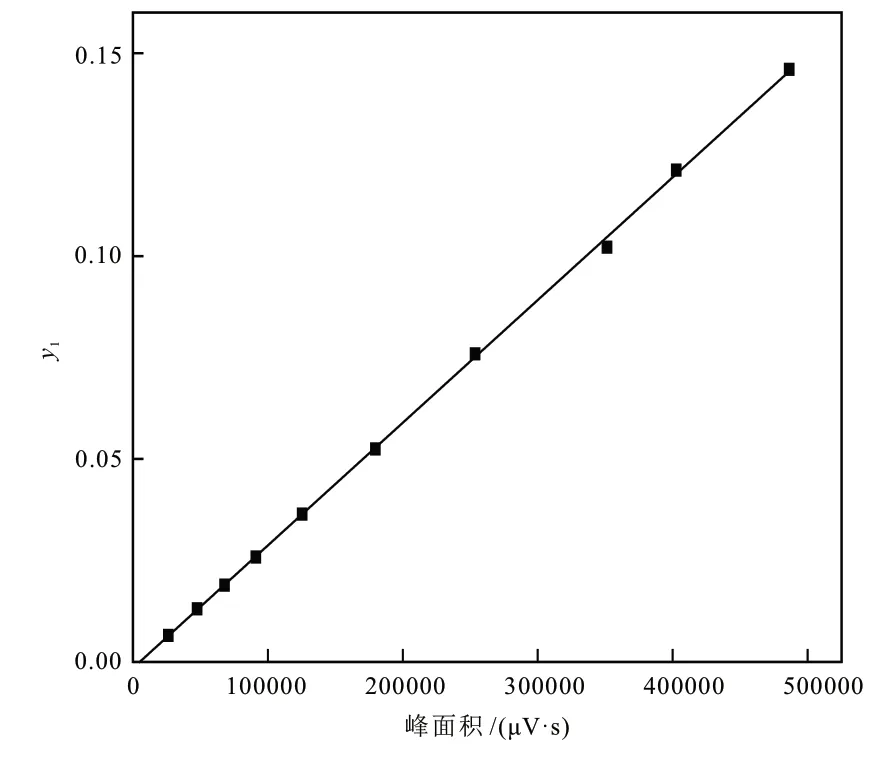
图3 汽相乙醇标准曲线Fig. 3 Standard curve of ethanol in vapor phase
2.1.2 液相校正因子测定
气相色谱的绝对校正因子公式如式(1)所示。

式中,A为色谱峰面积,μV·s;f为校正因子;w为质量分数;下标1代表乙醇,2代表水。
用乙醇和蒸馏水配制不同质量分数的标液,测定峰面积比,如图4所示,以A1/A2为x轴、w1/w2为y轴作图,将数据回归到一条直线,斜率即为f1/f2。通过式(2)计算得到乙醇的质量分数。
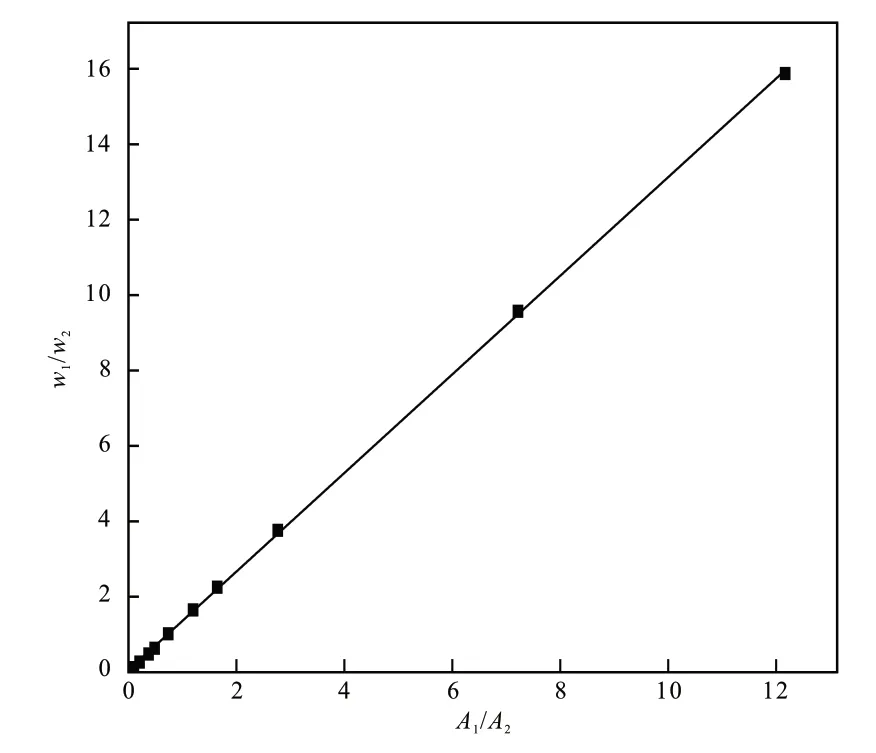
图4 乙醇-水溶液校正因子Fig. 4 Response factors of binary system ethanol-water
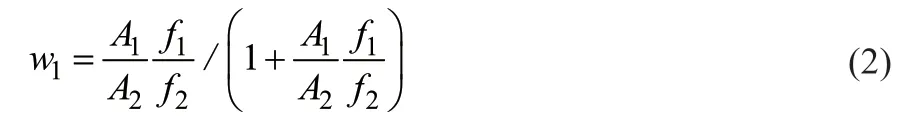
根据计算得到线性拟合方程为y= 1.3074x+0.05269,R2= 0.9998,可知拟合程度好,乙醇和水的校正因子f1/f2为1.3074。
2.2 相平衡数据测定结果
根据上述实验与分析方法,常压下乙醇-空气-水汽液平衡原始数据及处理结果如表2所示,其中,t为液相温度,°C;m为吸收平衡常数。由表2可知,乙醇极易溶于水,在空气中的物质的量分数远小于溶液中的物质的量分数。吸收平衡常数小,随温度变化敏感呈指数型正相关,与液相物质的量分数变化呈对数型负相关,吸收过程为气相阻力控制。保持吸收过程低温和吸收剂低浓度对提高回收率有重要意义。
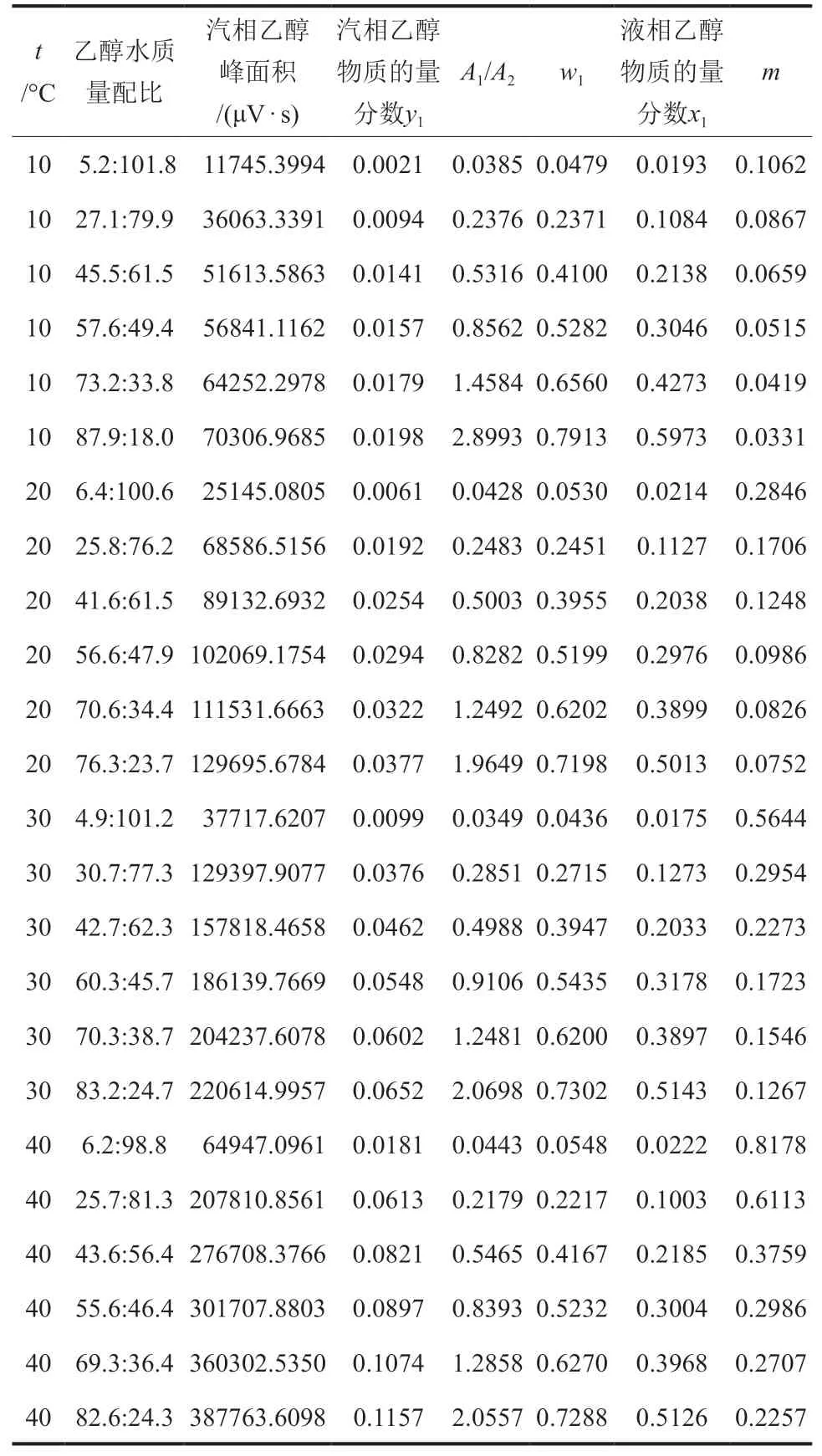
表2 常压下乙醇-空气-水体系的汽液平衡实验数据Table 2 Experimental data of phase equilibrium of ethanolair-water system
2.3 热力学模型关联与分析
对于乙醇、水这样强极性的非理想体系,活度系数模型比状态方程法更适用。选用Wilson、NRTL和UNIFAC活度系数模型关联。Wilson模型基于局部组成概念,适用于醇、酮、醚以及含水互溶溶液,但不能用于部分互溶体系。NRTL模型与Wilson模型有大致相同的适用范围与预测精度,并可用于互溶体系的液液平衡。UNIFAC模型是将集团贡献法应用于UNIQUAC模型建立起来的,通用性好[12]。
系统总压强为101.3 kPa,属于中低压,汽相可视为理想气体。20 °C时,空气微溶于溶液,换算成物质的量分数约为1.502 × 10-5,且随着吸收放热的温度越高,溶解度越小,对比乙醇液相物质的量分数可忽略不计。假设液相为乙醇-水二元溶液,溶液表面气膜组成近似二元汽液平衡。汽相由液相组分平衡蒸汽与空气混合而成,遵守道尔顿分压定理,则汽相乙醇的物质的量分数可表示为如式(3)所示。

式中,p为乙醇蒸汽在汽相平衡分压,kPa;p为系统总压强,kPa。
由活度系数法计算汽液平衡关系,如式(4)所示。
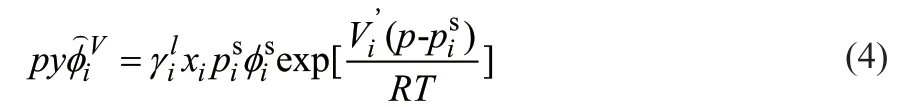
式中 为混合物中组分i的逸度系数; 为组分i的活度系数;xi为液相组分i的物质的量分数;为组分i的饱和蒸汽压,kPa;为纯饱和蒸汽i在温度t、压力 下的逸度系数;Vi’为偏摩尔体积,m3/mol;R为摩尔气体常数,8.314 J/(mol·K);T为温度,K。
常压下,上式可简化为如式(5)所示。

联立式(3)与式(5),吸收平衡常数表示为如式(6)所示。

Aspen物性数据库为活度系数模型提供了大量内置的二元交互参数,Wilson、NRTL和UNIFAC模型活度系数公式与模型参数如表3所示[13]。使用Analysis功能可快速准确模拟计算各个物性方法下,不同实验温度和物质的量分数的乙醇平衡分压,代入式(3)与式(6),得出与空气混合后的汽相物质的量分数和吸收平衡常数,并与实验数据进行比较,结果如表4和图5所示。
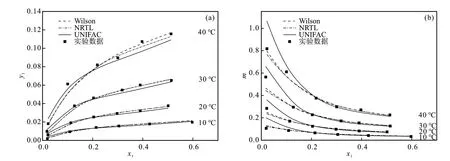
图5 汽相物质的量分数(a)与吸收平衡常数(b)的实验数据与模拟数据比较Fig. 5 Comparison of experimental and model values of (a) vapor mole fraction and (b) absorption constant

表3 各热力学模型公式及模型参数Table 3 Thermodynamic model formulas and model parameters
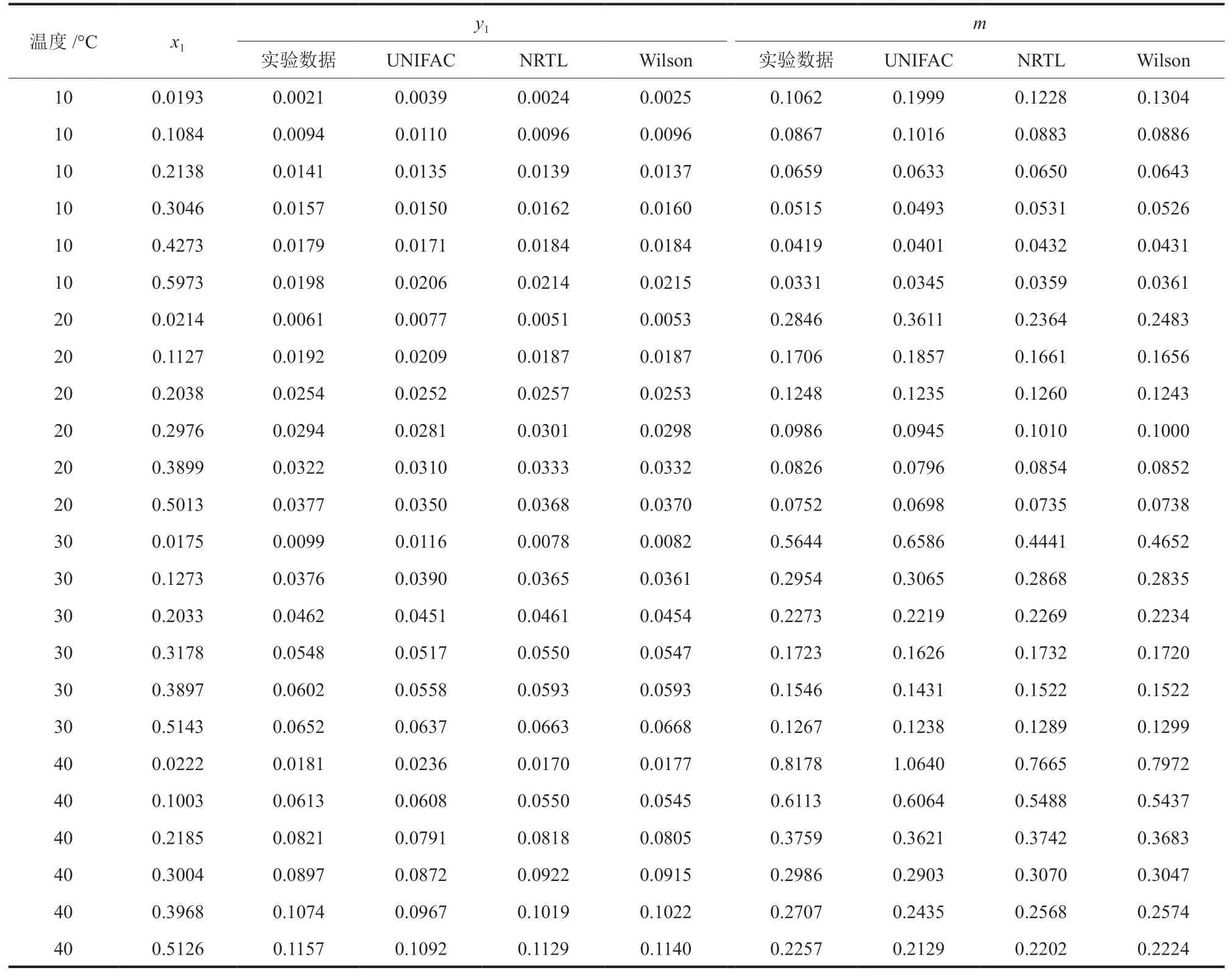
表4 乙醇-空气-水体系汽液平衡实验数据与热力学模型计算数据Table 4 Vapor-liquid equilibrium experiment data and thermodynamic model calculation data of ethanol-air-water system
y1的平均偏差(σy1)和m的平均偏差(σm)计算公式分别如式(7)和(8)所示。
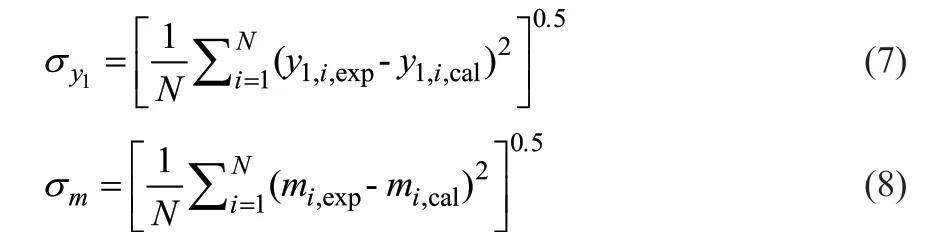
式中,N为实验点个数;y1,i,exp和y1,i,cal分别为第i组汽相乙醇物质的量分数实验值和模拟值;mi,exp和mi,cal分别为第i组吸收平衡常数实验数据和计算数据。
计算结果如表5所示。从表5可知, UNIFAC、NRTL和Wilson计算值与实验值的平均偏差小,σy1分 别 是0.003323、0.002043和0.002026;σm分 别 为0.059923、0.031661和0.026800。说明式(3)和式(6)可计算常压下该模型的乙醇-空气-水的平衡数据。其中Wilson模型偏差最小,与实验值关联最好;UNIFAC模型偏差最大,对水吸收乙醇过程的计算准确性有待提高。因此,Aspen模拟乙醇蒸汽吸收过程使用Wilson模型最佳。
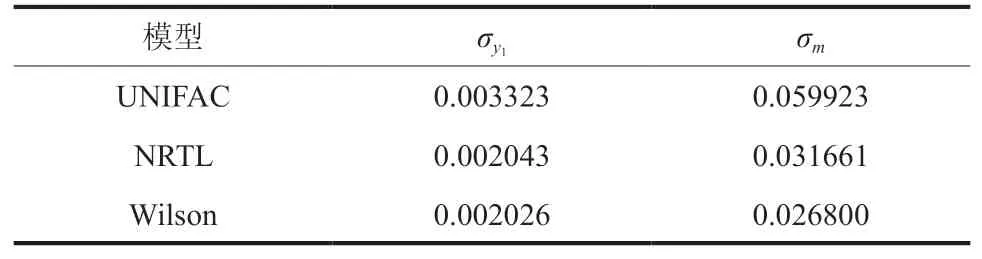
表5 各热力学模型计算数据的平均偏差Table 5 Average deviation of calculated data of each thermodynamic model
2.4 热力学一致性检验
热力学一致性是检验相平衡数据可靠性的标准,针对低物质的量分数范围的汽液平衡数据,使用 Van Ness 点检验法对数据点逐点检测,该方法对热力学一致性进行检验如式(9)所示[14]:
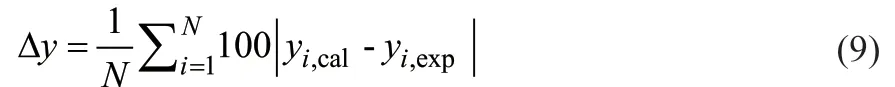
采用Wilson 模型推算得到的二元交互参数,如果Δy< 1,说明数据符合热力学一致性。将实验数据代入式(9),得Δy1= 0.1984 < 1,通过了Van Ness点检验法的热力学一致性检验,说明实验数据具有可靠性。
2.5 平衡常数的拟合与分析
根据实验数据,常压下乙醇-空气-水体系挥发相平衡曲面y1-x1-t和平衡常数m-x1-t的关系如图6和图7所示。由图6和图7可知:y1随着x1和t的增大而增大;m随着x1的减小、t的增大而增大。这是由于乙醇-水为正偏差非理想混合物,不同分子的吸引力小于相同分子吸引力。溶液中的乙醇活度系数在低物质的量分数时远大于1,并随物质的量分数增大而降低。活度系数越偏离1,体系越偏离理想混合物,水分子与乙醇分子之间排斥力也就越强,使得乙醇更易挥发至汽相。
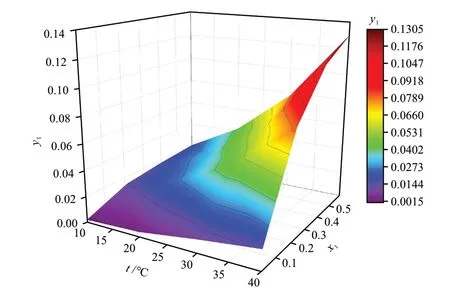
图6 y1-x1-t关系Fig. 6 Relation of y1-x1-t
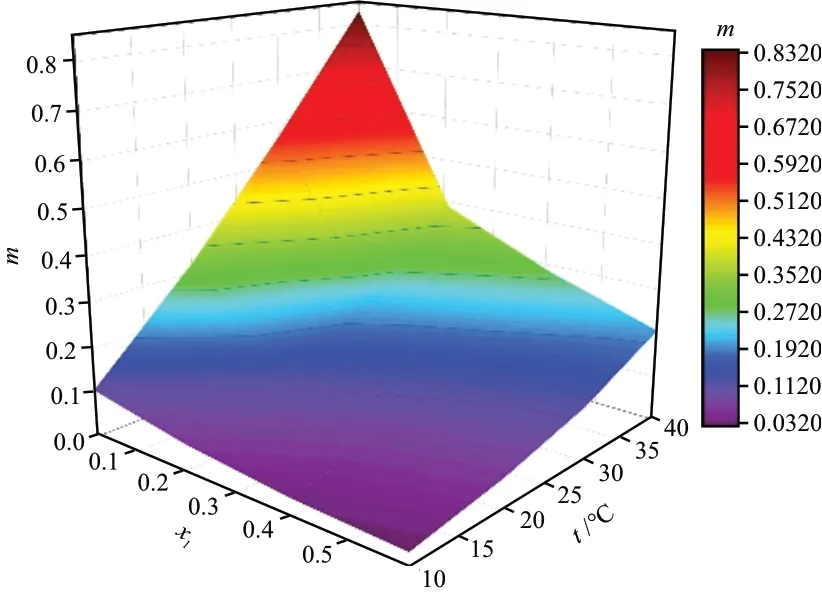
图7 m-x1-t关系Fig. 7 Relation of m-x1-t
对实验数据与关系曲面进行分析[15],对m关于x1和t的实验数据进行非线性回归,分别拟合得到二元多项式型、幂函数型以及自然指数型经验公式,发现自然指数型拟合度最好,同时与Wilson热力学方程建立的平衡常数计算模型契合度高。m的经验公式如式(10)所示,由表4中的实验数据通过Origin非线性拟合得出R2= 0.9926,和方差(SSE) = 0.00556。该公式可以用于实验条件内(x1< 0.5, 10 °C ≤ t ≤ 40 °C)预测m与x1、t的关系。将式(10)带入吸收平衡曲线得到式(11)。
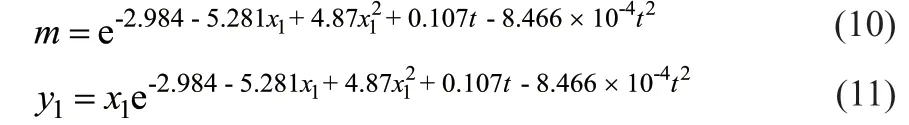
利用以上公式可为乙醇回收的吸收过程提供相应的数据参考。
2.6 误差分析与改进
定制的汽液平衡釜的汽液取样管中会有初始的气体液体残留,虽然取样时抽取数次进行置换,但仍会与釜内平衡的样品存在少量不匀的情况,导致系统误差。后续可使用内径更小的毛细管,减少管内样品残余。在气体取样中,随着装置内气体温度升高,取出的气体样遇相对较冷的取样针时,会有少量乙醇气体冷凝附着在针壁上,导致汽相乙醇物质的量偏低,所以取气体样时需让取样针温度接近气体温度,并且取后立即分析,或者使用带加热的顶空进样器进行操作[16]。使用精度更高的温度传感器,保持体系温度准确也是提高相平衡数据精度的重要手段。
3 结论
(1)使用定制平衡釜测定了常压下乙醇-空气-水平衡数据,建立了相平衡模型,将Wilson、NRTL和UNIFAC热力学模型计算所得结果与实验结果比较,Wilson吻合性最好,其汽相平衡乙醇物质的量分数和平衡常数最大平均偏差分别为0.002026和0.026800,适用于水吸收含乙醇的空气的过程。UNIFAC计算值吻合度有待提高。
(2)实验测定的乙醇-空气-水平衡数据通过了Van Ness 点检验法的热力学一致性检验,具有可靠性与有效性。根据实验结果拟合得到吸收过程的平衡常数m与x1、t多元非线性方程,可为工业上的乙醇吸收过程提供数据参考。
