Cu/MgO催化剂中Cu与MgO协同作用对合成气加氢制甲醇性能的影响
2022-03-08程思番任鹏超张振洲涂维峰
程思番,任鹏超,田 芸,张振洲,涂维峰,
(1. 郑州大学 先进功能材料制造教育部工程研究中心,河南 郑州 450001;2. 郑州大学 化工学院,河南 郑州 450001)
我国能源资源具有“富煤、贫油、少气”的结构特性[1],煤炭资源占据主导地位,其储量占世界总储量的11.6%[2],煤炭在未来相当长时期内仍将发挥不可替代的作用。清洁高效地利用煤炭资源关乎我国“碳达峰”、“碳中和”战略目标的实施。利用丰富的煤炭资源为原料,经合成气(CO、H2及CO2)高效合成甲醇(CH3OH)是我国煤炭高效清洁利用的重要途径之一[3],而催化剂是合成气制甲醇技术的关键。目前工业上合成气制甲醇催化剂主要为Cu/ZnO/Al2O3催化剂[4-6],但铜基催化剂热稳定性差,反应条件苛刻(压力5~10 MPa、温度220~280 °C)[7],催化剂活性不理想,且成本高、能耗大,致使国内开工甲醇装置大多处于亏损状态[8],这种状况制约着我国煤炭清洁高效转化战略,因此,开发新型高效甲醇合成催化剂以提高甲醇合成效率刻不容缓[9]。
合成气制甲醇为放热反应:CO + 2H2⇋CH3OH,ΔH298K= -90.77 kJ/mol,在热力学上低温条件更利于甲醇合成。因此,低温高效甲醇合成催化剂是目前的研究热点之一[10]。Hu等[11]报道了Cu/MgO催化剂在较低反应温度(160 °C)下仍具有较高的甲醇合成活性;Schumann等[12]发现Cu/MgO催化剂对CO加氢制甲醇的活性优于传统Cu/ZnO/Al2O3催 化 剂;Sharma等[13]认 为,Cu/MgO/γ-Al2O3催化剂中金属Cu与载体间存在强相互作用,从而提高了催化剂的选择性和稳定性。Ren等[14]报道了助剂ZnO、ZrO2和MgO的性质对Cu/Al2O3催化剂结构的影响,发现ZnO、ZrO2和MgO三者共同作用可以改变催化剂中金属Cu与Al2O3载体间的相互作用,从而促进高分散CuO物种的形成;作者进一步研究发现,MgO具有弱碱性,可调节催化剂表面酸碱度,增加催化剂表面碱性位点数量和强度,从而促进催化剂对合成气的吸附和活化[15,16]。此外,MgO能调控铜基催化剂表面电子结构,改变催化剂表面对反应介质的吸附特性[17]。尽管近年来国内外对MgO改性铜基催化剂合成甲醇进行了一定的研究,但目前对低温甲醇合成条件下Cu/MgO催化剂活性中心结构的认知仍然不足。
本文采用共沉淀法合成了一系列具有不同Mg含量(物质的量分数,下同)的Cu/MgO催化剂,在固定床微分反应器系统中进行催化剂性能评价。通过动态现场原位X射线衍射(XRD)和漫反射傅里叶变换红外光谱(DRIFTS),并结合程序升温还原(H2-TPR)和程序升温脱附(H2-TPD和CO-TPD)等表征手段对低温甲醇合成反应条件下Cu/MgO催化剂理化性质进行研究,探究Cu与MgO间的相互作用对铜基催化剂表面结构及低温合成气制甲醇性能的影响,揭示MgO能大幅提高铜基催化剂低温合成气制甲醇反应活性的内在机制,以期对开发新型高效合成气制甲醇催化剂及其工业化提供参考。
1 实验部分
1.1 实验试剂
Cu(NO3)2(99.7%,上海麦克林生化科技有限公司),Mg(NO3)2·6H2O(> 99.0%,阿达玛斯试剂有限公司),Na2CO3(≥ 99.8%,天津市瑞金特化学品有限公司)。
1.2 催化剂合成
实验采用共沉淀法合成Cu/MgO催化剂,制备过程为:称取所需质量的Cu(NO3)2和Mg(NO3)2·6H2O,在室温下搅拌溶于双重去离子水(200 mL,电阻> 18.2 MΩ),得到含Cu2+和Mg2+溶液(Cu(NO3)2溶液浓度为0.125 mol/L);称取一定质量的Na2CO3,在室温下搅拌溶于双重去离子水(200 mL),得到Na2CO3溶液;将以上两种溶液同时滴入持续搅拌的65 °C双重去离子水(300 mL)中,调节两溶液滴加速率,使混合溶液的pH维持在9.0;待滴加完毕,将混合溶液在65 °C持续搅拌1 h、老化2 h后得到含Cu和Mg的沉淀物;将沉淀物用去离子水洗涤10~15次后,置于100 °C鼓风干燥箱中干燥12 h;随后,将样品置于管式炉内,在450 °C(升温速率:1.75 °C/min)流动的空气气氛(GHSV= 20 mL/(g·min))下焙烧4 h;最后经压片和筛分得到粒径范围为125~180 μm的CuO-MgO催化剂前驱体。
根据Mg含量的不同,将Cu/MgO催化剂命名为Cu/x-MgO(x=n(Mg)/n(Cu + Mg) = 0.00、0.09、0.17、0.33、0.40、0.50、0.67和1.00)。
1.3 催化剂性能及动力学测试
催化剂性能及动力学测试均在固定床微分反应器系统中进行。反应器由不锈钢外管(总长400 mm)和石英内管(内径4.0 mm)组成,催化剂床层温度由床层底部K型热电偶测量,反应所需气体由4台气体质量流量计(Brooks Instrument,SLA5800系列)分别控制。反应气由Ar、H2(济宁协力气体有限公司,99.999%)、CO(河南心连心深冷能源股分有限公司,99.999%)和25% CO2/Ar(济宁协力气体有限公司,体积分数)组成。反应器压力由反应器前端的精密压力传感器测量,并由安装于反应器出口处的背压阀控制(TESCOM26-1765型)。反应物和产物由在线气相色谱仪(上海锐敏仪器有限公司,GC2060)检测,气相色谱仪同时配备有与毛细色谱柱(安捷伦,HP-PLOT-Q)相连的H2火焰离子检测器(FID)、与Porapak-Q色谱柱串联的甲烷转化炉及FID检测器,还有与TDX-01填充色谱柱相连的热导检测器(TCD)。测试前,在石英内管中装入100 mg(125~180 μm)Cu/MgO催化剂样品,催化剂上下两端填充石英棉,确保催化剂在反应器恒温区。反应前先将催化剂样品在H2/Ar(气体流速为0.83 cm3/s,H2体积分数为5%)气氛中预处理3 h(温度为230 °C,升温速率为1 °C/min,压力为500 kPa),然后在Ar气氛中降温至220 °C(降温速率为1 °C/min),并在Ar气氛中将压力升至1500 kPa,随后将Ar切换为CO/H2混合气(V(H2)/V(CO) = 3/1,GHSV= 48000 mL/(g·h))开始反应。
甲醇生成速率(rCH3OH,mol/(g⋅s))定义为单位时间内单位质量催化剂上生成甲醇的物质的量,如式(1)所示。

合成气制甲醇的转换频率(TOFCH3OH,s-1)定义为单位表面Cu0上甲醇的生成速率,如式(2)所示。

式中,nCu为单位质量催化剂表面Cu0原子数,mol/g。
催化剂表面Cu0原子数的测定方法很多[18,19],本文采用N2O化学吸附法[20]。催化剂表面Cu0的氧化过程如式(3)所示。

使用自制的测试装置对催化剂表面Cu0原子数进行测定,反应器由不锈钢外管与石英内管组成。N2O气体(济宁协力气体有限公司,体积分数1.00%)由热式气体质量流量计控制,反应器出口N2和N2O由Hiden HPR20在线质谱仪检测。根据检测结果,计算出nCu。
1.4 催化剂结构表征
Cu/MgO催化剂的体相结构及颗粒粒径由X射线粉末衍射仪(Bruker D8 Advanced X)测定:X光射线源为Cu Kα,管电压为40 kV,管电流为40 mA,扫描范围为10°~80°,扫描步长为0.02°,扫描速率为0.013 (°)/s。CO在Cu/MgO催化剂上的吸附状态采用DRIFTS(Thermo Fisher,iS50)测定:仪器配备了智能MCT液氮冷却检测器,分辨率为4 cm-1,扫描次数为64次,扫描范围为1000~4000 cm-1。H2-TPR表征采用与1.3节中N2O化学吸附实验相同的自制装置:催化剂用量为100 mg(125~180 μm),首先将样品在Ar气氛中(400 °C、0.67 cm3/s)预处理1 h以除去催化剂表面吸附的水和羟基;然后在Ar气氛中自然降温至40 °C;最后将Cu/MgO催化剂在5% H2/Ar(体积分数)混合气体(流量为0.67 cm3/s)中进行程序升温处理,温度区间为40~400 °C,升温速率0.17 °C /s。
2 结果与讨论
2.1 Mg含量对Cu/MgO催化剂活性的影响
在反应温度220 °C和反应压力1500 kPa时,不同Mg含量的Cu/MgO催化剂上甲醇的选择性均高于99%;反应产物CO2、CH4和H2O的体积分数均低于实验检测极限(0.0001%),因此CO加氢制甲醇反应过程中水煤气变换反应(WGS)和甲烷化反应可忽略。不同Mg含量的Cu/MgO催化剂上甲醇生成速率、表面Cu0原子数和合成气制甲醇的转换频率如表1所示。

表1 不同Mg含量Cu/MgO催化剂上甲醇生成速率、表面Cu0原子数和合成气制甲醇的转换频率Table 1 Methanol formation rate, surface Cu0 content and conversion frequency of syngas to methanol on Cu/MgO catalysts with different Mg contents
从表1可以看出,CuO对甲醇合成反应的催化活性很低,MgO对甲醇合成反应没有活性,而采用共沉淀法制备的Cu/MgO催化剂相比于单纯的CuO和MgO,甲醇生成速率显著提高,表明Cu与MgO间存在显著的协同作用,从而提升了催化剂的甲醇合成活性。此外,在Cu/MgO催化剂中,随着Mg含量的逐渐增加,表面Cu0原子数反而逐渐增加;但当Mg含量大于50%时,催化剂表面Cu0原子数则不再发生明显变化,铜颗粒分散度增加幅度正好与Cu/MgO催化剂中总Cu原子数减少程度相一致。实验发现,在Cu/MgO催化剂上合成气制甲醇的转换频率始终随Mg含量增加而增加,当Mg含量为67%时,转换频率达到5.67 × 10-1s-1。
图1为反应温度220 °C时不同Mg含量Cu/MgO催化剂上合成气制甲醇的转换频率随H2和CO分压的变化,图中直线斜率代表H2或CO的表观反应级数(n)。从图1可以看出,Cu/MgO催化剂的H2表观反应级数(0.87 ± 0.03)和CO表观反应级数(0.69 ± 0.02)随Mg含量增加无明显变化,说明甲醇合成反应机制可能没有发生变化[21,22],Cu与MgO间的协同作用促进了催化剂表面活性组分Cu0的生成,提高了催化剂的甲醇合成活性。

图1 不同Mg含量Cu/MgO催化剂的H2表观反应级数(a)和CO表观反应级数(b)Fig. 1 Apparent reaction orders of H2 (a) and CO (b) of Cu/MgO catalysts with different Mg contents
2.2 Mg含量对Cu/MgO催化剂体相结构的影响
不同Mg含量Cu/MgO催化剂的XRD表征结果如图2所示。图2(a)中35.5°、38.7°和48.7°的衍射峰分别对应CuO的(002)、(111)和(-202)晶面,42.9°和62.3°的衍射峰对应MgO的(200)和(220)晶面。从图2(a)中可以看出,当Mg含量较低时,几乎没有检测出MgO的衍射峰,这可能是由于MgO在催化剂中高度分散引起的。随着Mg含量逐渐增加,CuO的衍射峰变宽,峰强度逐渐降低,表明Cu与MgO间的协同作用可以促进催化剂中高分散CuO物种的形成,降低了CuO物种的晶粒尺寸。当Mg含量为67%时,MgO的衍射峰强度最高,CuO的分散度最高,晶粒尺寸最小。图2(b)中43.3°、50.4°和74.1°的衍射峰分别对应Cu0的(111)、(200)和(220)晶面,而MgO的相态未发生变化,表明MgO是不可还原载体,Cu与MgO的协同作用没有改变MgO的性质。还原处理后的催化剂中,CuO全部被还原为Cu0,且Cu0的分散度随Mg含量增加而增加,高分散的Cu0增加了与反应气体的接触面积,利于合成气在催化剂表面的吸附与活化。
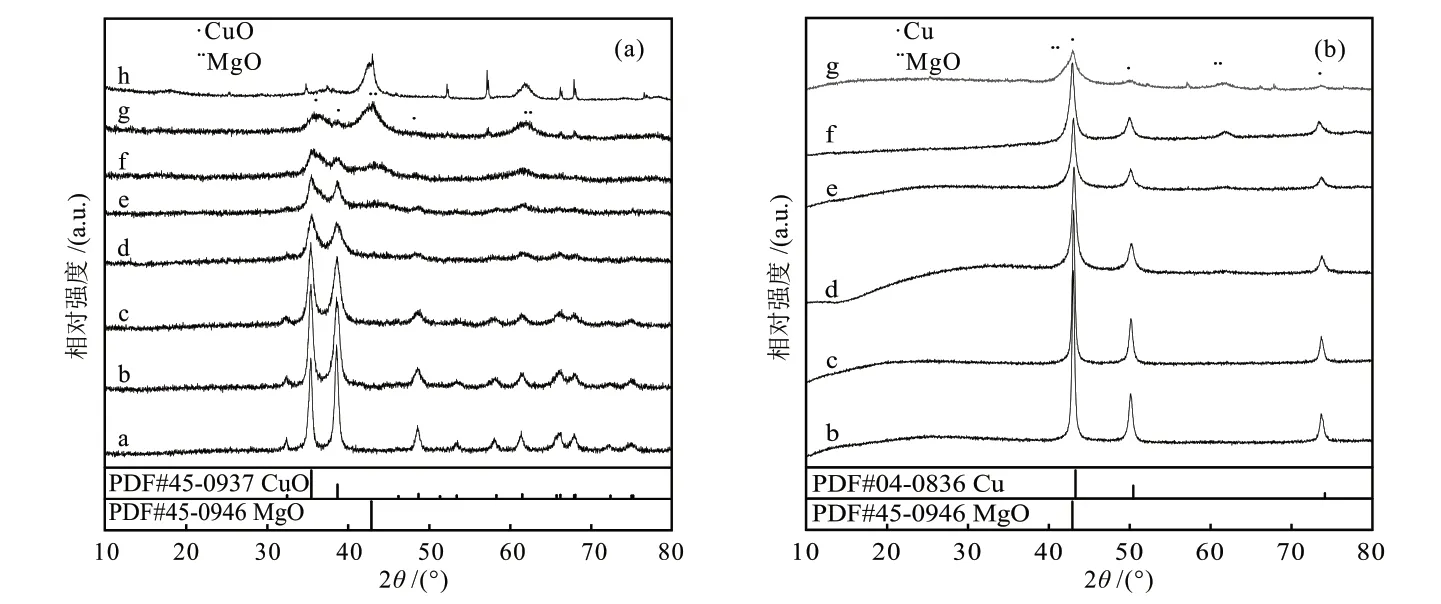
图2 不同Mg含量Cu/MgO催化剂焙烧后(a)和还原后(b)的XRD谱图Fig. 2 XRD patterns of Cu/MgO catalysts with different Mg contents after calcination (a) and reduction (b)
基于XRD测得的半峰宽(FWHM),由Scherrer公式计算得到不同Mg含量的Cu/MgO催化剂焙烧后和还原后的晶粒尺寸,如表2所示。从表2可以看出,还原后催化剂Cu0的晶粒尺寸随Mg含量的增加而减小,这可能是Cu与MgO载体间的协同作用使更多的CuO物种还原成表面Cu0,减小了催化剂中Cu0的晶粒尺寸。随着Mg含量的增加,催化剂表面暴露出更多小尺寸的Cu0,Cu0晶粒尺寸越小,越有利于提高催化剂的甲醇合成活性。
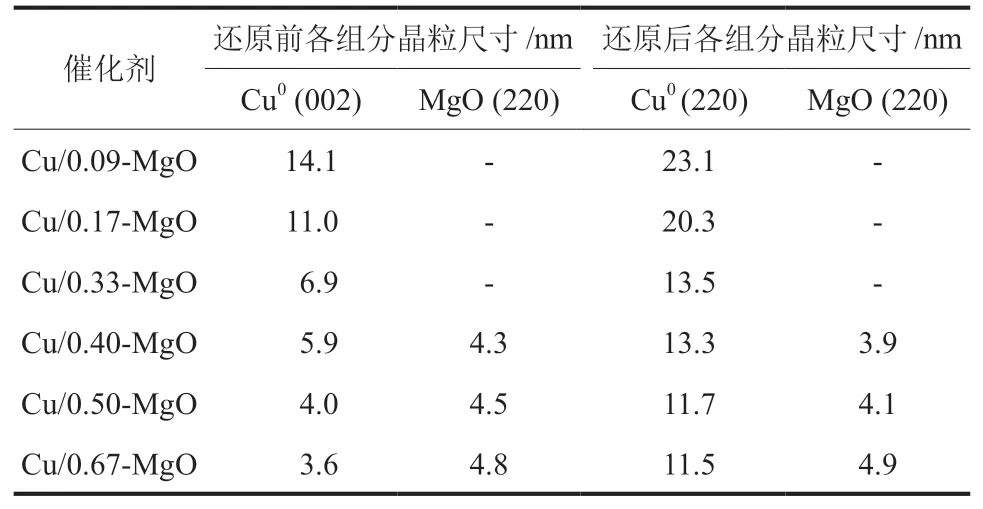
表2 还原前后不同Mg含量Cu/MgO催化剂中各组分晶粒尺寸Table 2 Particle size of each component in Cu/MgO catalysts with different Mg contents before and after reduction
2.3 Mg含量对Cu/MgO催化剂还原特性的影响
对于铜基催化剂,通常采用H2-TPR探究金属与载体之间的相互作用,从而评价催化剂的氧化还原特性。不同Mg含量Cu/MgO催化剂的H2-TPR曲线如图3所示。从图3可以看出,不同Mg含量Cu/MgO催化剂的H2-TPR曲线差别较大。MgO是不可还原载体,在H2-TPR实验中未检测到H2的消耗峰。不同Mg含量的Cu/MgO催化剂均出现两个还原峰,通常情况下,出峰温度较低(220~265 °C)的α还原峰对应催化剂表面高分散CuO的还原,温度较高(240~285 °C)的β还原峰对应体相大颗粒CuO的还原[23]。与CuO相比,少量MgO的添加使得CuO的还原峰向高温偏移,随着Mg含量的逐渐增加,CuO的还原峰向低温偏移,表明催化剂表面具有较多的与载体间存在协同作用的CuO,使α峰面积占比逐渐增加,β峰面积占比逐渐减小。结合XRD表征计算出的催化剂晶粒尺寸结果发现,CuO晶粒尺寸较小时,Cu2+主要以高分散的形式存在,容易被还原,峰位置逐渐向低温偏移。可以认为,Cu与MgO间的协同作用促进了催化剂中CuO的还原,使催化剂表面暴露出更多小尺寸的Cu0,有利于提高催化剂的甲醇合成活性。
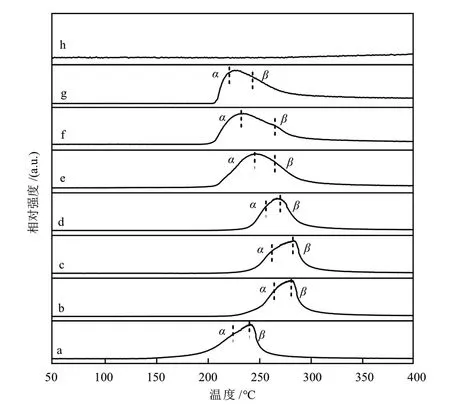
图3 不同Mg含量Cu/MgO催化剂的H2-TPR曲线Fig. 3 H2-TPR curves of Cu/MgO catalysts with different Mg contents
2.4 Mg含量对Cu/MgO催化剂表面结构及吸附特性的影响
采用H2-TPD和CO-TPD技术研究了催化剂的吸附特性,不同Mg含量Cu/MgO催化剂的H2-TPD曲线如图4所示。从图4可以看出,催化剂具有α、β、γ和δ4个脱附峰(见图4中曲线d、e、f、g和h)。H2在催化剂表面可能以分子态和解离态两种吸附形式存在[24],低温区(100~170 °C)的α峰和β峰对应弱吸附物种的脱附峰,可能是吸附在催化剂表面的分子态H2的脱附峰;高温区(240~350 °C)的γ和δ峰对应强吸附物种——游离态H原子的脱附峰,可能是吸附在Cu0上的H2发生解离后分别在Cu0和MgO表面的脱附峰。H2在Cu0(图4中曲线a)表面没有被吸附[25],在MgO(图4中曲线h)表面有少量被吸附,但脱附温度(332 °C)较高,表明Cu/MgO催化剂的活性位点可能是与MgO有协同作用的Cu0。可以看出,随着Mg含量的增加,催化剂表面分子态H2脱附温度降低,说明催化剂表面对H2分子的吸附能力减弱,而游离态H原子的脱附温度升高,这可能是因为随着Mg含量的增加,催化剂表面Cu0位点数增加,促进了催化剂对游离态H原子的吸附;另一方面,在Cu0位点上,更多的分子态H2发生解离,通过溢流吸附在MgO表面,从而使催化剂对游离态H原子的吸附强度增加。各脱附峰面积占比结果如表3所示,可以看出,随着Mg含量增加,游离态H原子在Cu0表面吸附量(γ峰)增加,该结果进一步证明Cu与MgO载体间的协同作用使得催化剂表面存在更多Cu0,从而使更多游离态H原子吸附在催化剂表面Cu0上,有利于后续CO加氢合成甲醇。
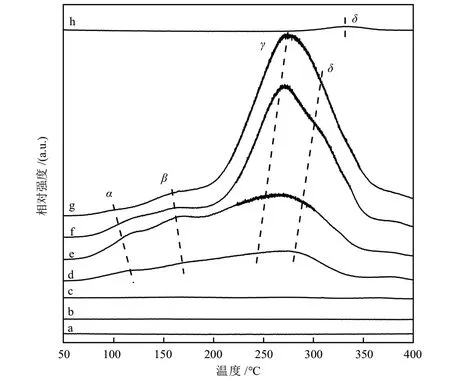
图4 不同Mg含量Cu/MgO催化剂的H2-TPD曲线Fig. 4 H2-TPD curves of Cu/MgO catalysts with different Mg contents
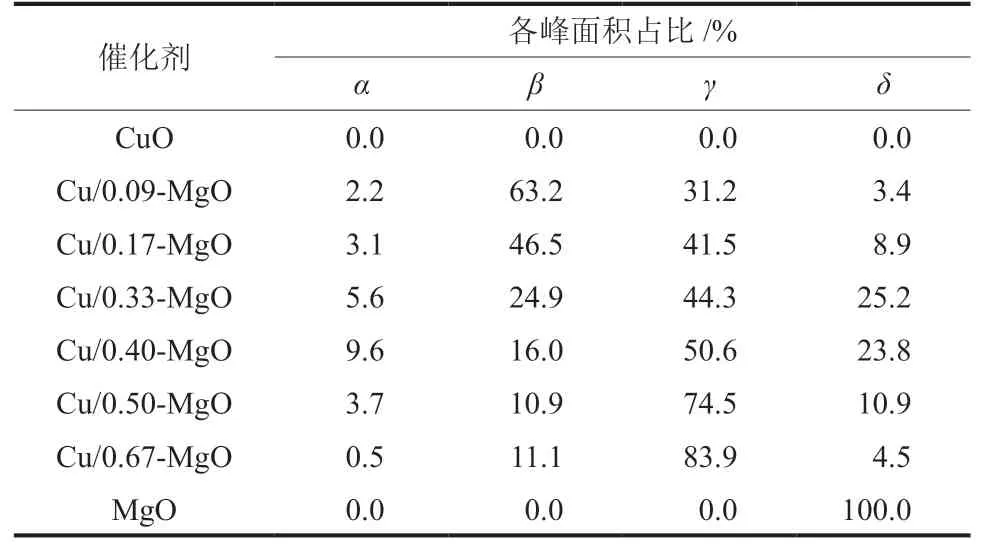
表3 H2-TPD曲线中α、β、γ和δ峰面积占比Table 3 Ratio of peak area of α, β, γ and δ in H2-TPD curves
不同Mg含量的Cu/MgO催化剂的CO-TPD曲线如图5所示。从图5可以看出,CO的脱附峰可以分为低温(150~280 °C)α峰和高温(280~350 °C)β峰两部分,分别对应CO在Cu0表面的弱吸附和强吸附。随着Mg含量的增加,α峰和β峰强度逐渐增加,表明催化剂对CO的吸附增强,这是由于催化剂表面高分散的小颗粒Cu0原子数增加,从而促进了催化剂对CO的吸附。在本反应温度(220 °C)下,催化剂活性与α峰相关性较高,即随着Mg含量增加,CO的低温脱附α峰逐渐增强,表明催化剂对CO的弱吸附量增加,有利于CO转化。结合不同Mg含量的Cu/MgO催化剂的H2-TPD和CO-TPD表征结果,发现Cu与MgO间的协同作用改变了催化剂对H2和CO的吸附特性,Mg含量的增加,促进了催化剂表面Cu0对H2和CO的吸附与活化,从而提高了催化剂上合成气制甲醇的转换频率。
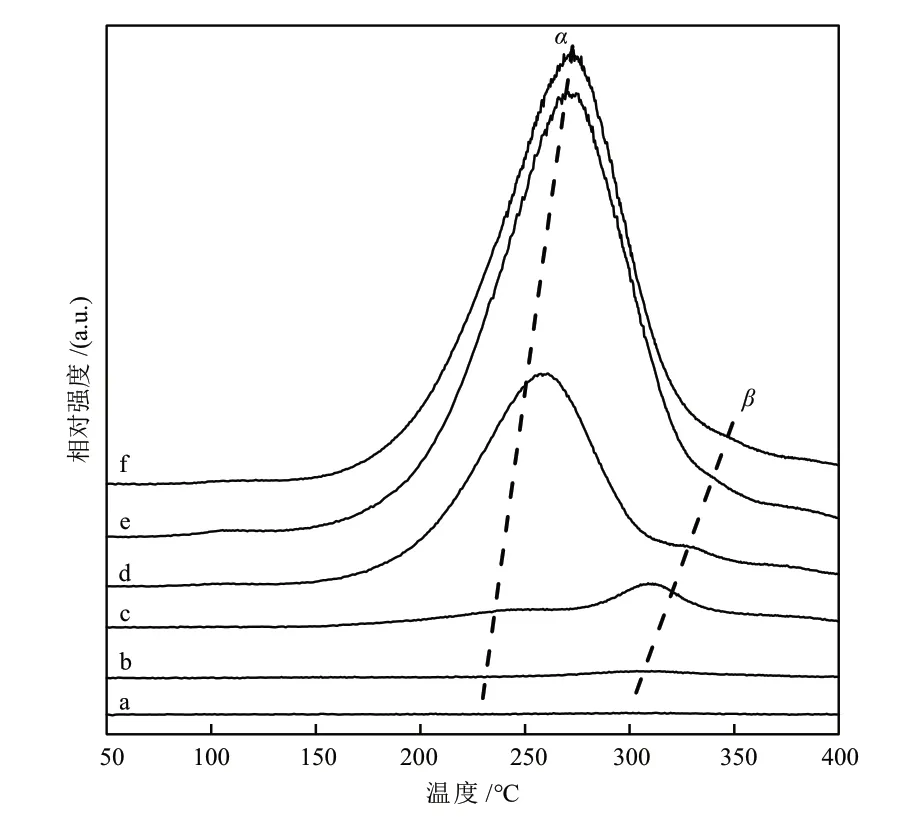
图5 不同Mg含量的Cu/MgO催化剂的CO-TPD曲线Fig. 5 Co-TPD curves of Cu/MgO catalysts with different Mg contents
催化剂表面铜物种的存在形式以及对CO的吸附性能可进一步通过DRIFTS进行测定。将反应后的催化剂在220 °C下经过Ar气吹扫5 h后降温至40 °C进行CO吸附的DRIFTS实验,吸附稳定后的结果如图6所示。通常情况下,可以根据CO在铜位点上的振动频率(νCO)判断催化剂中铜的价态:(1)CO在Cu0位点上吸附的νCO低于2110 cm-1;(2)CO在Cu+位点上吸附的νCO在2110~2140 cm-1之间;(3)CO在Cu2+位点上吸附的νCO高于2140 cm-1[26]。从图6可以看出,在2090 cm-1附近有一个明显的红外振动峰,对应Cu0位点上CO的吸附,表明催化剂表面铜物种以Cu0形式存在,与XRD表征结果一致。从图6还可看出,Cu0-CO红外振动峰随Mg含量的增加发生红移(从2093 cm-1到2088 cm-1),不同Mg含量的Cu/MgO催化剂对CO的吸附量存在明显差异,表明Mg含量的增加,促进了Cu0在催化剂表面的分散,催化剂表面Cu0数量随之增加,催化剂对CO的吸附随之增强[27],利于中间产物的生成,从而提升了催化剂的甲醇合成活性。
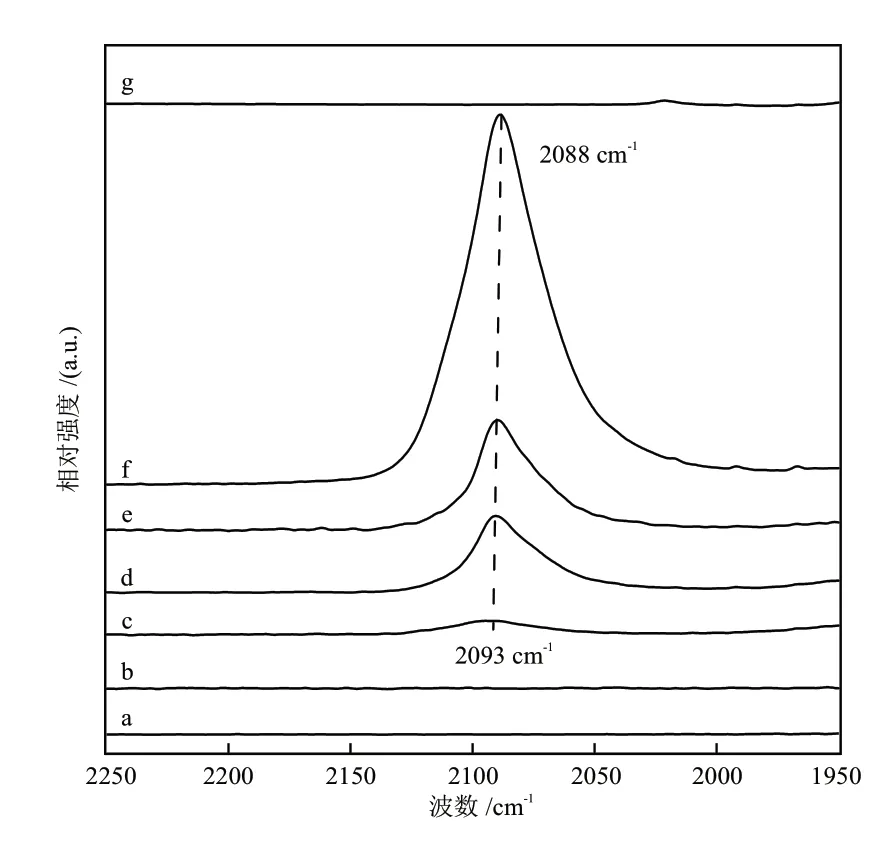
图6 不同Mg含量Cu/MgO催化剂表面CO吸附的DRIFTS谱图Fig. 6 DRIFTS of CO adsorption on Cu/MgO catalysts with different Mg contents
3 结论
通过共沉淀法合成了一系列Cu/MgO催化剂,研究了不同Mg含量对Cu/MgO催化剂上合成气制甲醇的反应性能以及对Cu/MgO催化剂表面结构的影响。主要结论如下:
(1)Cu/MgO催化剂表现出较好的CO低温加氢合成甲醇活性,这是由于Cu与MgO载体之间的协同作用可以促进催化剂中高分散CuO物种的形成,减小CuO物种的晶粒尺寸,促使催化剂表面更多的CuO被还原成Cu0,从而使得催化剂表面暴露出更多的Cu0活性位点,提高了合成气制甲醇的转换频率。
(2)当Mg含量为67%时,CuO物种分散度最高,催化剂表面高分散Cu0晶粒尺寸最小为11.5 nm。晶粒尺寸越小,越有利于合成气制甲醇反应的进行,此时合成气制甲醇的转换频率达到5.67 × 10-1s-1。
(3)Cu与MgO载体间的协同作用还可以促进H2的吸附和解离,随着Mg含量增加,催化剂表面Cu0数量增加,增大了与反应气的接触面积,使更多的游离态H和CO吸附在Cu0活性位点上,促进了催化剂对合成气的吸附与活化,从而提高了催化剂CO加氢生成甲醇的活性。
