桑葚、百香果、柚子及火龙果复合果汁协同抑制α-葡萄糖苷酶的作用及机制
2022-03-07董宇豪陈春扶雄
董宇豪,陈春,扶雄
(华南理工大学食品科学与工程学院,广东 广州 510640)
随着人们生活水平的提高,饮食结构发生了重大的改变,健康饮食的意识日益增强。天然果汁,以水果为原料,含有多酚、黄酮类、多糖、维生素等营养元素,具有丰富的营养价值,越来越受到大众的青睐。桑葚(Fructus mori),天然活性物质含量丰富,在中医临床中,桑葚可以用于预防和治疗各种慢性疾病,是一种药食同源类食品[1]。百香果(Passiflora edulisSims),广泛种植于热带地区,具有独特的香味,常被应用于果汁、食品的调味增香,并且在抗氧化、降血糖等方面具有潜在应用价值[2]。柚子(Citrus grandis(L.)Osbeck),与其他水果相比,具有产汁量高的特点,最大产汁量可达果实重量的 40%~50%[3]。火龙果(Hylocereus),广泛种植于热带和亚热带地区,含有丰富的多酚、膳食纤维及钾元素,具有潜在的抗氧化、抗炎、抗肥胖等作用[4]。然而,以上四种水果制备的单一果汁均存在一定的局限性,如桑葚的市售价格较高,百香果的出汁率较低,柚子的活性物质含量相对低,而火龙果制得果汁的风味较差等。因此,将其复配制备复合果汁可以充分发挥各自的优势,并在一定程度上改善其应用上的局限,同时提高果汁的营养价值,丰富口感。
然而,目前对于复合果汁的大量研究都集中于口感、稳定性、理化性质的改善等方面[5,6],针对果汁复配对于生物活性的协同增效作用及其作用机制的研究鲜见报道。协同作用存在于一些临床药物、天然产物之间,通过比较复合前后的活性强弱并计算组分之间的联合指数,判断是否具有增效作用,并区分叠加与协同作用,评价协同作用的强弱[7]。除此之外,通过抑制动力学的研究,绘制Lineweaver-Burk方程曲线,根据拟合方程的交点判断抑制类型,并计算抑制常数以判断抑制作用大小,从而深入探究作用机制。在余娜[8]的研究中发现,黄岑素与1-脱氧野尻霉素(1-DNJ)联用后对淀粉酶的抑制活性增强,联合指数计算结果表现为协同作用,且两个抑制剂与酶作用位点不同,解释了抑制活性增强的主要原因。
鉴于此,本文以桑葚、百香果、柚子、火龙果为原料,制备复合果汁并评价其抗氧化、降血糖活性,分析不同复合果汁组体系中的协同作用,并通过研究各单一果汁对α-葡萄糖苷酶的抑制动力学,判定各自的抑制类型及抑制作用强弱,以期为复合果汁生物活性协同增效的研究与应用提供借鉴。
1 材料与方法
1.1 材料与试剂
实验用桑葚、百香果、红肉蜜柚、红肉火龙果购于广东省广州市番禺区农贸市场,果实新鲜、完整且无机械损伤及病虫害;福林酚试剂购于上海麦克林公司;没食子酸购于上海阿拉丁公司;Trolox、荧光素钠、APPH、α-葡萄糖苷酶及pPNG 购于美国 Sigma公司;Na2CO3购于广州化学试剂厂。试剂均为分析纯。
1.2 仪器与设备
Milli-Q Academic超纯水系统(A10),Millipore公司;AHYQ数显恒温水浴锅,常州澳华仪器有限公司;XW-80A微型漩涡混合仪,上海精科实业有限公司;SpectraMax i3多功能酶标仪,美国 Molecular Devices公司;Varioskam Flash荧光酶标仪,美国Thermo Fisher公司;BY-1000B台式离心机,北京白洋医疗器械有限公司。
1.3 方法
1.3.1 复合果汁的制备
首先,按照以下工艺流程制备桑葚、百香果、柚子、火龙果四种水果的单一果汁样品。
得到单一果汁样品后,测定单一果汁总酚含量,并根据单位体积的多酚含量等比例复配制备复合果汁,使复合果汁体系中各组分的多酚含量相同。
1.3.2 四种单一果汁多酚含量测定
各果汁样品的多酚含量根据福林酚比色法测定[9]。以0~100 μg/mL没食子酸(GAE)为标准参照物绘制标准曲线。具体步骤为:0.5 mL样品或GAE与0.5 mL福林酚试剂混合,震荡摇匀充分混合后在室温下反应5 min,后加入0.75 mL NaCO3(20%,m/V)及3.75 mL去离子水,37 ℃下反应20 min,最后在760 nm下测定吸光值。为避免样品颜色干扰,取相同体积的去离子水代替福林酚试剂作为对照。每组样品设立三组平行试验,结果以没食子酸当量(mg GAE/mL果汁)表示。
1.3.3 果汁样品氧化自由基吸收能力(oxygen radical absorbance capacity,ORAC)评价
样品ORAC值的测定参照Zhang[10]的方法并加以改进。具体来说,于96孔黑色酶标板中依次加入20 μL不同浓度的样品溶液或Trolox标准溶液(6.25、1.5、25、50 和100 μmol/L),后加入 200 μL 荧光素钠溶液(95.6 nmol/L),在荧光酶标仪中自动混匀并于37 ℃下孵育10 min。随后,加入20 μL AAPH溶液(119.4 mmol/L)并混匀,酶标仪记录荧光强度(4 min/次,35次;激发波长:485 nm,吸收波长:535 nm),反应体系始终维持在37 ℃。根据不同浓度的Trolox标准溶液(6.25~100 μmol/L)的荧光猝灭面积(AUC)绘制标准曲线。每组样品设立三组平行试验。结果以每毫升果汁或每毫克没食子酸的mmol Trolox当量表示(mmol TE/mL或mmol TE/mg GAE)。
1.3.4 果汁样品对α-葡萄糖苷酶的抑制活性测定
根据 Chen[11]的方法测定样品对α-葡萄糖苷酶的抑制活性。果汁样品溶液、α-葡萄糖苷酶(0.1 U/mL)和4-硝基酚-α-D-呋喃葡萄糖苷(pPNG,1.5 mmol/L)溶液的配制均使用磷酸盐缓冲液(0.1 mol/L,pH 6.9)。先将 50 μL 果汁样品溶液与 100 μLα-葡萄糖苷酶充分混合,37 ℃下孵育10 min后,向混合液中加入100 μL底物溶液pPNG,充分混匀后,继续在 37 ℃下孵育20 min,最后加入1 mL Na2CO3(1 mol/L)溶液以终止反应。测定反应液405 nm处的吸光度。样品对α-葡萄糖苷酶的抑制率通过(1)式计算,并通过计算各样品对α-葡萄糖苷酶抑制的IC50值表示抑制强度,以判断降血糖活性。
式中:
As——样品组吸光度;
Ab——缓冲溶液代替α-葡萄糖苷酶的背景对照组吸光度;
An——缓冲溶液代替样品溶液的空白对照组吸光度。
1.3.5 果汁复合的联合指数
参照 Chou等人[12]的方法,通过计算联合指数(Combination Index,CI)评价协同作用。基于等效作用和中值定理计算CI值,计算公式如下:
式中:
D1、D2——两种组分联合作用时,抑制率为 50%的每个组分各自的作用浓度;
(Dx)1、(Dx)2——两种组分单独作用时,抑制率为50%的作用浓度。
1.3.6 果汁对α-葡萄糖苷酶的抑制动力学评价
抑制动力学主要研究活性物质对酶的抑制类型,并通过酶的失活过程判定活性物质的抑制程度。配制不同浓度的果汁样品及不同浓度的底物溶液(1~4 mmol/L),α-葡萄糖苷酶的浓度为0.1 U/mL。测定不同反应时间下的样品对α-葡萄糖苷酶的抑制率并计算反应速率。将结果带入酶动力学方程进行拟合,分别以底物浓度倒数(1/[S])及反应速度倒数(1/V)为横坐标和纵坐标绘制 Lineweaver-Burk方程,绘制曲线并根据交点判断抑制类型,进一步分析果汁复合的协同增效作用,并计算抑制常数(Ki),判定各果汁样品对酶的抑制强度。
1.3.7 数据统计
每组试验重复三次,数据结果以平均值±标准差(mean±SD)形式表示,显著性水平为0.05。采用SPSS 25软件进行数据分析,Origin 9.1软件作图,抑制动力学数据分析由GraphPad Prism软件进行。
2 结果与分析
2.1 果汁中多酚含量比较
测定四种果汁的总酚含量,结果如表1所示。以mg GAE/mL果汁为单位,比较四种果汁总酚含量,由此可见,四种果汁总酚含量大小依次为桑葚>百香果>火龙果>柚子,其中桑葚果汁的总酚含量为14.12±0.53 mg GAE/mL,显著高于其他三种果汁。

表1 单一果汁样品的总酚含量Table 1 TPC values of samples
2.2 果汁的抗氧化活性评价
ORAC法是根据自由基破坏荧光探针引起荧光强度变化的原理,在抗氧化剂存在时,可以抑制由自由基引起的荧光变化,程度可以反映其抗氧化能力。相较传统的评价抗氧化活性的化学方法(如DPPH法及ABTS法)更加灵敏和准确,是目前应为最广泛的体外评价抗氧化活性的方法之一[13]。因此,通过测定果汁样品的ORAC值,比较样品间的抗氧化活性。
结果如表2所示,当四种单一果汁的ORAC值以mmol TE/mL果汁为单位表示时,每单位体积果汁样品的抗氧化活性比较为:桑葚>百香果>火龙果>柚子,其中,以桑葚果汁最高为43.44 mmol TE/mL,结合四种果汁的总酚含量,可见,当二者均以每单位体积果汁样品比较时,果汁的总酚含量与抗氧化活性呈现正相关性,果汁中多酚含量越高,则表现出更强的抗氧化活性。这说明在果汁样品的抗氧化活性中,酚类物质起到了关键作用。这与其他已报道的研究结果具有一致性,在吴国美[14]的研究中发现,浆果果汁的抗氧化能力与其花色苷含量有较高的相关性;同样,在对于8种水果果皮和果肉的酚类及抗氧化活性研究中发现,酚类物质含量与DPPH自由基清除能力及氧自由基吸收能力具有相关性[15]。

表2 单一及复合果汁的抗氧化活性Table 2 The antioxidant activities of samples
考虑到复合果汁的制备是以多酚含量等比例混合而得,因此,以mmol TE/mg GAE为单位,比较果汁样品的抗氧化活性。由表2可见,对于单一果汁,每单位多酚含量的果汁样品的抗氧化活性比较为:桑葚>火龙果>柚子>百香果,其中,桑葚果汁样品表现出最好的抗氧化活性,ORAC数值为3.08 mmol TE/mg GAE。与上述结论相比,不同单位下ORAC数值的比较结果略有不同,这主要是由于在不同单位表示下,ORAC数值分别表现为果汁体系抗氧化活性(以mmol TE/mL果汁为单位)及果汁内酚类物质单体抗氧化活性(以mmol TE/mg GAE为单位),在两种比较方式下,桑葚果汁均表现出较好的抗氧化活性,由此可见,桑葚果汁体系及其酚类物质单体均具有较强的抗氧化活性,而火龙果果汁内可能含有较高抗氧化活性的酚类物质单体,该结论可为具有抗氧化活性的果汁的开发与利用提供借鉴。复合果汁的抗氧化活性结果如表2所示,其中,以四种果汁复合C4组ORAC值最高为3.87 mmol TE/mg GAE,三种果汁复合的组别中,以C1组ORAC值最高为3.19 mmol TE/mg GAE,略高于单一果汁的ORAC值,而C2和C3组的ORAC值低于桑葚果汁样品,由此可见,果汁复合对于其抗氧化能力无明显的增强效果。
2.3 果汁的降血糖活性评价
α-葡萄糖苷酶是人体体内关键的淀粉消化酶之一,通过水解低聚糖的α-1,4糖苷键生成葡萄糖发挥作用。因此,活性物质通过抑制α-葡萄糖苷酶的活性可以缓解葡萄糖的释放速度,调节餐后血糖,从而提高胰岛素敏感性[16]。测定各样品在不同浓度梯度下对于α-葡萄糖苷酶的抑制率,并计算IC50值,以比较不同果汁样品的降血糖活性,结果如图2及表3所示。
由图2可见,随着果汁浓度的升高,样品对α-葡萄糖苷酶的抑制作用逐渐增强。通过比较各样品的IC50值(表3),单一果汁对α-葡萄糖苷酶 IC50值在0.30~0.49 mg GAE/mL之间,其中以桑葚果汁最低(0.30 mg GAE/mL),各果汁样品对于α-葡萄糖苷酶的抑制作用比较为:桑葚>百香果>火龙果>柚子,该结果与上述总酚含量(2.1)及抗氧化活性(2.2)一致,说明三者可能具有一定的相关性。桑葚果汁在抗氧化及降血糖两个方面均表现出较高的活性,这可能与其丰富的生物活性物质(包括多酚、花青素、黄酮类化合物、多糖等)有关,在Chen等[17]的研究中表明,桑葚提取物可以降低糖尿病小鼠空腹血糖,改善体内抗氧化系统,修复器官组织损伤,同时,增加了小鼠肠道菌群的丰富度和多样性。

表3 单一及复合果汁的降血糖活性比较Table 3 The hypoglycemic activities of samples
对于复合果汁样品,样品对α-葡萄糖苷酶IC50值在 0.16~0.25 mg GAE/mL之间,均小于单一果汁的IC50值,即可初步判断果汁复合对于样品的降血糖作用具有一定程度的增强作用,降血糖作用样品间比较为:C4>C1>C3>C2,以C4组(IC50=0.16 mg GAE/mL)效果最佳,该结果与抗氧化活性一致。
2.4 复合果汁的协同作用评价
为进一步判断果汁复配是否具有协同效应,研究复合果汁中单一组分及复配组分的剂量与效应关系,根据样品浓度和IC50值计算CI指数。CI指数是基于质量作用定律提出的定量评价药物相互作用效果的指标[18]。当CI<0.9时,两组分之间表现为协同作用,当 CI=0.9~1.1,组分间为叠加作用,当 CI>1.1时,组分间表现为拮抗作用。通过上述样品对α-葡萄糖苷酶 IC50值分别计算四种果汁复合时百香果、柚子及火龙果与其他三组复合果汁的CI值,评定各单一组分在复合体系中的协同作用,结果如表4所示。三组联合指数均小于0.9,说明这三种单一果汁成分在桑葚-百香果-柚子-火龙果复合果汁体系中均表现出与其他三个组分的协同作用,而非简单叠加。其中,柚子与桑葚-百香果-火龙果协同比较的 CI值最低为0.57,表明柚子对于体系发挥协同作用具有重要作用。该结果进一步证实果汁复合对于增强α-葡萄糖苷酶抑制活性具有协同作用的结果。在李俊萱[19]对于苹果-浆果复合果汁的研究中得到相似结果,研究发现,与单一果汁相比,复配对果汁的生物活性具有一定的协同增效作用。
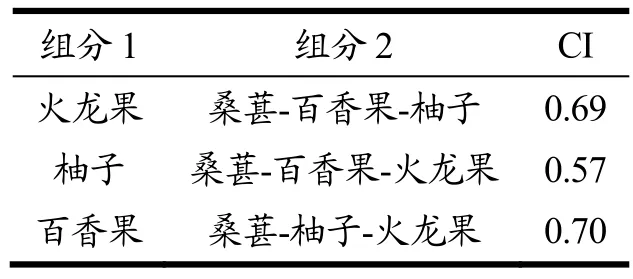
表4 果汁样品联合抑制50% α-葡萄糖苷酶活性时的联合指数(CI)Table 4 The combination index (CI) values for the compound juice at the 50% inhibition of α-glucosidase activity
2.5 果汁对α-葡萄糖苷酶的抑制类型分析
为进一步验证上述结果,对各果汁样品进行酶抑制动力学的研究,分析样品对α-葡萄糖苷酶的抑制效果及类型。四种果汁样品的 Lineweaver-Burk方程如图3所示,样品的双倒数作图均表现出良好的线性关系,其中,不同浓度桑葚果汁的拟合曲线相交于x轴,表现为非竞争型抑制类型,而其他三种果汁的拟合曲线均相交于第二象限,符合混合型抑制类型。在非竞争型抑制中,抑制剂结合在酶的非活性位点,不直接影响酶和底物的结合能力,而非竞争型抑制类型为抑制剂之间发挥协同抑制作用的基础[20]。本试验研究的四种样品表现出非竞争型抑制和混合型抑制,说明其复配后对于体系的协同效果具有积极作用,该结论进一步验证了上述协同抑制评价的结果。
由表5可见,依据Lineweaver-Burk动力学方程计算可得,四种果汁样品在不同浓度下的最大反应速度值均随浓度的升高而降低。抑制常数(Ki)为50%的酶与抑制剂结合时对应的抑制剂的浓度,反映的是抑制剂的抑制强度,Ki值越小说明抑制能力越强[21]。通过计算,四种果汁的 Ki值以桑葚最低为 22.2 mg/mL,说明桑葚果汁具有较强的α-葡萄糖苷酶抑制活性,抑制作用排序为桑葚>百香果>火龙果>柚子,该结果与上述结论一致。通过抑制动力学的试验,在结合位点的角度进一步证实了果汁复配对于α-葡萄糖苷酶的抑制效果的协同增效作用。

表5 果汁样品与α-葡萄糖苷酶作用的抑制动力参数Table 5 Kinetic parameters of α-glucosidase inhibition in the presence of juice
3 结论
本文制备了桑葚、百香果、柚子、火龙果果汁,研究果汁复配的协同抗氧化及降血糖作用,结果显示:
(1)果汁复配对于果汁α-葡萄糖苷酶抑制作用的增强具有明显效果,其中以四种果汁复配组具有最强的抑制作用,IC50值为0.16 mg GAE/mL。
(2)通过计算复配体系中的联合指数,CI指数在0.57~0.70之间,均小于0.9,表现出协同增效作用。其中,以柚子与桑葚-百香果-火龙果协同的数值最低(0.57),表明柚子对复配体系α-葡萄糖苷酶抑制作用的增强发挥重要作用。
(3)通过抑制动力学进一步探究作用机制,结果表明,四种组分在体系中均没有表现出竞争型抑制,证实了果汁复配的协同作用;而抑制常数计算结果显示,相较于其他三种组分,桑葚果汁Ki值最低为22.2 mg/mL,表现出较强的α-葡萄糖苷酶抑制活性。
