新疆伊吾县野山杏多肽对衰老模型小鼠的抗氧化作用
2022-03-07蒋丽卢悦买迪娜木阿布力米提商雪珂许贺志祥杨晓君
蒋丽,卢悦,买迪娜木·阿布力米提,商雪珂,许贺志祥,杨晓君,3*
(1.国药集团新疆新特药业有限公司,新疆 乌鲁木齐 830000)(2.新疆农业大学食品科学与药学学院,新疆 乌鲁木齐 830052)(3.新疆果品采后科学与技术重点实验室,新疆 乌鲁木齐 830052)
山杏仁(Semen armeniacaeAmanrum)又名苦杏仁,是蔷薇科杏属植物,广泛分布在世界各地,在我国主要产于辽宁、内蒙古、陕西、甘肃、新疆等干旱和半干旱地区,资源丰富[1,2]。野山杏在新疆的伊犁和哈密地区分布广泛,且因山杏树耐寒、耐旱、耐贫瘠且适应性强,具有良好的防风固沙作用,加之国家政策的大力支持,使得山杏树在新疆的栽培面积不断扩大。杏仁是我国传统中药,不仅具有治风寒、定喘润肺、止咳祛痰等药效作用[3],还具有丰富的营养价值,是一种药食兼用的材料,杏仁中含有油脂、蛋白质、糖类、粗纤维以及维生素E等多种维生素。
目前我国对山杏的研究主要集中在果肉以及杏仁油上,随着杏仁油加工产业的发展,产生了大量杏仁粕,杏仁粕中含有约34%的果仁粗蛋白[4],伊吾县野山杏中杏仁粕蛋白可达47.8%,而杏仁粕仅作为动物饲料处理,造成资源的浪费,因此开发利用新疆野山杏特色资源具有十分重要的意义[5-7]。
近年来,食物蛋白质酶解物中的水解产物被称为食源性生物活性肽,生物活性肽(Bioactive peptides)是一种特殊的蛋白质片段,与蛋白质相比,生物活性肽不仅易于吸收,而且具有广泛的生物活性[8,9],例如:提高抗氧化性、降血压、降血脂、抗血栓、抑菌、免疫调节等作用受到广泛关注[10-12]。其中抗氧化肽是重要的生物活性肽之一,按来源可分为天然抗氧化肽、蛋白降解抗氧化肽和人工合成抗氧化肽三种,其中以蛋白降解多肽为主,主要从动植物中提取蛋白而得。研究表明,抗氧化肽可以预防与癌症和动脉粥样硬化等众多退行性疾病相关的氧化应激[13]。与其他制备方法相比,酶解法因价格低廉、操作简单、反应温和,可保护产物蛋白质营养价值等优点广泛使用[14]。
本研究以野山杏仁作为原料,在磁力搅拌方式下采用酶解法从杏仁中提取杏仁多肽,确定最佳提取条件,通过单因素实验与正交实验确定木瓜蛋白酶酶解的最优工艺指标,同时针对野山杏多肽的体内抗氧化活性进行研究,探讨伊吾县野山杏多肽的体内抗氧化作用,为伊吾县野山杏多肽的生物活性机制研究提供一定的理论基础。
1 试验材料
1.1 材料与仪器
1.1.1 原料
新疆伊吾县野山杏仁,由新疆伊吾天苇生物科技公司提供。
1.1.2 仪器设备和试剂
1.1.2.1 主要试剂
盐酸(分析纯),南京建成生物工程研究所;氨基酸水解分析标准样品,德国塞卡姆Sykam;三羟甲基氨基甲烷(分析纯),Gentihold;甲醛溶液(分析纯),天津市致远化学试剂有限公司;氢氧化钠(分析纯),天津市致远化学试剂有限公司;双蒸水(自制);丙二醛(MDA)测试盒,南京建成生物试剂研究所;总超氧化物歧化酶(T-SOD)测试盒,南京建成生物试剂研究所;谷胱甘肽过氧化物酶(GSH-Px)测试盒,南京建成生物试剂研究所;抗坏血酸,天津市致远化学试剂有限公司;木瓜蛋白酶,北京奥博星生物有限公司。
1.1.2.2 主要仪器
XMT-DA数显恒温水浴锅,余姚市亚星仪器仪表有限公司;80-2离心沉淀器,金坛市医疗仪器厂;PHS-2C型精密酸度计,上海大普仪器有限公司;85-2控温磁力搅拌器,江苏金怡仪器科技有限公司;S-433D全自动氨基酸分析仪,德国塞卡姆 Sykam;X-Mark酶标仪,伯乐生命医学产品上海有限公司;Neofuge 13R台式高速冷冻离心机,力康生物科技有限控股公司;XHF-DY高速分散器,宁波新芝生物科技股份有限公司;LGJ-10型冷冻干燥机,北京松源华兴科技发展有限公司。
1.2 试验方法
1.2.1 野山杏多肽的提取工艺优化
1.2.1.1 野山杏处理方法
野山杏仁置于烧杯中,在 60 ℃的水浴中浸泡10~20 min,即可去皮,外皮自然阴干保存,去皮后的杏仁于60 ℃干燥箱烘干2~4 h,将烘干的野山杏仁粉碎过60目筛,经正己烷回流2 h后取沉淀,为杏仁粕,将脱油后的杏仁粕于45 ℃鼓风干燥2 h,粉碎过80目筛,即为酶解粕原料。
1.2.1.2 粗蛋白检测标准曲线的绘制
氨氮标准储备溶液(以氮计)(1.0 g/L):称取105 ℃干燥2 h的硫酸铵0.4720 g,加水溶解后转于100 mL容量瓶中,并稀释至刻度,混匀,此溶液每毫升相当于1.0 mg氮。
氨氮标准使用溶液(0.1 g/L):用移液管吸取10.00 mL氨氮标准储备液于100 mL容量瓶内,加水定容至刻度,混匀,此溶液每毫升相当于0.1 mg氮。
粗蛋白按GB 5009.5-2016分光光度法测定[15],吸取0.00、0.05、0.10、0.20、0.40、0.60、0.80、1.00 mL氨氮标准使用溶液,分别置于10 mL比色管中,加4.0 mL乙酸钠-乙酸缓冲溶液及4.0 mL显色剂,加水稀释至刻度,混匀。置于100 ℃水浴中加热15 min。取出用水冷却至室温后,移入1 cm比色杯内,以零管为参比,波长400 nm处测量吸光度值,根据标准各点吸光度值绘制标准曲线并计算线性回归方程。
以氨氮标准液浓度C(mg/mL)为横坐标,吸光度值 A为纵坐标,线性拟合,线性回归方程为:A=0.9899C-0.0567(r=0.9980),在 0.00~1.00 mg/mL范围内呈良好的线性关系,故可以用此方法来快速检测提取溶液中蛋白质的含量。粗蛋白检测标准曲线见图1。
1.2.1.3 木瓜蛋白酶水解条件的单因素试验设计
经前期试验证明,野山杏多肽在磁力搅拌酶解方式下利用木瓜蛋白酶水解度最高,多肽水解度为:35.02%[16]。因此在磁力搅拌酶解方式下考察酶底物比、料液比、酶解时间、pH值和酶解温度对野山杏多肽水解度的影响。
(1)酶底物比对野山杏多肽水解度的影响
设定酶底物比分别为1%、2%、3%、4%、5%,料液比1:20,pH为7.0,反应温度为60 ℃条件下,酶解120 min。
(2)料液比对野山杏多肽水解度的影响
根据(1)筛选出的酶底物比,料液比分别为1:10、1:15、1:20、1:25、1:30,pH为7.0,反应温度为60 ℃条件下,酶解120 min。
(3)酶解时间对野山杏多肽水解度的影响
根据1筛选出的酶底物比,(2)筛选出的料液比,pH为7.0,反应温度为60 ℃条件下,将酶解时间分别设定为30、60、120、180、240 min。
(4)pH值对野山杏多肽水解度的影响
根据(1)筛选出的酶底物比,(2)筛选出的料液比(3)筛选出的酶解时间,设定pH值为4、5、6、7、8,反应温度为60 ℃条件下进行酶解。
(5)酶解温度对野山杏多肽水解度的影响
根据(1)筛选出的酶底物比,(2)筛选出的料液比,(3)筛选出的酶解时间,(4)筛选出的 pH值,设定反应温度分别为 50、55、60、65、70 ℃条件下进行酶解。
1.2.1.4 木瓜蛋白酶水解条件的优化试验
在单因素试验的基础上,选取酶底物比、时间、pH值和酶解温度为试验因素,以多肽水解度为试验指标,进行四因素三水平的正交试验。
1.2.1.5 野山杏仁粕水解度(DH)的测定
利用甲醛滴定法测定酶解液中的氨基氮[17]。原理:甲醛与氨基酸中的氨基作用,可消除其碱性,使羟基显示出酸性,用氢氧化钠标准溶液滴定,以酸度计指示终点,即可对氨基酸进行定量[18]。
吸取5 mL上清液,置于200 mL烧杯中,加入45 mL蒸馏水,用0.05 mol/L NaOH标准溶液滴定至pH为8.2,记录使用NaOH标准溶液的体积;再加入10 mL甲醛溶液并混匀,继续用NaOH标准溶液滴定至pH为9.2,记录使用体积,同时做空白试验。
(1)氨基酸态氮计算公式[19]
(2)总氮量测定计算公式
采用凯氏定氮法[20]测定:
(3)水解度公式[21]
1.2.1.6 野山杏多肽得率计算
1.2.2 野山杏多肽对衰老模型小鼠的抗氧化作用
1.2.2.1 试验原料的制备
野山杏多肽为1.2.1.3中优化试验后木瓜蛋白酶磁力加热搅拌所得野山杏仁酶解液,经过冷冻干燥得野山杏多肽粉,低温保存备用。
1.2.2.2 试验动物及饲料
健康昆明种S级小鼠,雄性,体重18±4 g,由新疆医科大学实验动物中心提供(动物生产许可证号:SCXK[新]2017-0004)。灭菌全价颗粒饲料,由新疆医科大学实验动物中心提供。
1.2.2.3 分组与造模
选取健康的雄性小鼠72只,适应性喂养7 d,随机分为六组,每组12只。选取五组小鼠以D-半乳糖100 mg/kg·bw·d颈后皮下注射,每天一次,连续30 d,制备衰老模型。五组分别为:野山杏多肽低剂量组(后文简称低剂量组)、野山杏多肽中剂量组(后文简称中剂量组)、野山杏多肽高剂量组(后文简称高剂量组)、衰老模型组(后文简称模型组)、Vc阳性对照组(后文简称阳性对照组),另取一组为空白对照组。同时进行野山杏多肽按低、中、高剂量每天一次灌胃给药,阳性对照组灌胃给予Vc,空白对照组和模型组用等剂量生理盐水代替。持续喂养30 d,试验过程中小鼠每周称取体重1次调整给予剂量,自由进食,进水。末次给药后禁食24 h,不禁水,处死前称量体重。
1.2.2.4 剂量设计
在体外抗氧化的基础上,以体外抗氧化清除自由基能力最佳剂量结合文献资料,设置高、中、低剂量进行体内抗氧化预实验,根据预实验结果确定的实验剂量分别为50、75、100 mg/kg,详见表1所示。
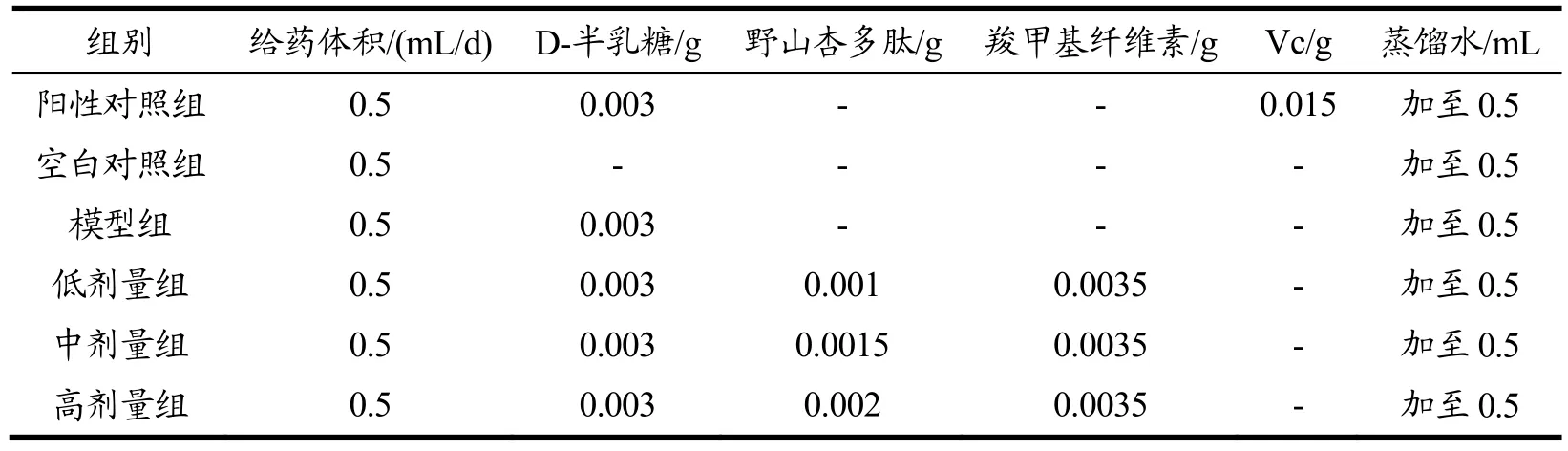
表1 各组给药剂量Table 1 Dosage of each group
1.2.2.5 样品制备
各组小鼠眼眶取血,4 ℃条件下3000 r/min离心15 min,取上清(即血清)备用。小鼠取血后脱臼处死,快速取出肝组织及脑组织,0 ℃~2 ℃生理盐水洗去淤血。精密称取肝组织0.5 g,加入0 ℃生理盐水4.5 mL,迅速研磨制成组织匀浆,4 ℃条件下4000 r/min离心10 min,取上清,备用。
1.2.3 MDA、T-SOD及GSH-Px含量测定
1.2.3.1 脑组织、肝组织蛋白测定[22]
取脑组织、肝组织匀浆上清用生理盐水稀释,取样50 μL测定。混匀,将配置好的溶液静置10 min,于595 nm波长,1 cm光径,蒸馏水调零,测定各管吸光度值。计算方法见公式(5)。
1.2.3.2 MDA含量测定[23]
(1)小鼠血清MDA测定:直接取血清0.05 mL进行测定。将配置好的混匀,塑料薄膜封口,剌一小孔,95 ℃水浴40 min,取出后流水冷却,3500 r/min,离心10 min,取上清,于532 nm处,1 cm光径4 mm内径,蒸馏水调零,测各管吸光度值。计算方法见公式(6)。
(2)小鼠肝组织、脑组织MDA测定:取上清组织匀浆待测,将配置好的试剂旋涡混匀器混匀,用保鲜薄膜封口,刺一小孔,沸水浴40 min,取出后流水冷却,然后3500 r/min,离心10 min,取上清,于532 nm处,1 cm光径4 mm内径,蒸馏水调零,测各管吸光度值。计算方法为见公式(7)。
1.2.3.3 T-SOD含量测定[24]
(1)小鼠血清T-SOD测定:将小鼠血清稀释2倍,取50 μL测定。将溶液混匀,室温静置10 min,550 nm,1 cm光径,蒸馏水调零,测各管吸光度值。计算方法见公式(8)。
(2)小鼠肝组织、脑组织T-SOD测定:取脑组织、肝组织匀浆上清用生理盐水稀释,取样50 μL测定。将试剂混匀,室温放置10 min,于波长550 nm处,1 cm光径比色杯,蒸馏水调零,比色。计算方法见公式(9)。
1.2.3.4 GSH-Px含量测定[25]
(1)小鼠血清GSH-Px测定:将小鼠血清2倍稀释,取100 μL测定。将各试剂与待测样品混匀,4000 r/min,离心10 min,取酶促反应上清液1 mL,将试剂与待测样品溶混匀,15 min后,412 nm处,1 cm光径比色杯,蒸馏水调零,测各管吸光度值。计算方法见公式(10)。
(2)小鼠肝组织、脑组织GSH-Px测定:取脑组织、肝组织匀浆上清取样200μL测定。操作同小鼠血清GSH-Px测定。计算方法见公式(11)。
1.2.4 数据处理
采用Origin Pro 2018软件进行图形绘制,SPSS 24.0版统计软件进行统计学分析。
2 结果与讨论
2.1 酶解法提取野山杏多肽的单因素试验
2.1.1 酶底物比对野山杏多肽水解度的影响
当酶底物比分别为1%、2%、3%、4%、5%,料液比1:20,pH为7.0,60 ℃酶解120 min时,水解度见图2。
由图2可知,水解度随酶底物比的增加而上升,酶底物比为3%时野山杏仁水解度为29.23%;当酶底物比大于 3%时,水解度趋于平稳,根据酶动力学原理,酶的用量过少不利于水解,过多不仅水解效果差,还会造成一定程度上的资源浪费[26]。因此,综合考虑选择酶底物比 3%作为野山杏多肽水解度最适酶底物比。
2.1.2 料液比对野山杏多肽水解度的影响
当酶底物比为3%,料液比分别为1:10、1:15、1:20、1:25、1:30,pH为7.0,60 ℃酶解120 min时,水解度见图3。
由图3可知,料液比对于水解度影响不大,野山杏多肽水解度在料液比为1:10时最低为21.66%,料液比1:25时水解度最大为27.07%,因此料液比为1:25时为最适料液比。
2.1.3 酶解时间对野山杏多肽水解度的影响
当酶底物比为3%,料液比为1:25,pH为7.0,60 ℃酶解30、60、120、180、240 min时,水解度见图4。
由图4可知,酶解时间对野山杏多肽水解度影响较大。酶解120 min时水解度最大为27.07%。水解时间180 min和240 min时,水解度降低。因此,水解时间不宜过长,以120 min为中点,取60、120、180 min做正交试验条件。
2.1.4 pH对野山杏多肽水解度的影响
当酶底物比为3%,料液比为1:25,60 ℃酶解120 min时,设定pH为4.0、5.0、6.0、7.0、8.0酶解,水解度见图5。
由图5可以看出,当pH值为4.0时,溶液呈酸性,野山杏多肽水解度为10.83%,为最低,可以看出酶解溶液呈酸性可抑制酶解,木瓜蛋白酶在酸性条件下可部分失活,酶解能力下降。当pH值为7.0时,为木瓜蛋白酶的酶解最适pH,水解度为25.99%。因此,正交试验选取pH为6.0、7.0、8.0三个梯度。
2.1.5 酶解温度对野山杏多肽水解度的影响
当酶底物比为3%,料液比为1:25,pH为7.0,酶解120 min时,不同温度50、55、60、65、70 ℃条件下,水解度见图6。
由图6可以看出,55 ℃时野山杏多肽水解度亦最大,为24.90%。随着温度的升高,水解度下降,说明温度越高,酶解能力越弱。由于温度过高会使木瓜蛋白酶失活,酶解能力下降。由于木瓜蛋白酶在水解过程中,最适pH值温度在55 ℃~65 ℃之间[27],因此选用55、60、65 ℃为正交试验条件。
2.2 正交试验结果与分析
在单因素试验结果与分析的基础上,对影响野山杏多肽水解度的四个因素进行L9(34)正交试验设计,试验因素水平表见表2,正交试验结果见表3,方差分析见表4。

表2 正交试验因素和水平设计表Table 2 Factors and levels of orthogonal experiment
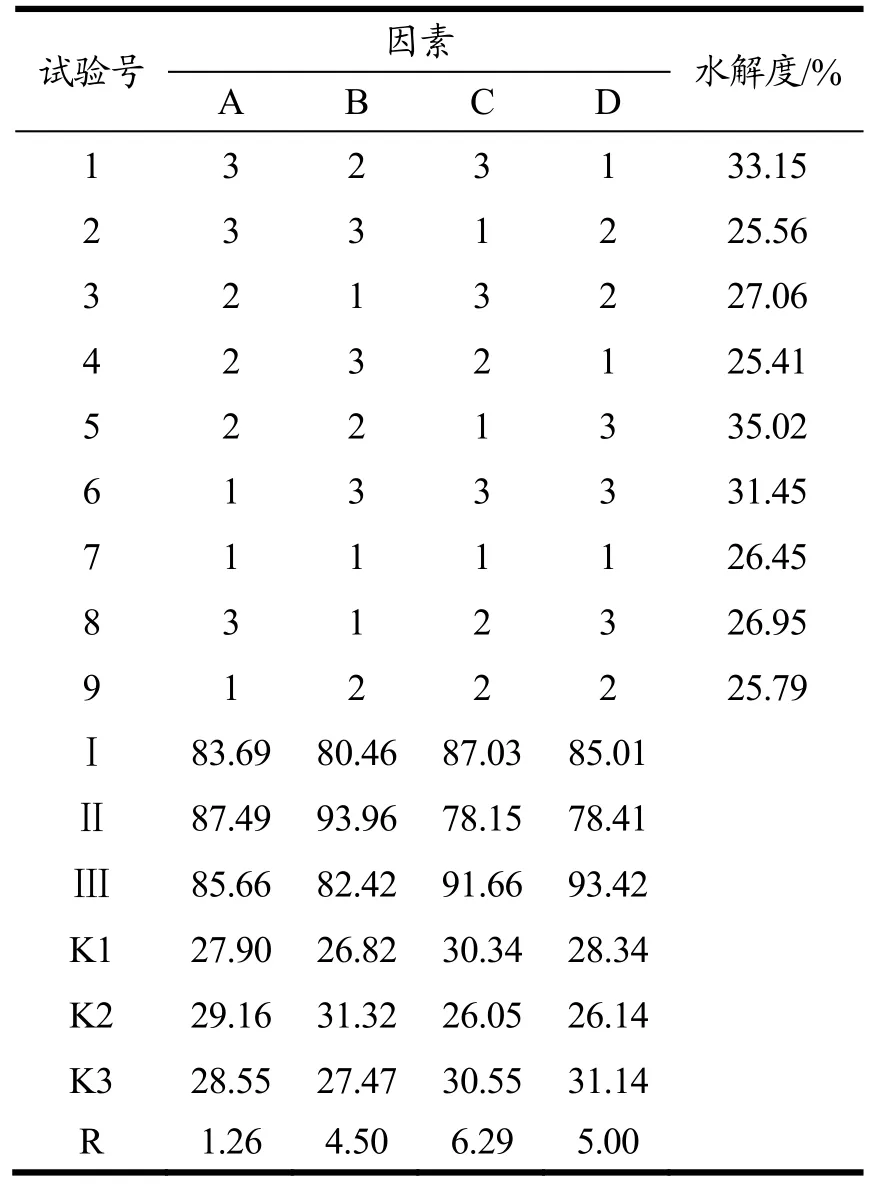
表3 正交试验结果Table 3 The result and analysis of orthogonal experiment
从表2~表4正交试验结果可以看出,以野山杏多肽水解度为评价指标,各个因素影响极差R大小的主次顺序依次为:C>D>B>A,即温度>pH值>酶解时间>酶底物比。因此,野山杏多肽提取最佳工艺组合为A2B2C3D3,即酶底物比为4%,酶解时间120 min,pH值为8.0,酶解温度为65 ℃。
从方差分析表4可以看出,pH值、酶解时间、酶解温度对野山杏多肽水解度影响差异极其显著(p<0.001),酶底物比对野山杏多肽水解度影响差异不显著(p>0.05)。
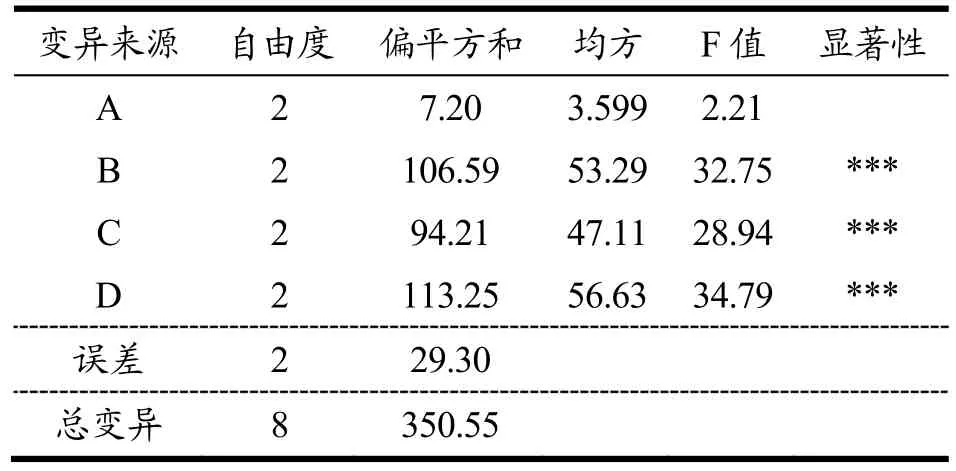
表4 方差分析结果Table 4 Results of analysis of variance
综上所述,酶解法提取野山杏多肽的最佳工艺为酶底物比为4%,酶解时间120 min,pH值为8,酶解温度为65 ℃。
2.3 验证试验
称取10 g野山杏仁粕放置于500 mL烧杯中,按1:25料液比加入250 mL去离子水,以酶底物比为4%加入木瓜蛋白酶,pH值为8,65 ℃水浴酶解120 min后,离心,分离上清液,测定多肽水解度。该试验过程平行进行三组。
通过验证试验可以得知:在此工艺条件下野山杏多肽水解度为35.73%,多肽液经过酸沉、洗脱、冷冻干燥,得白色粉末,得率为7.22%。
酶解法通常采用一种或多种蛋白酶,王琳等人[28]以杏仁粕为原料,通过脱脂和提取蛋白处理后,以木瓜蛋白酶和碱性蛋白酶作为复合酶解制备杏仁肽,以水解度为指标,最终杏仁蛋白水解度为23.60%;赵换霞等[29]通过响应面分析法研究并优化了扁杏仁抗氧化肽的酶解制备工艺,同时研究其体外抗氧化活性,以碱性蛋白酶-风味蛋白酶的复合酶制备的扁杏仁抗氧化活性肽水解度为 20.87%,本试验多肽水解度为35.73%,与上述文献进行比较,分别高出 12.13%和14.86%,由此可见本试验优化后的多肽提取工艺较优于对方。
2.4 野山杏多肽对衰老模型小鼠的抗氧化作用
2.4.1 试验前后小鼠的体重变化
试验数据以(¯X±SD)表示,采用SPSS 24.0统计软件分析试验数据。
通过表5可以看出,各组小鼠试验前后体重差别不明显(p>0.05),各组间试验小鼠体重无显著差异(p>0.05)。模型组小鼠注射D-半乳糖,30 d后体重略有下降,其余各组小鼠体重稍微增加。
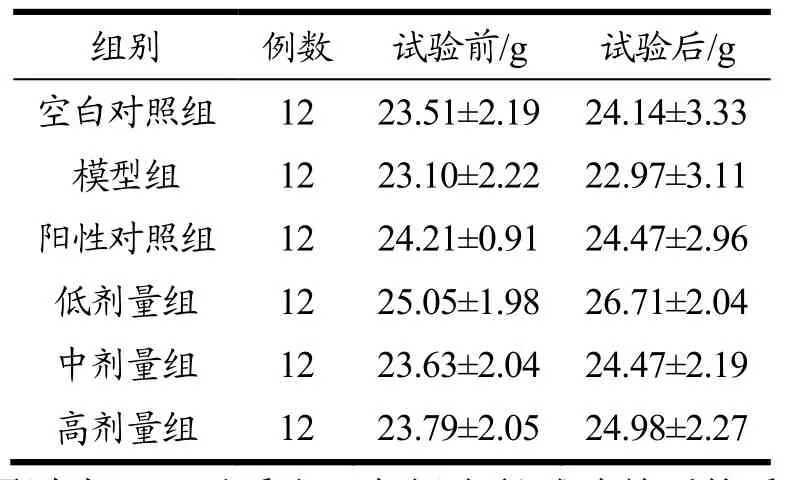
表5 试验中总体动物体重变化Table 5 The overall animal body weight change in the experiment (¯X±SD, n=12)
2.4.2 野山杏多肽对小鼠血清T-SOD、GSH-Px活性以及MDA含量的影响
试验数据以(¯X±SD)表示,采用SPSS 24.0统计软件分析,组间比较方差分析和t检验。试验结果见表6。
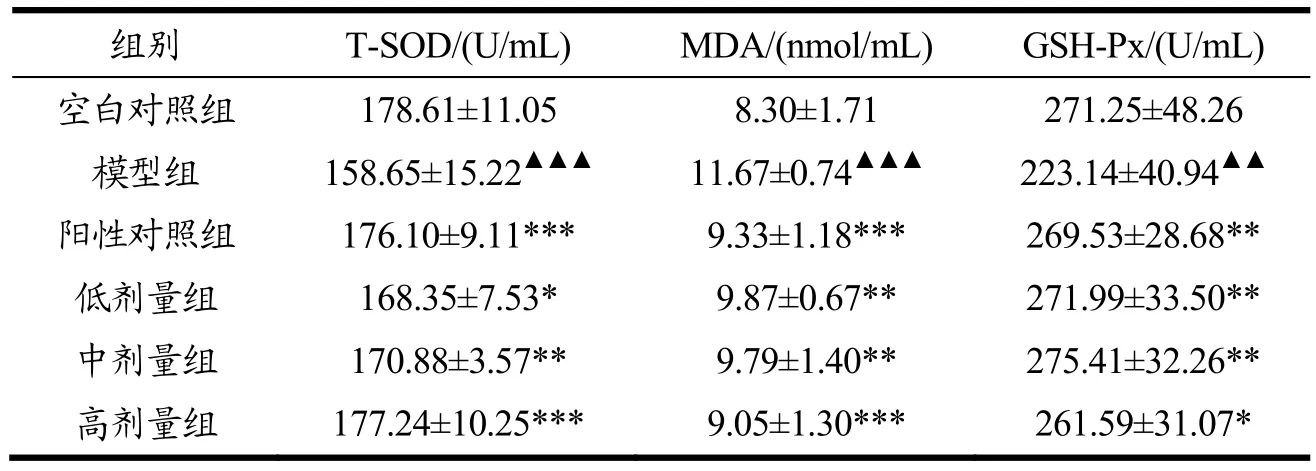
表6 野山杏多肽对小鼠血清T-SOD、GSH-Px活性以及MDA含量的影响Table 6 Effects of Noama Kyoto polypeptide on T-SOD, GSH-Px activity and MDA content in serum of mice (¯X±SD, n=10)
由表6可知,与空白对照组比,模型组小鼠血清T-SOD、GSH-Px活性极显著下降(p<0.001、p<0.01),MDA含量极显著升高(p<0.001),表明衰老模型小鼠造模成功。
MDA是体内含氧自由基与细胞膜表面脂质过氧化反应的产物,其含量反映体内脂质氧化损伤程度[30]。GSH-Px可以催化还原型谷胱甘肽(GSH)过氧化氢反应生成对机体无害的水和氧化型谷胱甘肽,从而保护细胞免受氧化胁迫和细胞损伤[31]。SOD几乎存在于所有生物细胞中,能够催化超氧化物转化,T-SOD活力的高低代表着机体清除氧自由基的能力大小[32]。
与模型组比,阳性对照组及低、中、高剂量组小鼠血清中T-SOD、GSH-Px活性显著升高(p<0.01或p<0.05 或p<0.001),MDA活性均极显著降低(p<0.001或p<0.01)。其中低剂量组GSH-Px活性达到271.99 U/mL,高剂量组T-SOD活力达到177.24 U/mL,与空白对照组结果相近;低、中、高剂量组小鼠T-SOD活性随着野山杏多肽给药量的增加而增加,具有剂量依赖性。说明不同剂量的野山杏多肽均能对小鼠血清中的MDA含量值以及T-SOD、GSH-Px活力产生显著影响。
2.4.3 野山杏多肽对小鼠肝组织 T-SOD、GSH-Px活性、以及MDA含量的影响
试验数据以(¯X±SD)表示,采用SPSS 24.0统计软件分析,组间比较才有方差分析和t检验。试验结果见表7。
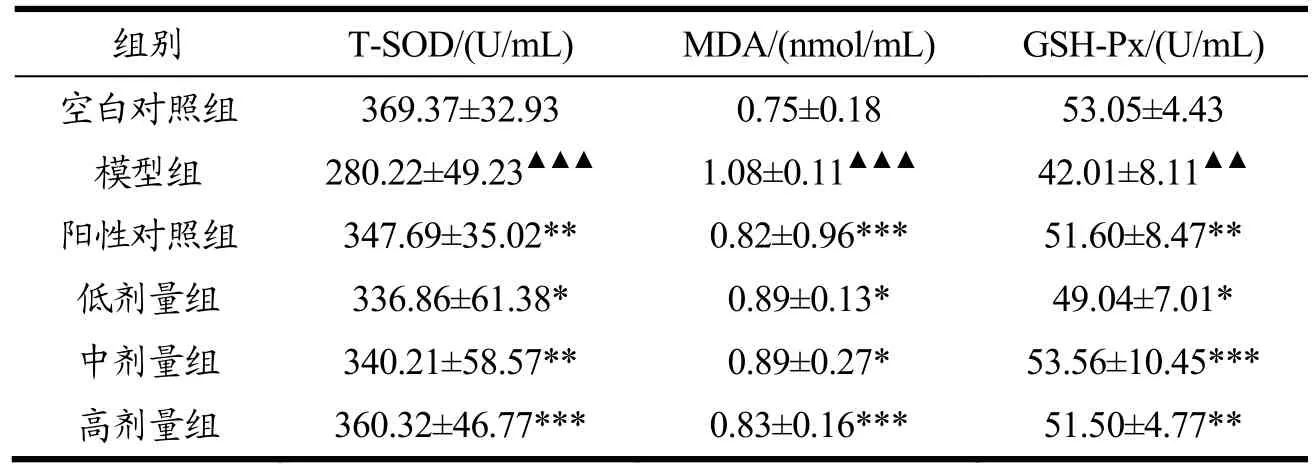
表7 野山杏多肽对小鼠肝组织T-SOD、GSH-Px活性以及MDA含量的影响Table 7 Effects of apricot kernel polypeptide on T-SOD, GSH-Pxactivity and MDA content in liver tissues of mice (¯X±SD, n=10)
由表7可知,与空白对照组比,模型组小鼠肝组织 T-SOD、GSH-Px活力极显著下降(p<0.001或p<0.01),MDA 含量极显著升高(p<0.001);与模型组相比,阳性对照组及各剂量组MDA含量不同程度的降低(p<0.05或p<0.001),T-SOD、GSH-Px活性均有不同程度的增加(p<0.01或p<0.05或p<0.001),其中T-SOD活性随着野山杏多肽剂量的增加而增加,具有剂量依赖性。说明不同剂量的野山杏多肽均能对小鼠肝组织中的 T-SOD、GSH-Px活性、以及MDA含量值产生影响。
2.4.4 野山杏多肽对小鼠脑组织 T-SOD、GSH-Px活性以及MDA含量的影响
试验结果以(¯X±SD)表示,采用SPSS 24.0统计软件分析试验数据,数据如表8所示。

表8 野山杏多肽对小鼠脑组织T-SOD、GSH-Px活性以及MDA含量的影响Table 8 Effect of Noama Kyoto polypeptide on T-SOD, GSH-Px activity and MDA content in the brain of mice (¯X±SD, n=10)
由表8可知,与模型组相比,中、高剂量组均可显著提高衰老小鼠脑组织中 T-SOD、GSH-Px活性(p<0.01),降低MDA含量(p<0.05或p<0.01),其中高剂量组MDA含量为1.84 nmol/mL,与空白对照组脑组织中MDA含量接近,表明当野山杏多肽给药剂量为100 mg/kg,给药周期30 d后,可使衰老模型小鼠脑组织中MDA含量显著降低并基本恢复至造模前水平。与低剂量组相比,中、高剂量组T-SOD及MDA数据差异较大,中高剂量组明显好于小剂量组,且数据更接近于阳性对照组。综上,中、高剂量组野山杏多肽均能对小鼠肝组织中的T-SOD、GSH-Px活性以及MDA含量值产生显著影响。
综上所述,本试验通过野山杏多肽各剂量组研究其对衰老模型小鼠的体内抗氧化作用,与模型组相比,各剂量组可以不同程度地增加小鼠体内 GSH-PX及T-SOD活力,降低MDA含量,其中以中、高剂量组效果较为明显,具有统计学意义。但野山杏多肽的不同剂量组的各项数据并未呈现出完全一致的变化趋势,可能是由于机体存在不同的抗氧化调节机制而导致的,其他研究也表明SOD和GSH-Px在某些状态下呈现出一定范围内的动态变化,而非绝对的同时增加,即当其中一种机制被激活时,另一种会呈现出有所抑制的状态[33]。
3 结论
本试验通过研究得到酶解法提取野山杏多肽的最佳工艺:酶底物比为4%,酶解时间120 min,pH值为8,酶解温度为65 ℃。并进行验证试验,得知:在此工艺条件下野山杏多肽水解度为35.73%,多肽液经过酸沉、洗脱、冷冻干燥,得白色粉末,得率为7.22%。通过上述工艺得到的野山杏多肽给予 D-半乳糖诱导的小鼠衰老模型,发现中、高剂量的野山杏多肽皆能提高衰老小鼠血清、肝组织以及脑组织匀浆中的T-SOD、GSH-Px活性,同时降低MDA含量,抑制血清及组织中的脂质过氧化。综上所述,本试验优化后提取的野山杏多肽对衰老小鼠具有良好的体内抗氧化作用。
