诱导自噬对朊病毒病治疗、作用机制的研究进展
2022-03-05黄雨妍李睿涵李佳津韦文君缑梦兰汪宁
黄雨妍,李睿涵,李佳津,韦文君,缑梦兰,汪宁
1.中国医科大学第一临床学院,辽宁沈阳 110001;2.中国医科大学法医学院,辽宁沈阳 110122
朊病毒病是由于异常折叠的朊蛋白——朊病毒蛋白(prion protein,PrPSc)的大量聚集引起的神经退行性疾病。而自噬作为体内清除错误折叠的蛋白质或抑制聚集的主要方式,通过多种途径如转录因子EB(transcription factor EB,TFEB)调控的自噬溶酶体途径(autophagy-lysosome pathway,ALP)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamy‐cin,mTOR)介导的自噬抑制途径和AMP 活化激酶(adenosine 5’-monophosphate-activated protein ki‐nase,AMPK)介导的ALP 途径等参与朊病毒病的发生,并成为在研究疾病的进展与治疗中不可忽视的存在,得到了广泛的研究。自噬在朊病毒病中的作用及作用机制并不明确,此外,过度自噬会加重朊病毒病的进展,这一观点引起了科学界的广泛关注。近年来,越来越多的科研工作者针对自噬在朊病毒病中的作用机制进行了大量研究,研究表明许多基于诱导自噬的药物在小鼠试验阶段甚至临床试验阶段都呈现出良好的治疗效果。文章总结了自噬在朊病毒病中的作用机制,详细阐明了诱导自噬对朊病毒病所产生的积极影响,这对探索朊病毒病的治疗具有重要意义。本文对临床常用药物如雷帕霉素、甲磺酸伊马替尼、白藜芦醇等进行了简单介绍,并简述了相关作用机制。现报道如下。
1 朊病毒病
朊病毒病也称为传染性海绵状脑病(transmis‐sible spongiform encephalopathy,TES),是一种能够感染人类和动物的致命性神经退行性疾病[1]。人类朊病毒病根据发病形式可以分为:①散发性人类朊病毒疾病,包括克鲁茨费尔特-雅各布病(creutzfeldtjakob disease,CJD)、致死性失眠和可变蛋白酶敏感性朊病毒病;②遗传性或家族性朊病毒病,一般是由相关编码基因突变所引起,包括家族性或遗传性克雅氏病、致命性家族性失眠症和格斯特曼综合征(gerstmann-sträussler-scheinker,GSS);③获得性人类朊病毒病,包括库鲁病、医源性克雅氏病和一种新的克雅氏病变异形式,仅占人类朊病毒病病例的5%[2]。在朊病毒病中,人体内与朊病毒病相关的正常蛋白(PrPC)的构象发生转变,形成一种错误折叠、富含β-折叠且易于聚集的病理形式,可称为朊病毒蛋白(PrPSc)[3]。在未感染的细胞中,PrPC通过内吞途径降解,然而对比PrPC易于被溶酶体水解酶降解,PrPSc对蛋白水解更具抵抗性,PrPSc的聚集能有效阻止朊病毒蛋白的降解[4]。体内错误折叠的毒性蛋白大量聚集[5],通过细胞凋亡使神经元丢失[6],造成严重的神经退行性变。
2 自噬
自噬指将细胞质货物输送到溶酶体的细胞降解途径,即细胞“吃掉自己”的过程,其不仅参与胞内物质运输,还起到清除细胞内受损的细胞器或错误折叠的蛋白质等废物并循环利用相关降解产物的作用,对维持人体正常的生理功能以及内环境的稳态至关重要。自噬通常根据其特定的生理功能、物质运输方式和途径分为3 类,分别为巨自噬、微自噬和分子伴侣介导自噬[7]。其中巨自噬最为普遍与典型,在此过程中,细胞接受自噬诱导信号后产生具有双层膜的吞噬泡,吞噬泡包裹受损的细胞器和蛋白形成自噬体,自噬体内的物质被转运到溶酶体并在酶的作用下进行降解,产生的大分子被释放回细胞质中以供再利用[8]。
3 自噬针对朊病毒蛋白的作用机制
在朊病毒病中,自噬具有降解聚集蛋白、减少聚集蛋白数量和降低其毒性的作用。上调自噬可以有效防止神经变性,从而减缓疾病的发展。ALP降解是细胞清除异常蛋白的主要方式。ALP 的缺陷会导致蛋白质聚集、有毒蛋白种类的产生和积累以及细胞器的功能失调。ALP 途径的作用机制主要概括为TFEB 调控的ALP 途径、mTOR 介导的自噬抑制途径、AMPK 介导的ALP 途径,这3 个途径既相互独立,又彼此联系。
3.1 TFEB 调控的ALP 途径
TFEB 是一种与溶酶体调控基因或协调溶酶体表达和调控(coordinated lysosomal expression and regulation,CLEAR)元件表达的启动子结合的转录因子[9],通过驱动自噬和溶酶体基因的转录,来促进自噬体溶酶体的形成[10]。进一步研究发现,TFEB增强了溶酶体蛋白的稳态,这些蛋白大多是发生了突变或错误折叠,同时TFEB 可以促进自噬体与溶酶体的融合[11]。TFEB 的亚细胞定位和活性受磷酸化水平的控制[12],激活后的TFEB 可迅速由细胞质转位到细胞核与靶序列基因结合,参与自噬的转录调控,诱导自噬[10]。在营养丰富的条件下mTOR 复合物1(mammalian target of rapamycin 1,mTORC1)可通过PI3K-Akt 途径被激活并使TFEB 磷酸化,磷酸化的TFEB 与14-3-3 蛋白结合,留在胞质,无法进入细胞核而失去驱动功能。压力条件下,mTORC1通过AMPK 途径失活,去磷酸化的TFEB 发生质核转位[13],发挥转录因子的功能。此外,Ca2+依赖的钙调神经磷酸酶的激活也可使TFEB 去磷酸化进入细胞核(图1)[14]。最新研究表明,microRNA(miRNA)可以控制TFEB 的表达和激活,调节TFEB 诱导的CLEAR 基因的转录[15]。
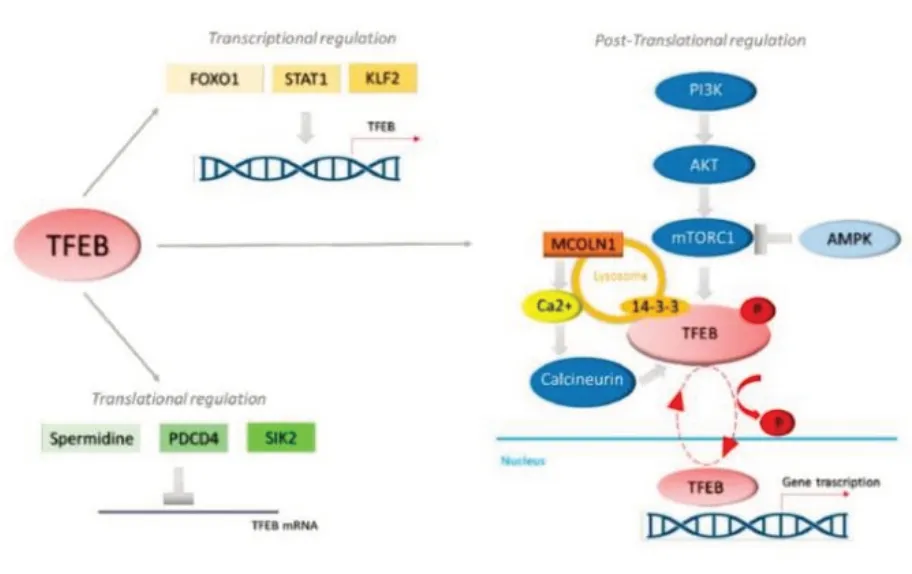
图1 TFEB 的激活途径
3.2 mTOR 介导的自噬抑制途径
mTOR 是一种丝氨酸/苏氨酸激酶,是哺乳动物自噬中研究最好的自噬调节因子,也是mTOR 复合物的催化亚基。根据结构差异,可以将mTOR 复合物分为mTORC1 和mTORC2[16]。
mTORC1 是营养和生长因子信号的主要传感器,可以影响生长因子、营养物质和细胞能量状态等多种输入信号。mTORC1 由富含脯氨酸的40 kDa的Akt 底 物(PRAS40)、mTOR 相互作 用蛋白(DEPTOR)、mTOR 的调节相关蛋白(Raptor)、G 蛋白β-亚基样蛋白(GβL)和mTOR 构成。当营养丰富的条件下,Akt 作用于PRAS40,使磷酸化的PRAS40 从Raptor 上解离后激活ULK1,抑制自噬溶酶体的形成。
mTORC2 由GβL、mTOR、mTOR 的雷帕霉素不敏感伴侣(Rictor)、应激激活蛋白激酶相互作用蛋白(SIN)1 和与Rictor 观察到的蛋白(protein ob‐served with Rictor,PROTOR)构成。饥饿条件下,mTORC2 通过FoxO3 信号通路调控自噬。mTORC2磷酸化作用于Akt,Akt 使FoxO3 基因表达的蛋白质(FoxO3)磷酸化,后者与14-3-3 蛋白结合,留在胞质,无法进入细胞核,抑制自噬基因转录的激活(图2)[17]。最新研究表明,mTORC2 可能也存在其他介导途径,多种途径共同负调控自噬基因的转录。
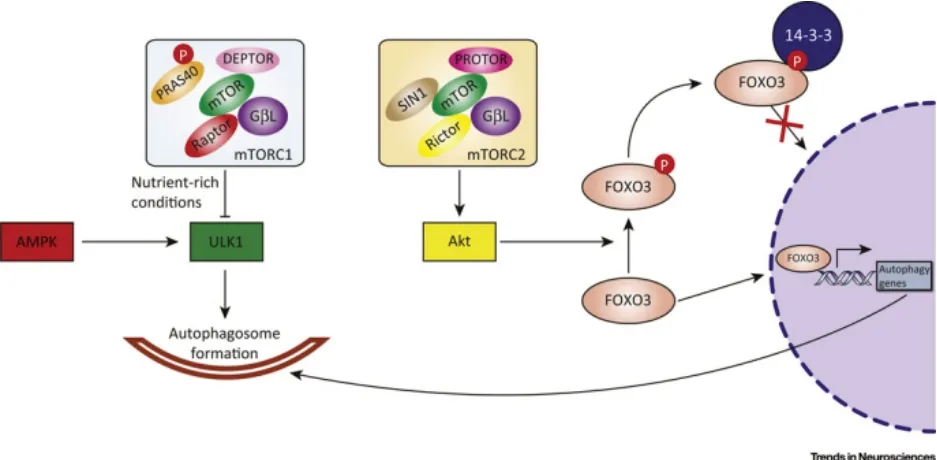
图2 mTOR 介导的自噬抑制途径
3.3 AMPK 介导的ALP 途 径
AMPK 可以响应能量状态与细胞质钙水平来进行自噬的调节。在营养充足时,三磷酸腺苷(ad‐enosine triphosphate,ATP)结合AMPK 的γ 亚基使其失活;在饥饿状态下,一磷酸腺苷(adenosine mono‐phosphate,AMP)结合于AMPK 的γ 亚基,通过肿瘤抑制激 酶(liver kinase B1,LKB1)使α 亚基上 的Thr172 磷酸化,激活AMPK,激活后的AMPK 可通过磷酸化mTORC1 上的Raptor 与TSC1/2 复合物使mTORC1 失活,阻断mTOR 介导的自噬抑制途径[18],达到诱导自噬的作用(图3)[19]。
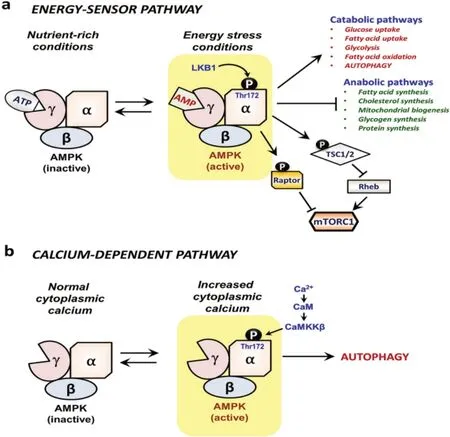
图3 AMPK 激活的两种途径
AMPK 还可以以AMP 独立的方式被激活,主要与细胞质中钙的含量有关。神经退行性疾病模型中反复观察到胞质Ca2+水平异常升高[20]。究其原因为钙蛋白酶介导的溶酶体膜完整性被破坏,从而导致溶酶体中大量组织蛋白酶泄漏,钙蛋白酶在细胞内结构中的致病性激活导致大脑中广泛的退行性疾病[21],特别是散发性克雅氏病,这是与朊病毒疾病相关的神经毒性的关键决定因素之一。细胞质钙是AMPK 和通过钙调蛋白/CaMKKβ 途径自噬的激活剂。细胞内钙水平的增加可使钙/钙调蛋白依赖性蛋白激酶激酶2(recombinant calcium/calmodu‐lin dependent protein kinase kinase 2,CAMKK2)被激活,激活后的CaMKK 以AMP 独立的方式磷酸化α亚基上Thr172,激活AMPK(图4)[15]。AMPK 激活后,可使自噬通量大大增加。AMPK 诱导的自噬与TFEB 转录因子的核转位有关。
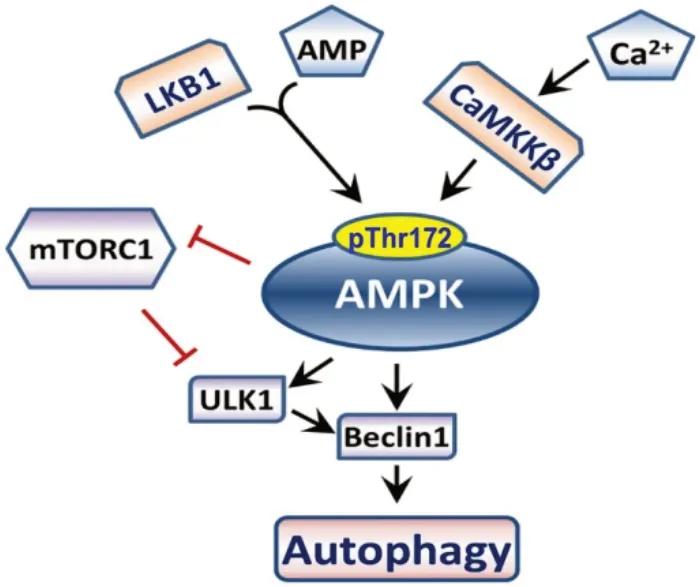
图4 AMPK 介导的自噬途径
保持钙的稳态和钙介导的AMPK 信号传导、纠正不平衡的钙蛋白酶-组织蛋白酶激活,可以更好地确保自噬功能的正常发挥,同时减轻钙超载带来的线粒体损伤等其他病理变化[22]。
4 利用自噬通路治疗朊蛋白病的药理学及病理学理论基础
4.1 自噬的药理诱导可减少朊病毒蛋白并减轻朊病毒病
各种体内、体外研究表明,自噬诱导会干扰朊病毒感染[23]。在持续性朊病毒感染的细胞或小鼠中研究了几种自噬的药理学诱导剂。其中一些化合物通过抑制mTOR 诱导自噬,对自噬进行负调节,其他化合物则在mTOR 非依赖性途径中工作[24]。
4.2 p62-Keap1-NRF2-ARE 信号通路
主动自噬可以从两个方面对神经元起到保护作用,降低氧化应激水平。一方面通过减少错误折叠的朊病毒数量,另一方面p62-Keap1-NRF2-ARE信号通路中NRF2 由磷酸化p62 触发从Keap1 上脱离,促使NRF2 转移到细胞核并激活抗氧化防御机制[25]。
通过p62-Keap1-NRF2-ARE 信号通路诱导的自噬可能为治疗常见神经退行性疾病提供有显著效果的新选择。由于药理学NRF2 激活对疾病的广泛作用,作者推断绝大多数神经退行性疾病都将适合以此途径进行靶向治疗。
5 各药物对阮蛋白病的临床调节作用
朊蛋白病是一类具有传染性的朊蛋白导致的散发性中枢神经系统变性疾病。目前的医疗水平对朊病毒尚无有效的对因治疗办法,主要是进行对症的治疗。病程迁延数年者很少见,在治疗朊蛋白病过程中较常使用的药物有如下几种。
5.1 甲磺酸伊马替尼(Gleevec,STI571)
甲磺酸伊马替尼(Gleevec,STI571)是一种酪氨酸激酶c-Abl 的抑制剂[26]。该药处于小鼠实验阶段,感染早期可明显降低PrPSc在小鼠脾脏中的负荷,主要在中枢神经系统外发挥抗朊病毒蛋白的作用,从而延长小鼠的存活时间。对于严重感染后期,该药物是否能持续发挥显著效果,以及如何确定最佳的给药量仍然是需要探究的问题。
5.2 AR-12(OSU-03012)
AR-12 属于塞来昔布的一种衍生物,也被称为OSU-03012,具有强大的抗朊病毒作用[27]。该药处于细胞试验阶段,治疗2 周后,AR-12 在持续感染朊病毒的神经元(ScN2a)和非神经元(ScMEF)培养细胞中完全消除了朊病毒感染,然而AR-12 诱导自噬的具体机制尚不明确。
5.3 白藜芦醇(3-4'-5-trihydroxystilbene)
葡萄中富含的天然酚和植物毒素可以治愈SMBs15 细胞中的朊病毒感染[28]。白藜芦醇的抗朊病毒和神经保护作用主要归因于通过激活Sirt1(Ⅲ类组蛋白去乙酰化酶)诱导自噬[29]。
5.4 其他药物
PPS、奎纳克林通过稳定PrPC并减少其向PrPSc的转化来防止PrPSc聚合物的积累。姜黄素(Cur)具有抗淀粉样蛋白特性和神经保护作用,亲脂性Cur可穿过血脑屏障在脑中抑制朊病毒蛋白的聚集[30]。其他的有抗朊病毒作用的药物有刚果红、马来酸氟吡啶、硫磺素、铁的四吡咯衍生物。
5.5 典型药物的药理机制与作用效果
5.5.1 自噬诱导剂雷帕霉素(Rapamycin)雷帕霉素是经典的哺乳动物雷帕霉素靶蛋白(mTOR)抑制剂和被认可的自噬诱导物,可延长小鼠存活时间。相较于甲磺酸伊马替尼,雷帕霉素可顺利通过血脑屏障,在中枢神经系统发挥作用。已经确定自噬诱导剂雷帕霉素可应用于临床治疗,可以通过靶向抑制mTOR 依赖的自噬抑制途径来降低PrPSc的聚集水平。
雷帕霉素的靶标(target of rapamycin,TOR)是一种进化保守的丝氨酸/苏氨酸激酶,可感知和整合来自环境的信号,以协调发育和代谢过程[31]。TOR在条件有利时感知营养、激素、代谢物和压力信号,以促进细胞和器官的生长。然而,当条件不利时,TOR 会受到抑制,从而促进自噬等分解代谢过程。
5.5.2 候选药物二甲双胍(Metformin)有研究表明,二甲双胍对神经退行性疾病有治疗作用。二甲双胍减少了朊病毒感染,并诱导持续感染22 L 朊病毒的N2a 细胞自噬。用二甲双胍处理22 L-ScN2a 细胞7 d 可降低朊病毒载量。诱导自噬可能是二甲双胍减轻N2a 细胞中朊病毒感染的机制之一。
此外,二甲双胍诱导持续感染RML 朊病毒的ScCAD5 细胞自噬。朊病毒由具有不同构象稳定性和生化性质的各种菌株组成。采用二甲双胍治疗RML 感染的ScCAD5 细胞,10 d 后可减少朊病毒感染,这表明二甲双胍的体外抗朊病毒作用可能与菌株和细胞类型无关,但抗病毒作用的效力在不同的菌株与细胞类型之间有差异。
为测试二甲双胍在体内的治疗效果,接种并使小鼠在脑脊髓内感染22 L 朊病毒。从接种之日起,在饮用水(2 mg/mL)中用二甲双胍对小鼠进行治疗110 d。与对照组相比,结果显示二甲双胍治疗组的存活时间没有增加,并且接受二甲双胍的小鼠没有表现出任何低血糖现象。多项实验表明,二甲双胍只能暂时降低朊病毒负荷,并不能根除朊病毒感染,长期使用无法治愈感染细胞。短期使用对症状有改善作用,长期使用对疾病转归的影响有待深入研究。
以上结果表明,自噬在朊病毒病中起到至关重要的作用,在患者和实验接种小鼠的大脑中也可以观察到自噬体。然而,这种水平的自噬不足以解决朊病毒感染。使用化合物增强自噬已被证明可以增加PrPSc降解,限制其外泌体释放,并具有神经保护作用。虽然这些通过自噬干扰朊病毒繁殖的多种方式在体外是高效的,但只有少数化合物可以有效地提高朊病毒感染小鼠的存活率、延长存活时间,临床试验阶段仍处于萌芽状态。未来需要新的方法来发现更多有效的药物,改善体内抗朊病毒作用的一种可能方法是联合治疗,例如:与自噬诱导剂和抑制从头朊病毒转化的化合物联合处理可协同抗朊病毒作用。某些单一药物常存在缺陷,如甲磺酸伊马替尼穿透血脑屏障的效果较差,因此,另一种策略可以是在现有的药物基础上对药物进行功能化修饰,促进药物通过血脑屏障,进入到大脑中发挥作用。阐明自噬在朊病毒感染中的作用机制,将可行性方案应用到临床治疗,挽救患者的生病、延长患者的生存时间,是每一位医疗科研人员的共同目标。
6 总结
朊病毒病是一种由毒性蛋白(PrPSc)异常大量聚集所导致的严重神经退行性疾病,而PrPSc毒性蛋白多由中枢系统中正常的朊蛋白PrPC异常折叠形成。目前全球范围内治疗手段有限,患者2 年生存率较低。朊病毒相关的自噬机制的研究对于探寻延缓疾病进程及治疗朊病毒病的新思路与有效方案具有重要意义。本文阐述了自噬在朊病毒病中通过TFEB 调控的ALP 途径、mTOR 介导的自噬抑制途径、AMPK 介导的ALP 途径3 个主要机制来增加自噬通量、调节PrPSc在体内的聚集。ALP的缺陷会导致蛋白质聚集、有毒蛋白种类的产生和积累以及细胞器的功能失调,维持ALP 途径的稳定可为治疗带来新希望。TFEB 在ALP 的3 种自噬途径中起着至关重要的作用,如何调控TFEB 的表达或许可作为一个新的突破口。此外,靶向抑制mTOR 介导的自噬抑制途径是诱导自噬、降低PrPSc聚合物的有效途径。现有药物中雷帕霉素是经典的mTOR 抑制剂,可有效延长小鼠存活时间,相较于甲磺酸伊马替尼来说,雷帕霉素有可能顺利通过血脑屏障,在中枢神经系统发挥作用,弥补甲磺酸伊马替尼只在中枢神经系统外发挥作用的缺陷。目前在临床阶段,已经确定使用自噬诱导剂雷帕霉素治疗可以通过靶向抑制mTOR 依赖的自噬抑制途径来降低PrPSc的聚集水平。在自噬通量的检测方面,LC3-Ⅱ和p62 蛋白的表达量是良好的观测指标。LC3-Ⅱ下调、p62 蛋白上调均可说明自噬通量的减低,此时提示或许可将诱导自噬作为有效的治疗途径,为朊病毒病的治疗带来希望。同时,在诱导自噬时保持钙的稳态和钙介导的信号传导、纠正不平衡的钙蛋白酶-组织蛋白酶激活,可以更好地确保自噬功能的正常发挥,减轻钙超载带来的线粒体损伤等其他病理变化。以上3 种自噬在朊病毒病中的机制为临床靶向抗朊病毒病药物的研发提供了新思路。从目前研究结果来看,雷帕霉素与二甲双胍是较为有效的药物,其他基于以上机制的药物还包括甲磺酸伊马替尼、AR-12、白藜芦醇、PPS、奎纳克林、多西环素、刚果红、马来酸氟吡啶、硫磺素、铁的四吡咯衍生物等。然而,过度诱导自噬可能会造成严重的后果,如何寻找自噬通量调控点、解决过度自噬带来的不良反应,以及在严重感染后期药物是否能持续发挥显著效果、如何确定最佳的给药量,都是未来科研工作者探索与努力的方向。
