基于非靶向代谢组学分析酿酒酵母甲酸胁迫的响应和耐受性机制
2022-03-05曾令杰丰丕雪黄锦翔梁大呈佀再勇龙秀锋伍时华
曾令杰,丰丕雪,黄锦翔,梁大呈,佀再勇,龙秀锋,伍时华,易 弋
(广西科技大学生物与化学工程学院,广西糖资源绿色加工重点实验室,广西 柳州 545006)
燃料乙醇代替传统化石燃料可带来许多环境和社会效益[1]。酿酒酵母(Saccharomyces cerevisiae)作为常用的乙醇生产者具有许多优势,例如生长周期短、发酵能力强以及对木质纤维素水解产物中存在的乙醇[2]有更高的抵抗力,包括渗透压[3]和弱酸[4]等。然而,在木质纤维素原料预处理和水解过程中会产生对细胞有毒的化合物,根据这些有毒化合物的来源分为弱酸、呋喃衍生物和酚类化合物3 大类[5-6],这些毒素能抑制细胞生长,并对发酵微生物的性能产生负面影响[7-8]。因此,研究酵母细胞对木质纤维素水解液中各种胁迫环境的耐受性很重要。甲酸、乙酸和乙酰丙酸是木质素纤维素水解液中一些常见的弱酸类抑制剂[9],在这些几种弱酸中,虽然甲酸含量较乙酸和乙酰丙酸低,通常约为乙酸(10~20 g/L)的1/10,但其对酵母细胞的毒性最强[10-11]。因此,研究甲酸对酵母细胞的毒性机理及其解毒机制非常重要。
近年来,关于酿酒酵母对各种应激的研究越来越多,对酵母细胞应激反应的分子机制有了更好的认识[12-14]。 代谢组学是继基因组学和蛋白质组学之后发展起来的一门新学科[15]。Nugroho等[16]采用代谢组学方法研究乳酸诱导的胁迫对酵母代谢物库的影响,结果表明,外源添加脯氨酸能够抵抗乳酸诱导的氧化损伤,提高细胞的生长速率,保护细胞免受酸胁迫。Devantier等[17]通过代谢组学研究乙醇对酿酒酵母细胞代谢的影响,结果发现酵母细胞能量消耗增加,细胞内丙酮酸和相关代谢产物的含量明显提高。Jung等[18]利用代谢组学研究探讨酿酒酵母对糠醛的响应,发现酿酒酵母进行全局代谢分配以快速抵御胁迫,与能量产生、辅因子再生和细胞损伤恢复相关的代谢产物在胞内大量积累。因此,研究酿酒酵母细胞的环境胁迫耐受性具有重要意义。本实验采用非靶向代谢组学分析,从代谢水平系统分析酿酒酵母对甲酸抑制剂的耐受机理,以期为酵母耐性调节机制的研究提供理论依据。
1 材料与方法
1.1 材料与试剂
酿酒酵母(S. cerevisiaeGGSF16)由广西科技大学微生物研究室保存;酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基(酵母粉10 g/L、蛋白胨20 g/L、葡萄糖20 g/L)、发酵培养基(酵母粉 10 g/L、蛋白胨20 g/L、葡萄糖100 g/L,pH值自然,121 ℃灭菌20 min)由实验室自制。
甲酸(分析纯) 西陇科学股份有限公司; 甲酸、甲醇、乙腈、2-丙醇(均为色谱纯) 美国Fisher Chemical公司。
1.2 仪器与设备
Triple TOF 5600三重四极杆质谱、ExionLC AD液相色谱系统 美国AB SCIEX公司;HSS T3色谱柱(100 mm×2.1 mm,1.8 μm) 美国Waters公司;JXDC-20氮气吹扫仪 上海净信实业发展有限公司;LNG-T88台式快速离心浓缩干燥器 太仓市华美生化仪器厂;Wonbio-96c高通量组织破碎仪 上海万柏生物科技有限公司;Centrifuge 5430R高速冷冻离心机 德国Eppendorf公司;AR224CN电子天平 奥豪斯仪器(常州) 有限公司。
1.3 方法
1.3.1 甲酸胁迫对酵母细胞生长的影响
根据本课题组研究[19]的初步筛选结果,确定甲酸对酿酒酵母半致死质量浓度为1.8 g/L。以10%接种量将活化的酵母细胞接种到200 mL发酵培养基中,在30 ℃、 150 r/min摇床中培养6 h至对数生长中后期,此时菌液浓度约为3.68×107CFU/mL。以添加终质量浓度1.8 g/L甲酸溶液的菌液为处理组,未添加甲酸为对照组,在摇床中继续培养,每隔2 h取样用紫外分光光度计在600 nm波长处测定培养液光密度OD600nm,设置3 次生物学重复。
1.3.2 甲酸对酵母细胞发酵能力的影响
采用二氧化碳失重法[20],以10%接种量将酵母细胞悬液接入到200 mL发酵培养基中,分别吸取一定体积40 g/L甲酸母液于培养基中,使甲酸终质量浓度分别为1.0、1.2、1.4、1.6、1.8、2.0 g/L,以未添加甲酸为对照组,30 ℃、150 r/min摇床中进行培养。在发酵过程中称量发酵瓶质量(精确到0.01 g),称前需摇晃发酵瓶,赶除二氧化碳。计算各取样时间点发酵瓶质量差值,即为二氧化碳释放量。设置3 次生物学重复。
1.3.3 胞内代谢物的制备和提取
将活化的菌种接种于新鲜YPD培养基中,30 ℃、150 r/min摇床培养至对数生长中期,加入终质量浓度1.8 g/L的甲酸溶液,继续培养2 h。取发酵液3 mL,12 000 r/min、4 ℃离心10 min,弃上清液,用预冷的磷酸盐缓冲液洗涤菌体,再于12 000 r/min、4 ℃离心5 min,弃去上清液,得到新鲜菌体于离心管中,-80 ℃处理10 min。取50 mg固体酵母至2 mL加厚离心管中,加入800 μL提取液(甲醇-水(4∶1,V/V)),加入20 μL内标溶液(L-2-氯-苯丙氨酸,0.3 mg/mL,乙腈配制),冷冻组织研磨仪(-10 ℃、50 Hz)研磨6 min,低温超声(5 ℃、40 Hz)提取30 min,然后放入-20 ℃冰箱中,静置30 min后13 000 r/mim、4 ℃离心15 min,移取上清液至带内插管的进样瓶中待测。实验设置6个生物学重复。
1.3.4 液相色谱-质谱分析
采用UHPLC-Q Exactive系统。液相色谱条件:HSS T3色谱柱(100 mm×2.1 mm,1.8 μm);流动相A为体积分数0.1%甲酸-水溶液,流动相B为含体积分数0.1%甲酸的乙腈-异丙醇(1∶1,V/V),流速 0.40 mL/min;柱温40 ℃;进样量2 μL。
质谱条件:信号采集采用正负离子扫描模式,质量扫描范围m/z70~1 050;电喷雾电离源,正离子电压3 500 V,负离子电压2 800 V,鞘气压力40 psi,辅助加热气压力10 psi,离子源加热温度400 ℃,循环碰撞能20~60 eV。
1.3.5 差异代谢物分析
采用有监督的正交偏最小二乘判别分析(orthogonal partial least squares discrimination analysis,OPLS-DA)模型区分各组间代谢特性的总体差异,其中以变量投影重要性(variable importance projection,VIP)大于1和P值小于0.05为标准筛选差异代谢物,并通过京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库(https://www.kegg.jpkeggpathway.html)进行代谢通路注释,获得差异代谢物参与的通路。使用R软件包ropls(Version1.6.2)进行主成分分析(principal component analysis,PCA),Python软件包scipy.stats进行通路富集分析。
2 结果与分析
2.1 甲酸对酵母细胞生长的影响
由图1可知,对照组在6 h进入对数生长中期,8 h进入稳定期;培养6 h添加1.8 g/L甲酸后,处理组酵母细胞的生长立即受到抑制,酵母细胞生长缓慢,可能在适应新的环境。而随着培养时间的延长,酵母细胞缓慢生长,最终细胞生长量明显低于对照组。这说明甲酸对酵母细胞的生长繁殖具有一定的抑制作用。

图1 甲酸对酵母细胞生长的影响Fig. 1 Effect of formic acid on the growth of yeast cells
2.2 甲酸对酵母细胞发酵能力的影响
酿酒酵母在乙醇发酵过程中会产生大量CO2,CO2释放量可以直接指示酵母发酵时间和发酵活力,是评价酿酒酵母发酵能力最简便快速的方法[21]。由图2可知,不同质量浓度甲酸均影响了酿酒酵母CO2释放特性,且存在明显的浓度依赖效应。对照组在培养8 h CO2释放量达到最大;添加1.0、1.2 g/L和1.4 g/L甲酸处理组的CO2释放量也在8 h达到最大,但释放量均低于对照组;添加1.6 g/L甲酸处理组的CO2最大释放量出现在10 h,较对照组延长了2 h;添加1.8 g/L甲酸处理组的CO2最大释放量出现在12 h,较对照组延长了4 h,说明1.8 g/L甲酸对酵母细胞的发酵能力具有一定的抑制作用。添加2.0 g/L甲酸处理CO2释放量不到0.1 g,说明高质量浓度甲酸对酵母细胞具有强烈的毒害作用。
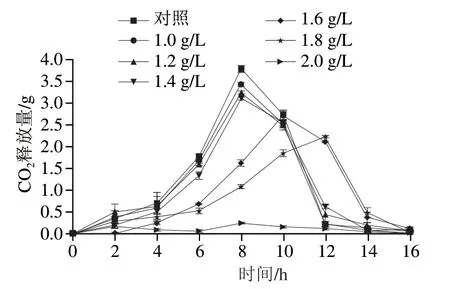
图2 甲酸质量浓度对酵母细胞发酵能力的影响Fig. 2 Effects different concentrations of formic acid on carbon dioxide release during yeast fermentation
2.3 代谢组学的数据质控
质控工作是进行基于质谱技术的代谢组学研究时获得可靠且高质量数据的基础[22]。采用PCA对数据进行质控分析,可用于发现异常样本、评价质控重复性。图3A、B分别为正、负离子模式下质控样本的PCA得分图,质控样本检测结果较为密集的聚在一起,说明质控重复性良好,分析系统稳定,所采集的样品数据可作进一步差异分析。
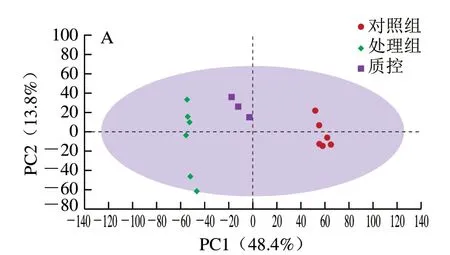
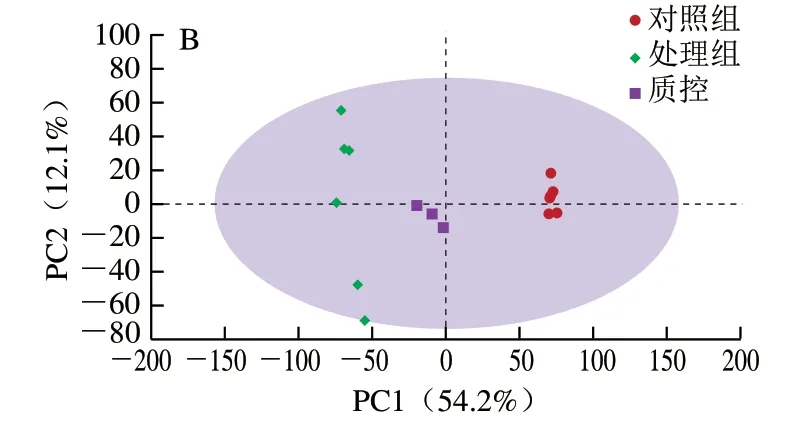
图3 质控样本PCA的得分图Fig. 3 PCA score plots of quality control samples
2.4 代谢组学的PCA结果
为判别对照组和1.8 g/L甲酸处理组之间是否具有差异,本研究采用PCA建模方法对两组进行分析。PCA结果表明,在正离子模式下PC1贡献率为53.10%,PC2贡献率为16.00%,两者累计贡献率达到69.1%。负离子模式下PC1贡献率为61.10%,PC2贡献率为14.10%,两者累计贡献率达到75.2%。如图3所示,两组样品基本都处于95%置信区间内,处理组和对照组6个重复数据点检测结果基本都能很好地集中在一起,说明在整个实验过程中实验操作、仪器分析稳定,数据重复性较好,可用于后续分析。
2.5 代谢组学的OPLS-DA结果
不同于PCA,OPLS-DA是一种有监督的学习方法,能很好地分离样品且更利于寻找差异代谢物。由图4可知,两组样本都能聚成一类,且区分明显,说明该实验重复性好,结果与PCA结果类似。此外,在正离子模式下,R2X=0.79,R2Y=0.999,Q2=0.997,负离子模式下,R2X=0.846,R2Y=0.999,Q2=0.998,这3个指标都接 近于1,表明OPLS-DA模型稳定可靠,且能较好地预测对照组和处理组酵母细胞内差异代谢物。为防止OPLS-DA 模型的过度拟合,采用置换检验法对OPLS-DA模型进行验证,结果表明,根据正、负离子模式数据建立的 OPLS-DA模型未发生过拟合。
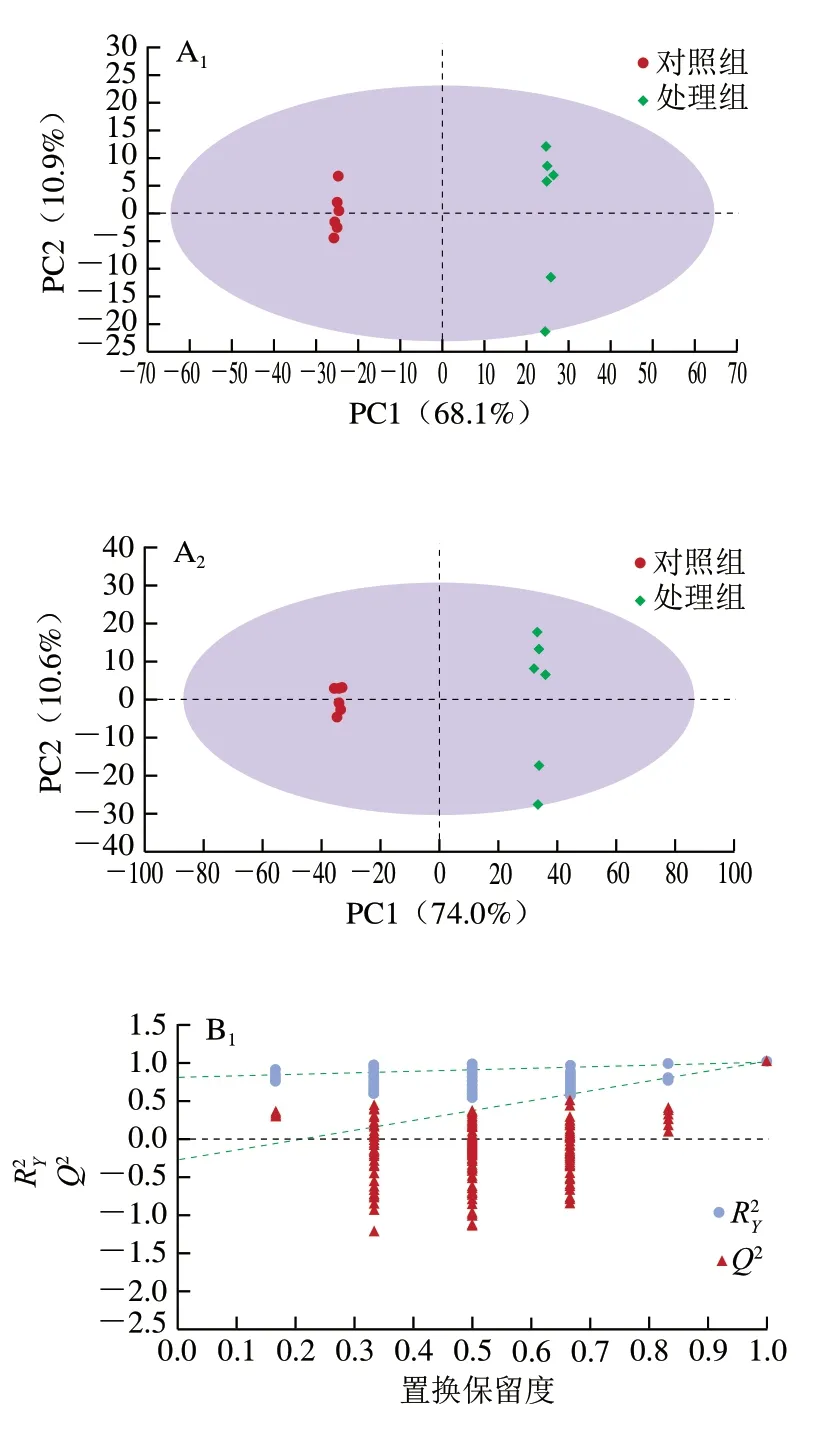

图4 不同组代谢物的OPLS-DA得分图(A)和置换检验图(B)Fig. 4 OPLS-DA score plots (A) and permutation test charts (B) of differential metabolites
2.6 差异代谢物筛选
采用OPLS-DA模型的VIP>1、P<0.05为筛选标准,初步筛选出两组的差异代谢物,共检测出差异代谢物226种,其中有123种代谢物显著上调,103种代谢物显著下调,表1为甲酸处理后酵母细胞内部分差异代谢物。
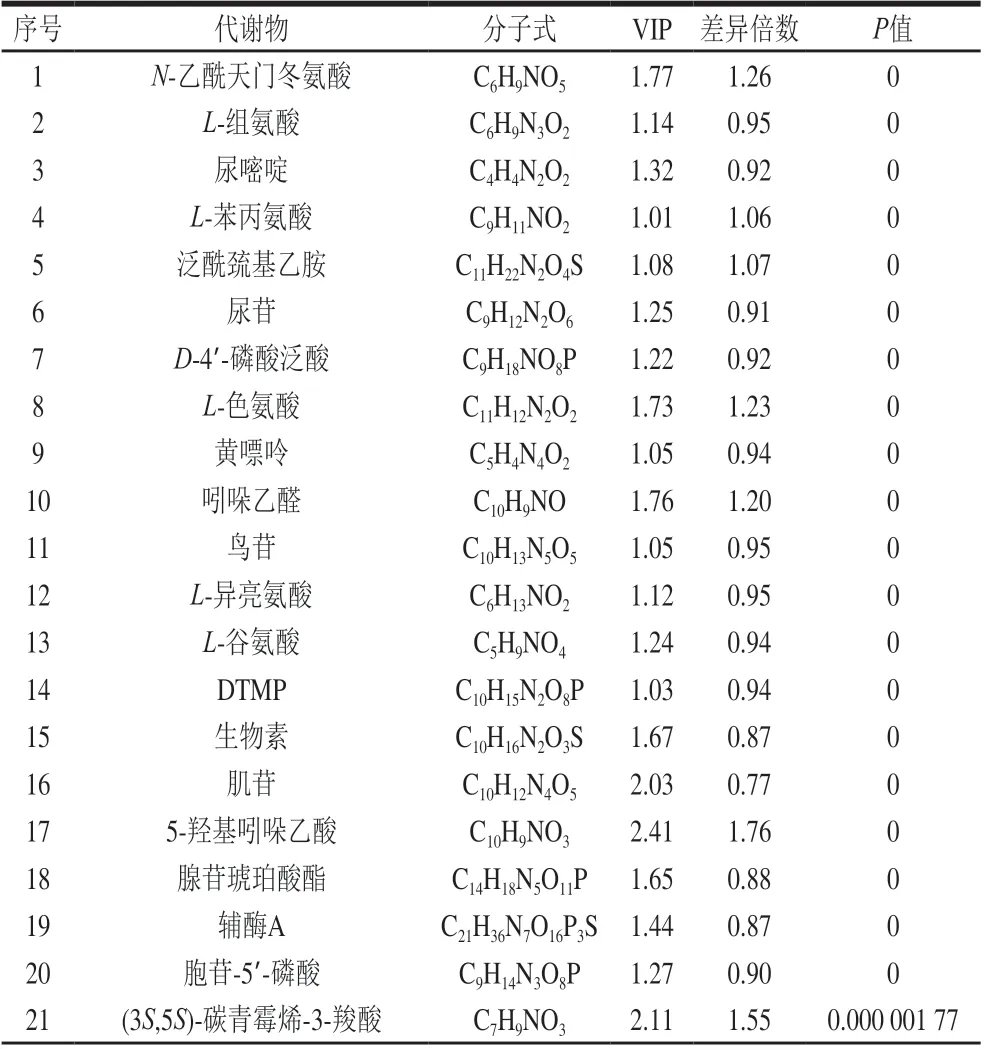
表1 甲酸处理后酵母细胞内部分差异代谢物Table 1 Differential metabolites in yeast cells treated with formic acid
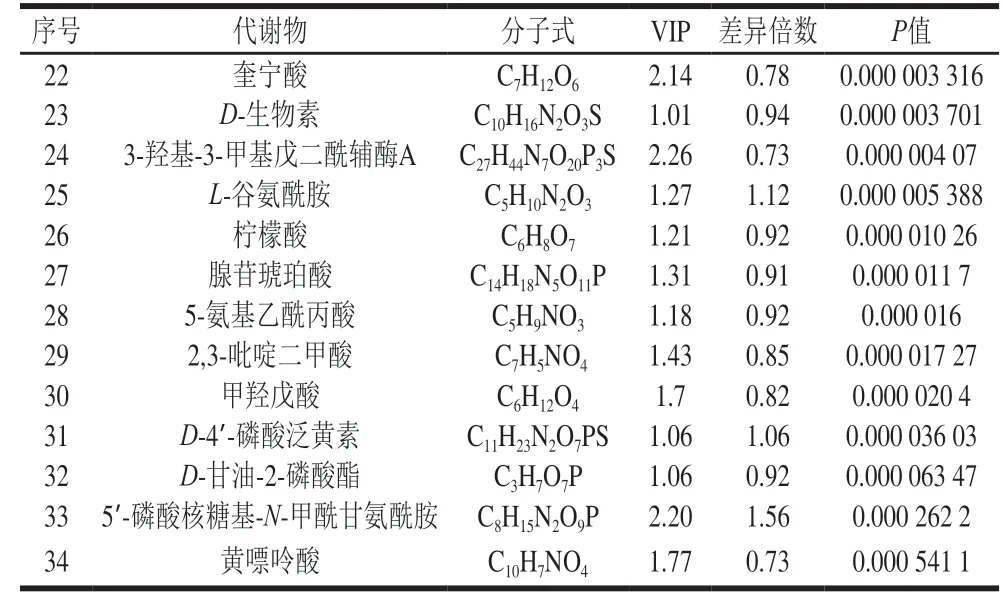
续表1
2.7 差异代谢物KEGG通路富集分析
通过KEGG分析发现这些差异代谢物共富集到45 条通路,共涉及55种代谢物,其中显著富集的代谢通路有18 条。如图5所示,有7 条氨基酸代谢通路受到显著富集,且覆盖差异代谢物最多的3 条氨基酸代谢通路分别为丙氨酸、天冬氨酸和谷氨酸代谢,色氨酸代谢以及β-丙氨酸代谢通路;其余显著富集的通路分别为泛酸和CoA生物合成,氨酰基tRNA的生物合成,碳青霉烯生物合成,嘌呤代谢,ATP结合盒蛋白转运,嘧啶代谢,乙醛酸和二羧酸的代谢,苯丙氨酸、酪氨酸和色氨酸的生物合成,谷胱甘肽代谢,氧化磷酸化,氰氨基酸代谢,氮素代谢,甘氨酸、丝氨酸和苏氨酸的代谢,甘油磷脂代谢和精氨酸生物合成代谢通路。KEGG通路富集表明甲酸胁迫引发了酵母细胞的代谢紊乱,特别是氨基酸代谢和核苷酸代谢受到影响最大,这些代谢通路可能在酿酒酵母耐受甲酸胁迫的研究中有重要意义。
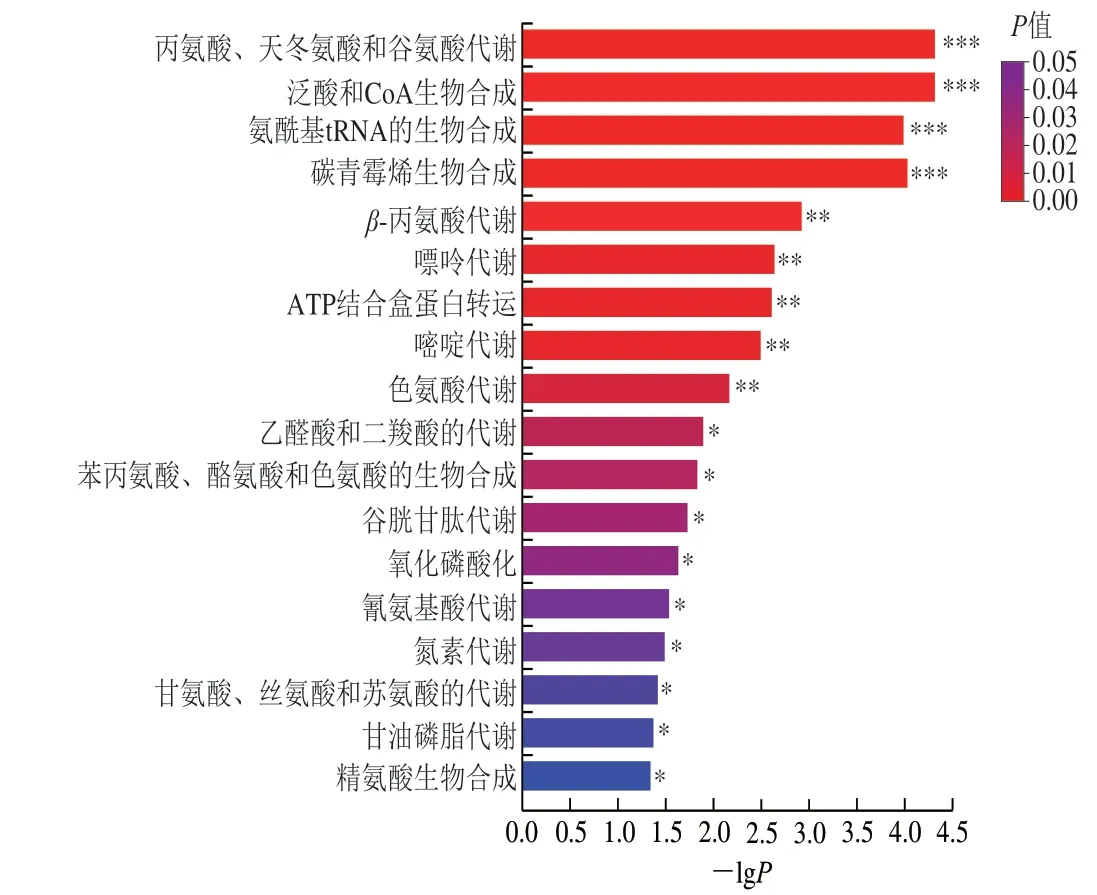
图5 差异代谢物KEGG富集通路图Fig. 5 KEGG enrichment pathways of differential metabolites
2.8 代谢通路分析
将拓扑分析和富集分析结合,进一步判断某一代谢通路是否在所研究的生物学过程中起到关键作用。对甲酸处理组和对照组之间有显著差异的代谢产物进行途径富集和拓扑分析,从而识别出甲酸对酵母细胞代谢通路的潜在影响,结果如表2和图6所示。图6中每一个气泡表示一种KEGG通路,气泡大小代表重要性,气泡越大,表示代谢物在通路中的重要性越大。在甲酸的影响下共鉴定出43 条代谢途径,重要性得分排名前20的代谢通路中,重要性值大于0.1的潜在代谢通路有9 条,包括丙氨酸、天冬氨酸和谷氨酸代谢,泛酸和CoA生物合成,嘧啶代谢,色氨酸代谢,组氨酸代谢,酮体的合成与降解,脂肪酸降解,糖酵解/糖异生以及赖氨酸的生物合成。
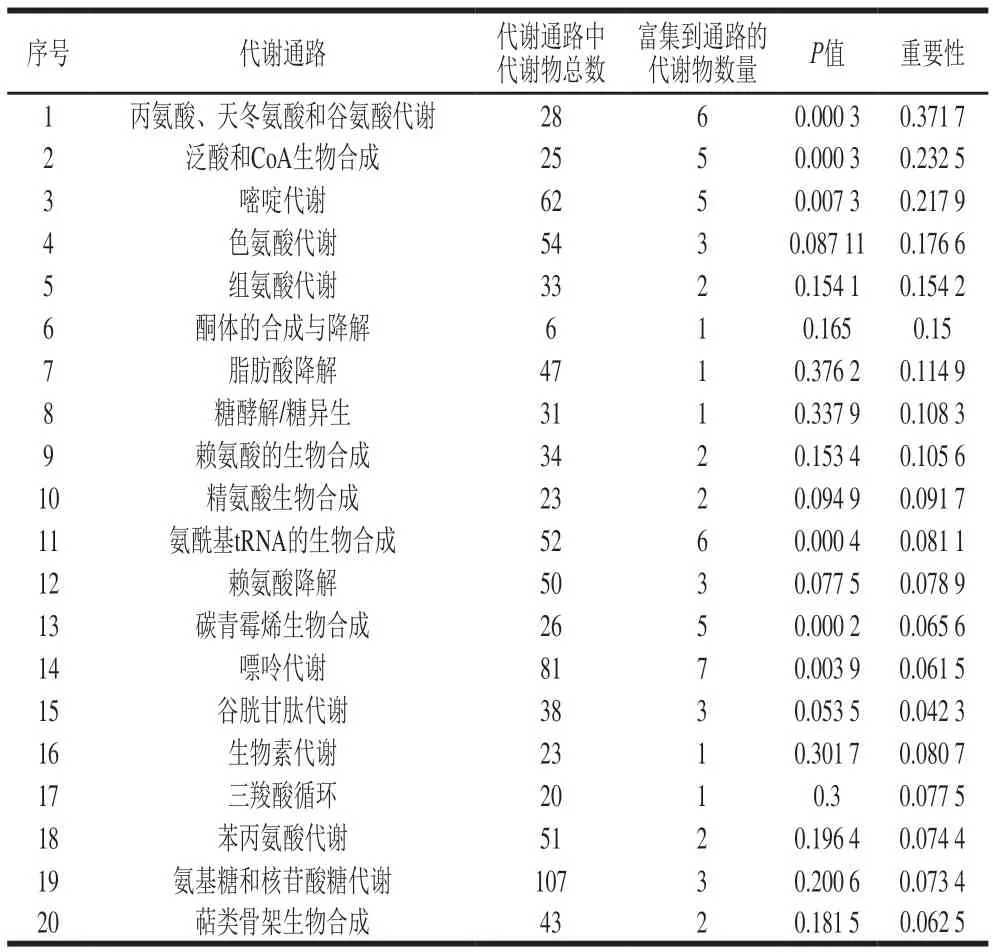
表2 重要性排名前20的代谢通路Table 2 Top 20 most important metabolic pathways
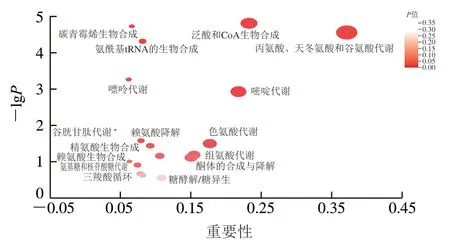
图6 显著差异代谢物代谢通路分析Fig. 6 Metabolic pathway analysis of significantly differential metabolites
2.9 甲酸胁迫下酵母代谢物差异的分析
通过基于液相色谱-质谱的代谢组学方法,在处理组与对照组间共检测出226种差异代谢物,其中123种差异代谢物上调,113种差异代谢物下调,通过代谢通路分析发现差异表达的代谢物主要与氨基酸代谢和核苷酸代谢相关。
氨基酸是许多细胞生物合成和代谢过程中的主要代谢产物,在细胞中通常作为前体物质参与细胞的构建,还可以通过形成催化酶调节细胞代谢。如图7A和图8所示,涉及氨基酸代谢的差异代谢物中,与对照组相比,处理组中氧化型谷胱甘肽、半胱氨酰甘氨酸、柠檬酸、L-谷氨酸、L-组氨酸、L-异亮氨酸、黄嘌呤酸、2,3-吡啶二羧酸、奎宁酸、5-氨基乙酰丙酸、D-4′-磷酸泛酸、D-甘油-2-磷酸酯等显著下调,而吲哚乙醛、5-羟基吲哚乙酸、L-谷氨酰胺、L-色氨酸、L-苯丙氨酸、N-乙酰天门冬氨酸等则显著上调。

图7 甲酸处理后酵母细胞内显著差异代谢物含量聚类图Fig. 7 Cluster analysis of significantly differential metabolite contents in yeast cells after formic acid treatment

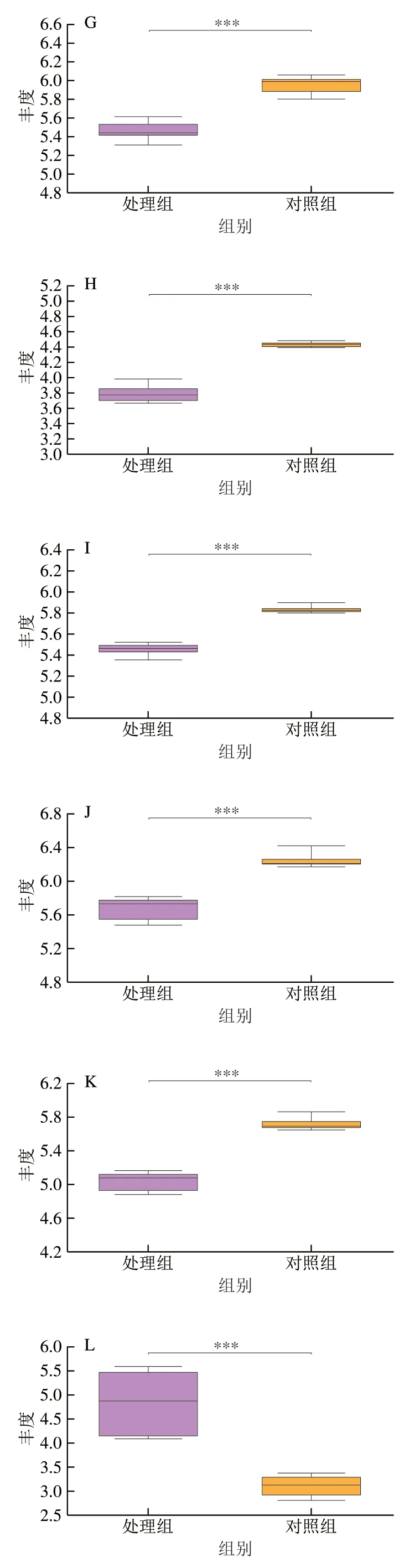

图8 甲酸处理后酵母细胞内显著差异代谢物含量箱形图Fig. 8 Box plot of significantly differential metabolite contents in yeast cells after formic acid treatment
代谢组分析表明,在甲酸胁迫下酵母细胞内氧化型谷胱甘肽、半胱氨酰甘氨酸、L-谷氨酸以及柠檬酸的水平明显降低。有研究表明,谷胱甘肽能够还原活性氧自由基,生成氧化型谷胱甘肽以发挥抗氧化功能,调节细胞内的氧化还原状态,并作为对抗活性氧的保护 剂[23-24]。此外,L-谷氨酸和半胱氨酸也能作为活性氧清除剂对抗氧化应激[25-26]。有研究报道,半胱氨酸的添加可以促进谷胱甘肽的合成[27-28],甘氨酸也直接参与谷胱甘肽的合成[29]。本研究中,在甲酸影响下,处理组氧化型谷胱甘肽和半胱氨酰甘氨酸含量较对照组显著下降,推测甲酸胁迫导致酵母细胞内活性氧积累,扰乱细胞氧化还原平衡,产生氧化应激反应,酵母细胞为维持细胞正常生长大量消耗谷胱甘肽,以抵御活性氧,从而避免细胞受到损伤。Jozefczuk等[30]研究发现,高温、低温等环境胁迫会导致碳中心代谢相关物质含量的下降,这是细胞在抵抗胁迫下为降低能量消耗所采取的自我保护。而本研究中,在甲酸影响下,三羧酸循环中间产物柠檬酸的含量较对照组明显降低,这也是酵母细胞采取保存能量的措施实现自我保护。此外,参与丙氨酸、天冬氨酸和谷氨酸代谢的中间体L-谷氨酸水平在甲酸胁迫下显著下调,这可能是由于三羧酸循环的抑制间接导致L-谷氨酸的减少。在谷氨酸脱氢酶作用下三羧酸循环中的α-酮戊二酸可转化为谷氨酸,同时还可以使L-谷氨酸脱氨生成α-酮戊二酸,并生成还原型辅酶II和ATP。因此,推测酵母细胞可能通过L-谷氨酸分解代谢提供能量和还原力抵抗甲酸诱导的氧化应激,从而导致L-谷氨酸的含量降低。在氨酰基tRNA的生物合成途径中,用于tRNA连接的L-氨基酸含量普遍下降。氨酰基tRNA合成途径在蛋白质合成中具有至关重要的作用,可能与细胞生长代谢调节密切相关。Weber等[31]研究发现在环境胁迫条件下,为降低能量损耗实现自我保护,与细胞生长、分裂以及蛋白合成相关的基因受到抑制。Dong Yachen等[32]也发现,酿酒酵母在醋酸胁迫下其与氨基酸生物合成相关的代谢物水平均明显下调,从而保护细胞免受醋酸损伤。由此猜测,甲酸胁迫可引起酵母细胞内营养物质氨基酸匮乏,使得氨酰基tRNA生物合成底物不足,蛋白质生物合成受阻,细胞生长受到抑制,而酵母细胞通过下调氨基酸代谢通路降低能量需求,维持碳氮代谢平衡,使其在逆境中得以存活。
此外,氨基酸的积累有利于细胞抵抗低温、高温和氧化胁迫[29]。代谢组分析表明,甲酸胁迫下酵母细胞中色氨酸代谢通路发生显著改变,通路中吲哚乙醛、5-羟基吲哚乙酸、L-色氨酸代谢产物全部呈上调趋势,而黄嘌呤酸、2,3-吡啶二甲酸含量呈下调趋势,表明色氨酸代谢通路在甲酸胁迫过程中发挥重要作用。此外,处理组芳香族氨基酸L-苯丙氨酸水平较对照组也显著上调。有研究表明,在色氨酸生物合成途径突变体中,通过向培养基中添加高水平色氨酸,或者过表达Tat2p高亲和力的色氨酸通透酶来抑制这种弱酸超敏性[33]。Ding Mingzhu等[34]研究表明氨基酸的积累能提高细胞的耐受性主要是因为氨基酸能稳定细胞膜结构。此外,还可能是由于甲酸胁迫导致酵母细胞内不正常的蛋白质合成增加,细胞需要自我调节以增加对这些不正常蛋白质的降解[35]。有研究表明,芳香族氨基酸可以通过形成疏水区域保护蛋白质免受胆汁胁迫[36],游离芳香族氨基酸(色氨酸和苯丙氨酸)可能通过减少汞诱导的活性氧产生促进植物对汞胁迫的反应[37]。因此推测,甲酸胁迫也可能通过积累活性氧诱导氧化应激,芳香族氨基酸通过形成疏水区域并减少活性氧的产生协助抵抗甲酸胁迫,从而提高甲酸的耐受性,但是具体机制尚待进一步探索。
核苷酸是细胞生长和繁殖所必需的基本物质,它不仅可以作为DNA和RNA合成的前体,而且在代谢中也扮演着重要角色,可作为生理、生化过程的调节物质参与体内物质代谢[38]。核苷酸代谢与氨基酸代谢有着密切的联系,共有代谢物有5′-磷酸核糖焦磷酸、5-氨基咪唑-4-甲酰胺核苷酸、四氢叶酸等,甲酸影响氨基酸代谢,必然也会影响细胞内核苷酸代谢。代谢组分析表明,在甲酸胁迫下酵母细胞内嘌呤代谢和嘧啶代谢相关的代谢物受到严重抑制,其含量普遍较对照组显著降低。如图7B和图8所示,鸟苷、肌苷、腺苷琥珀酸酯、腺苷琥珀酸、黄嘌呤、尿嘧啶、尿苷、胞苷-5′-磷酸、DTMP等水平显著下调,而谷氨酰胺和5′-磷酸核糖基-N-甲酰甘氨酰胺水平显著上调。
嘌呤和嘧啶是细胞内核苷酸代谢的重要组成部分,同时核苷酸的合成大多数都需要耗能,如嘌呤代谢的从头合成途径中合成1 分子次黄嘌呤核苷酸需要消耗5 分子ATP和6个高能磷酸键,合成AMP或GMP又需要消耗1 分子ATP。鸟苷、肌苷、腺苷琥珀酸酯、腺苷琥珀酸、黄嘌呤水平较对照组显著下调,表明这些物质参与嘌呤代谢的补救途径;参与嘧啶代谢的尿嘧啶、尿苷、胞苷-5′-磷酸、DTMP水平也有所下调,这些代谢物的合成过程也需要消耗能量,而甲酸的存在造成胞内ATP生成受损及消耗增加,可见酵母细胞选择减少核苷酸代谢的生物合成,降低能量消耗来提高对甲酸的耐受性。此外,参与核苷酸合成途径的相关代谢物水平普遍下调,也可能是由于甲酸抑制了酵母细胞DNA的生物合成,进而影响了细胞的正常生长。
添加甲酸后酵母细胞内L-谷氨酰胺和5′-磷酸核糖基-N-甲酰甘氨酰胺含量急剧增加。已有研究报道,L-谷氨酰胺在氮的分解代谢和合成代谢过程中扮演重要角色,同时它也是细胞内氮的主要来源[39-40]。另外,谷氨酰胺也是其他氨基酸和核苷酸生物合成的前体物质[41]。因此推测,酵母细胞可能会通过合成更多的前体物质保护细胞免受甲酸胁迫。5′-磷酸核糖基-N-甲酰甘氨酰是一种非常弱的碱性化合物,主要以磷酸核糖甲酰基甘氨酰胺合酶的底物,作为嘌呤核苷酸从头合成过程中的中间产物,由甘氨酸参入5′-磷酸核糖胺而形成,在嘌呤代谢以及谷氨酰胺向谷氨酸的转化中具有重要作用。这两种物质在酵母细胞内积累可能也有助于提高细胞耐受性,但是具体机理还需要后期进一步验证。
3 结 论
通过基于液相色谱-质谱联用的非靶向代谢组学技术研究酿酒酵母响应甲酸胁迫的代谢机制。研究结果表明,氨基酸,尤其是L-色氨酸、L-苯丙氨酸、谷氨酰胺、5-羟基吲哚乙酸、吲哚乙醛,以及核苷酸等代谢物在甲酸胁迫过程中发生显著改变,可能在酿酒酵母应对甲酸胁迫过程中起关键作用。甲酸胁迫可能导致酵母细胞内活性氧过度积累,诱导氧化应激,扰乱酵母细胞的能量代谢和氧化还原平衡状态,导致酵母细胞内ATP合成受损及消耗增加,同时致使细胞内氨基酸匮乏,氨酰基tRNA生物合成的底物不足,进一步抑制蛋白质的生物合成,影响细胞正常生长,使其存活率下降。胞内芳香族氨基酸水平的上调以及部分氨基酸和核苷酸的合成代谢减慢可以降低能量的消耗,实现自我保护,从而有助于提高酵母细胞对甲酸的耐受性。本研究初步揭示了酿酒酵母响应甲酸胁迫的分子机制,后期将进一步验证差异代谢物在甲酸胁迫过程中的作用。
