LncRNA FGD5-AS1通过miR-873-5p/GTPBP4轴促进肝细胞癌发展的研究
2022-03-05章诺贝黄神安
章诺贝,黄神安,沈 浩,陈 新
肝细胞癌(hepatocellular carcinoma,HCC)是世界上与癌症相关死亡的主要疾病之一。根据2018年《全球癌症统计》,全球已诊断出约841 000例新的肝癌病例,并且全球已有782 000人死于肝癌[1]。目前,肝癌外科手术治疗仅在这种疾病的初期有效。然而,大多数患者的肝癌在诊断明确时已发展到晚期,放疗和化疗疗效有限。因此,有必要进一步了解肝癌进展的分子机制,并研发出针对肝癌更有效的靶向疗法[2]。
近年来,越来越多的证据[3]表明LncRNAs作为癌症患者诊断和预后的生物学标志物,为癌症治疗提供了新的治疗靶点。有研究[4]表明LncRNA的异常表达在肝癌的发生和转移中起着至关重要的作用,如MALAT1与肿瘤转移有关,并可预测肝移植术后的复发[5]。此外,LncRNA-LET可抑制肝癌的侵袭和腹腔转移[6]。FGD5反义RNA 1(FGD5 antisense RNA 1,FGD5-AS1)是一位于染色体3p25.1的新近被确认的LncRNA。最近,LncRNA FGD5-AS1初步被确定为肝癌的潜在治疗靶标[7];然而,LncRNA FGD5-AS1在肝癌发生发展中的调控作用仍不得而知。
1 材料与方法
1.1 临床样本从在南昌大学第二附属医院接受手术的60例肝癌患者中,获得肿瘤组织和邻近配对正常组织。收集所有组织样本并在液氮中冷冻,然后在-80 ℃下保存以备后用。
1.2 细胞培养从中科院上海细胞库购买了4种肝癌细胞系,分别为HepG2、HuH-7、Li-7、SNU-387,以及正常人肝细胞系L02。将细胞系放在补充有10%胎牛血清(Invitrogen,美国加利福尼亚州卡尔斯巴德公司)的RPMI 1640培养基(Invitrogen,美国加利福尼亚州卡尔斯巴德公司)中,并在37 ℃、5%CO2的条件下培养。
1.3 细胞转染分别用由上海GenePharma公司合成的FGD5-AS1过表达载体、FGD5-AS1shRNA(sh-FGD5-AS1)、NC shRNA(sh-NC)和GTPBP4 shRNA(sh-GTPBP4)、NC mimic、miR-873-5p mimic对HepG2和HuH-7细胞系进行转染。sh-FGD5-AS1:5′-GAA CTCAGCGTTGACTATTCT-3′;sh-GTPBP4: GGATGTGCACAGTGATCAAGA;si-NC: 5′-TTCTCCGAACGTGTCACGT-3′。根据制造商说明使用Lipofectamine 2000(Invitrogen,美国加利福尼亚州卡尔斯巴德公司)进行转染。采用RT-qPCR和绿色荧光显微镜评估转染效率。
1.4 CCK-8和EdU分析通过CCK-8和EdU测定法检测细胞增殖。根据制造商说明(上海Beyotime公司),采用CCK-8分析,并在450 nm处测量吸光度(optical density,OD)值。同时按照制造商说明,使用EdU Apollo DNA体外试剂盒(广州RIBOBIO公司),通过EdU分析确定细胞增殖,并在荧光显微镜下观察细胞。
1.5 细胞划痕实验肝癌细胞种植到12孔板中,培养达到70%左右的融合度。接下来,利用一个50 μl小管的管尖部分造成划痕。通过1×PBS除去没有附壁的细胞。再次将细胞放入含有10% FBS的DMEM中分别培养0、48、72 h。每孔随机选择3个观察范围。
1.6 Transwell 实验上室涂有基质胶,用于侵袭分析或未涂覆基质胶进行迁移分析。上室每孔有1 000个/孔浓度的细胞以及无血清培养基,底部腔室为含有10%FBS的DMEM。48 h后,通过使用4%甲醇固定细胞,然后用0.1%结晶紫(美国Sigma-Aldrich公司)染色。在5个不同的视野(放大100倍)中,分别对迁移和侵袭的细胞进行计数。
1.7 双荧光素酶报告实验使用GTPBP4野生型(wt)或突变型(mut)启动子报告子与FGD5-AS1或miR-873-5p进行重组后转染HepG2和HuH-7细胞系。转染48 h后,使用双荧光素酶报告检测系统(美国威斯康星州Promega公司)检测荧光素酶活性。
1.8 RNA下拉实验将PierceTM磁性RNA-蛋白质下拉试剂盒(美国Thermo Fisher Scientific公司)用于RNA下拉实验。首先将RNA结合到磁珠上,以接收用于蛋白质结合的RNA。此后,在添加蛋白质裂解物之前,RNA结合珠在蛋白质-RNA结合缓冲液中被平衡。通过添加适当的缓冲液洗涤珠子,在磁力架上涡旋后分离。最后,通过RT-qPCR分析测定沉淀物中RNA的特异性。
1.9 RT-qPCR使用TRIzol试剂(美国Invitrogen公司)从组织样品和细胞中提取总RNA。根据制造商协议,使用PrimeScriptTMRT试剂盒(日本Takara公司)将RNA反转录为第一链cDNA。通过FastStart Universal SYBR Green Master(德国Roche公司)对PCR定量扩增产物,并标准化为GAPDH和U6。引物:FGD5-AS1,(F)5′-GTCACTGTTCGGTG GTCTGC-3′,(R)5′-CAGTCAGGTGTTGTCGTGGAG-3′;miR-873-5p,(F)5′-GCAGGAACTTGTGAGTCTCC-3′,(R)5′-CTTGAACACTCAGAGGAAGG-3′; GTPBP4,(F)5′-GTTGCTAAAGATTATGTGCGACTG-3′,(R)5′-CAAACGGGATAAATGCTGACG-3′;GAPDH,(F)5′-TATGATGATATCAAGAGGGTAGT-3′,(R)5′-TGTA TCCAAACTCATTGTCATAC-3′。
1.10 Western blot检测使用含有蛋白酶和磷酸酶抑制剂的RIPA缓冲液(美国Sigma-Aldrich公司)提取总蛋白。根据制造商说明,使用BCA蛋白分析试剂盒(上海)测定蛋白质浓度。通过SDS-PAGE分离蛋白质,并将其转移至PVDF膜(美国Millipore公司),然后与一抗在4 ℃孵育过夜,其后与HRP偶联的二抗(1 ∶5 000稀释)孵育。用ECL Western blot检测试剂(美国Millipore公司)对蛋白质进行可视化。免疫反应带使用Image J(美国NIH公司)进行定量。
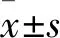
2 结果
2.1 FGD5-AS1在肝癌组织和细胞中表达情况首先通过RT-qPCR检测FGD5-AS1在肿瘤组织和相应癌旁非癌组织中的表达。与癌旁正常肝组织相比,HCC组织中FGD5-AS1的RNA表达水平增加(图1A);与正常肝细胞L02相比,4种HCC细胞系(HepG2、HuH-7、Li-7和SNU-387)中FGD5-AS1的RNA表达水平也均有升高(图1B)。RT-qPCR分析FGD5-AS1在HepG2和HuH-7细胞中的亚细胞定位,结果表明FGD5-AS1主要位于细胞质中(图1C)。
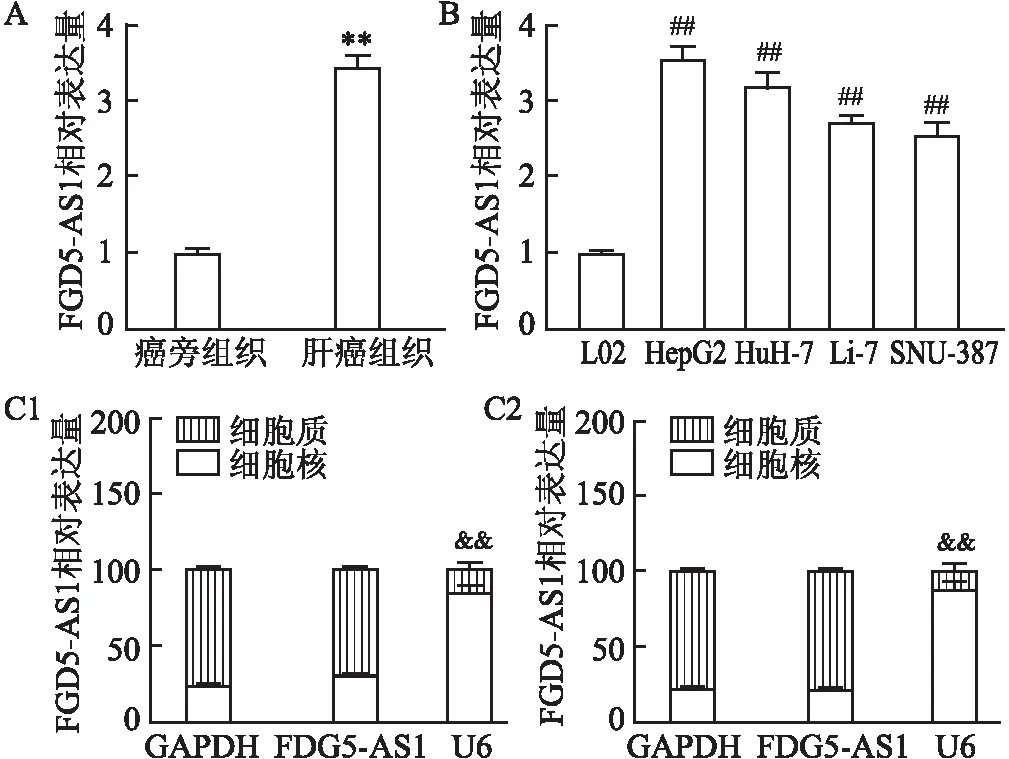
图1 FGD5-AS1在HCC组织和细胞中的表达
2.2 下调FGD5-AS1对HCC细胞增殖及凋亡的影响用sh-FGD5-AS1转染后,FGD5-AS1在HepG2细胞系中的表达水平降低了70%,在HuH-7细胞系中的表达水平降低了65%(图2A、B)。CCK-8和EdU检测表明,下调FGD5-AS1可抑制HepG2和HuH-7细胞系的增殖能力(图2C、D)。Western blot实验表明,下调FGD5-AS1可使增殖相关标志物PCNA和CyclinD1表达蛋白水平降低(图2E)。流式细胞仪检测FGD5-AS1对细胞凋亡,FGD5-AS1的下调使膜联蛋白V(Annexin V)阳性细胞的百分比在HepG2细胞中从8%增至24%,在HuH-7细胞中从7%增至20%(图2F)。为了进一步证实FGD5-AS1对肝癌细胞凋亡的影响,采用Western blot检测了4种凋亡标志物(Bax、Bcl-2、cleaved caspase-3和cleaved caspase-9)的蛋白水平。如图2G所示,在HepG2和HuH-7细胞系中,FGD5-AS1的表达沉默降低了Bcl-2的表达水平,而同时增加了Bax、cleaved caspase-3(abcam、ab2302)和cleaved caspase-9 (abcam、ab2324)的表达水平。
2.3 FGD5-AS1下调对HCC细胞的迁移和侵袭的影响细胞划痕和Transwell实验表明下调FGD5-AS1可以抑制HCC细胞迁移和侵袭(图3A~C)。 在分子水平上检测迁移/侵袭相关的蛋白Cox-2、MMP2和MMP9的表达水平变化,结果表明sh-FGD5-AS1组Cox-2、MMP2和MMP9的蛋白表达水平低于sh-NC组(图3D)。以上实验结果显示,下调FGD5-AS1可抑制HCC细胞的迁移和侵袭。
2.4 FGD5-AS1在HCC细胞中靶向miR-873-5p情况通过搜索在线生物信息学数据库来预测miR-873-5p是FGD5-AS1的潜在下游靶标(图4A)。使用miR-873-5p mimic实现miR-873-5p过表达,并且通过RT-qPCR分析验证了转染效率(图4B)。基因分析表明,将miR-873-5p mimic转染到HCC细胞中可抑制带有miR-873-5p结合位点的FGD5-AS1序列的萤光素酶报告基因的活性。在FGD5-AS1中的miR-873-5p的预测结合位点发生突变后,荧光素酶活性的变化被消除(图4C)。此外,RNA下拉试验进一步证实FGD5-AS1确实与HCC细胞中的miR-873-5p结合(图4D)。此外, RT-qPCR分析显示,HepG2和HuH-7细胞中的FGD5-AS1沉默后,miR-873-5p的表达水平升高(图4E)。与非肿瘤组织和正常人肝细胞系L02相比,在肿瘤组织和HCC细胞系中,miR-873-5p表达水平显著降低(图4F、4G)。Pearson的相关性分析表明,miR-873-5p与FGD5-AS1呈负相关(图4H)。这些数据为FGD5-AS1可海绵化miR-873-5p提供了证据。
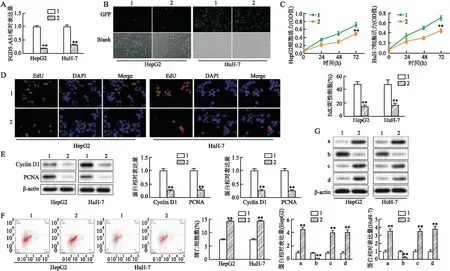
图2 下调FGD5-AS1对HCC细胞增殖及凋亡的影响
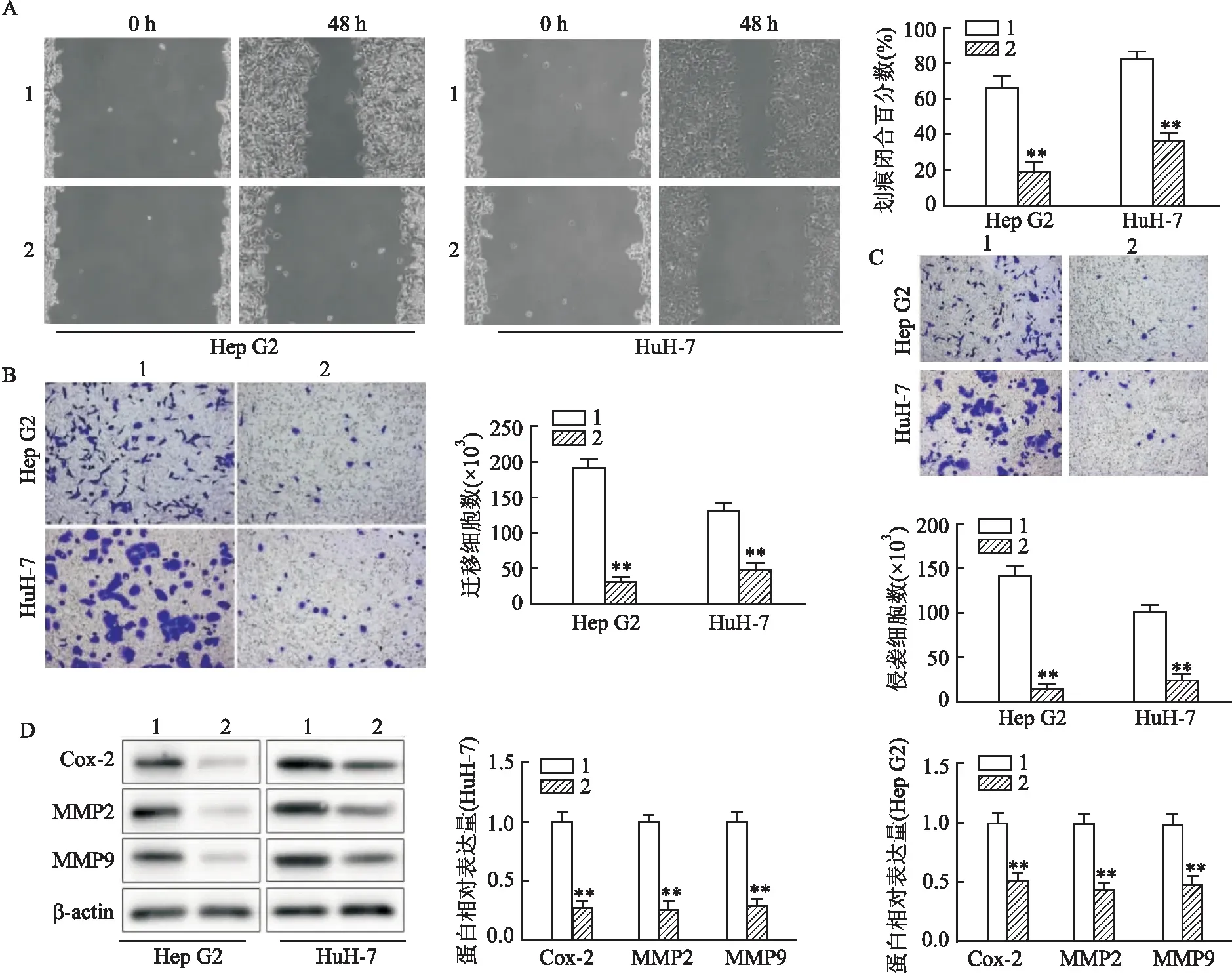
图3 下调FGD5-AS1对HCC细胞的迁移和侵袭的影响
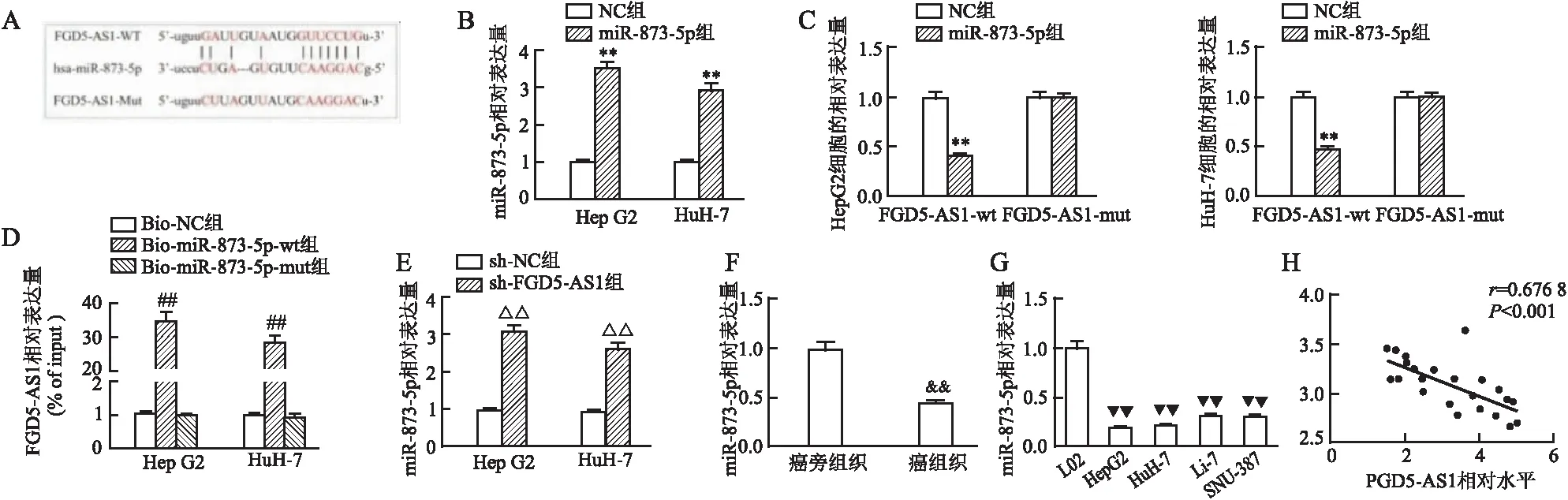
图4 FGD5-AS1在HCC细胞中靶向miR-873-5p情况
2.5 FGD5-AS1通过与miR-873-5p竞争性结合对GTPBP4的影响使用Starbase v2.0(http://starbase.sysu.edu.cn/)分析表明GTPBP4是miR-873-5p的下游靶基因,存在潜在的结合序列(图5A)。双荧光素酶报告实验表明,miR-873-5p可抑制野生型GTPBP4-WT的荧光素酶活性(图5B)。RNA下拉实验同样表明,GTPBP4仅被Bio-miR-873-5p-wt下拉,进一步验证了GTPBP4与miR-873-5p的相互作用(图5C)。通过RT-qPCR和Western blot分析表明:miR-873-5p过表达可导致GTPBP4 mRNA和蛋白质水平明显下降,证实了GTPBP4是miR-873-5p的靶标(图5D、E);miR-873-5p对GTPBP4荧光素酶活性的抑制作用可被GTPBP4的过表达所部分抵消(图5F);FGD5-AS1的表达下调可降低GTPBP4的mRNA和蛋白表达水平(图5G、H)。
2.6 FGD5-AS1/miR-873-5p/GTPBP4轴在HCC中的作用为了进一步研究FGD5-AS1/miR-873-5p/GTPBP4轴对HCC的影响,课题组首先通过RT-qPCR证实了HepG2细胞系的转染效率(图6A)。CCK-8和EdU实验显示miR-873-5p抑制剂可使FGD5-AS1沉默引起的HepG2细胞增殖减少的效应增强,而此效应又可由GTPBP4的敲低所阻遏(图6B、C)。流式细胞术分析细胞凋亡显示miR-873-5p抑制剂可消除FGD5-AS1下调对细胞凋亡的影响,且当GTPBP4沉默后,细胞凋亡得以恢复(图6D)。细胞划痕和Transwell实验分析表明,miR-873-5p抑制剂可增强FGD5-AS1下调对细胞的迁移和侵袭的抑制效应,而此效应又可通过抑制GTPBP4表达来恢复(图6E、F、G)。上述结果表明FGD5-AS1可通过miR-873-5p/GTPBP4轴影响HCC细胞的生物学行为。
3 讨论
本研究表明lncRNA FGD5-AS1在HCC组织和细胞中高表达,lncRNA FGD5-AS1竞争性地抑制miR-873-5p的表达,从而增强了HCC细胞中GTPBP4的表达水平。以上研究结果提示,lncRNA FGD5-AS1在促进HCC进程中发挥了推进作用,其可能作为HCC的一种新的治疗靶标。
lncRNA FGD5-AS1已被确定为包括肝癌在内的多种癌症的潜在致癌基因[8-12]。本研究显示,lncRNA FGD5-AS1在HCC组织中的表达明显高于相应的非肿瘤组织,lncRNA FGD5-AS1的表达下调可抑制HCC细胞的恶性表型,包括增殖、迁移和侵袭,结果表明lncRNA FGD5-AS1在HCC的发展中发挥着至关重要的促进作用。

图5 FGD5-AS1与miR-873-5p竞争性结合对GTPBP4的影响

图6 FGD5-AS1/miR-873-5p/GTPBP4轴在HCC中的作用
该研究表明lncRNA FGD5-AS1主要在HCC细胞质中表达,生物信息学分析显示miR-873-5p具有与lncRNA FGD5-AS1互补的序列。根据先前的研究报道,miR-873-5p在多种癌症中均具有抑癌作用[13]。因此,可推测lncRNA FGD5-AS1可通过与miR-873-5p相互作用从而发挥其致癌作用。本研究结果表明,lncRNA FGD5-AS1可负性调控miR-873-5p。此外,生物信息学分析表明,GTPBP4可能是miR-873-5p的下游靶标。在最近的研究中,GTPBP4已被报道可促进包括HCC在内的多种癌症的进展[14-15]。然而,在HCC中miR-873-5p和GTPBP4的关系尚不清楚。在本研究中,通过荧光素酶报告实验和RNA下拉实验,证实了GTPBP4是miR-873-5p的直接靶标。此外,拯救分析结果表明,lncRNA FGD5-AS1可通过miR-873-5p/GTPBP4轴促进HCC的发展,但是,需要更多的体内实验来进一步证实研究结果。
该研究为lncRNA FGD5-AS1在HCC进展中发挥重要作用提供了理论依据。此外,lncRNA FGD5-AS1/miR-873-5p/GTPBP4轴为肝癌的分子基础研究预示了新视角,并为开发新的HCC诊断和治疗策略提供了新的前景。
