羊毛固醇合成酶抑制剂对KCs细胞分化和凋亡的影响
2022-03-05顾亚男李名聪黄依璇张胜权
刘 莉,顾亚男,李名聪,黄依璇,张胜权
甲羟戊酸途径是存在于所有高等真核生物和很多病毒中的一条代谢途径。羊毛固醇合成酶[1]是甲羟戊酸途径胆固醇(cholesterol,CH)合成支路中的关键中间产物,胶质瘤中的 MI-2是通过破坏CH稳态,抑制CH合成和内源性肝X受体配体的产生来介导的,从而导致CH耗竭和肿瘤细胞调亡[2-3]。
表皮即皮肤的外层,由角质形成细胞(keratinocytes,KCs)组成,该类细胞分化形成一道防护屏障,抵御外界环境伤害。Jans et al[4]表明甲羟戊酸径中羟甲基戊二酸单酰辅酶A还原酶抑制剂(hydroxymethylglutarate monoacyl coenzyme A reductase inhibitor,PRA)、香叶基转移酶抑制剂(geranifolyl transferase inhibitor,GGTI)刺激KCs后,能够抑制Ca2+诱导INV表达[5]。Zhang et al[6]研究指出甲羟戊酸激酶(mevalonic,MVK)的杂合突变可导致播散型浅表性汗孔角化症(disseminated superficial actinic porokeratosis,DSAP),汗孔角化症皮损的特征之一是KCs凋亡[7],但其具体机制尚不清楚。此外,该实验室前期研究[8]指出羊毛固醇合成酶抑制剂(lanosterol synthase inhibitor,RO)通过影响周期蛋白表达从而抑制KCs增殖,但RO对KCs分化和凋亡的影响尚未研究。因此,该研究使用了RO探讨甲羟戊酸途径异常对KCs分化和凋亡的影响并探索其可能的分子机制。
1 材料与方法
1.1 试剂与仪器胎牛血清、 DMEM 、MEPICF 500培养基、0.06 mol/L NaCl 、0.2 mol/L CaCl2、Coating Matrix基质、HKGS(×100)和0.25% 胰酶均购自美国Gibco 公司;Dispase购自美国Sigma公司;RIPA蛋白裂解液、青霉素-链霉素溶液(×100)购自上海碧云天生物公司;细胞凋亡试剂盒购自中国上海贝博生物公司;Involucrin、Loricrin、Bcl-2、Bax 及 β-actin均购自美国Abcam公司;二抗购自北京中杉金桥生物公司。贝克曼流式细胞仪CytoFlex、天能电泳仪、天能化学发光成像仪。
1.2 方法
1.2.1细胞培养 皮肤原代细胞培养见参考文献[8]。
1.2.2细胞凋亡检测 胰酶消化收集KCs细胞,并调整细胞悬液浓度为5×104个/ml,分别接种于12孔板,培养箱贴壁培养过夜,单独加入RO(10 μmol/L)或联合CH(40 μmol/L),作用时间分别为 1、2、3 d,对照组培养液中加入相同浓度的PBS。3 d后胰酶消化再次收集细胞,按照凋亡试剂盒操作指南,用流式细胞仪检测细胞凋亡。检测数据结果用 Flowjo 10.0分析。
1.2.3凋亡相关蛋白检测 将上述处理的KCs细胞用含有蛋白酶抑制剂的蛋白裂解液(RIPA)在冰上裂解细胞提取细胞总蛋白,SDS-PAGE电泳后,移膜封闭,1 ∶1 000稀释Bax 和 Bcl-2,1 ∶10 000 β-actin抗体作为一抗, 4 ℃孵育过夜。TBST漂洗,1 ∶10 000稀释二抗,室温孵育2 h。TBST漂洗擦干,按照化学发光试剂盒操作方法进行发光和成像。
1.2.4分化相关蛋白检测 将RO单独或联合CH与KCs 共培养不同时间加入Ca2+(1.8 mmol/L)处理1d后提取KCs细胞总蛋白,进行SDS-PAGE电泳、转膜和封闭后,放入1 ∶1 000稀释的Involucrin、Loricrin和1 ∶10 000稀释的 β-actin抗体中4 ℃孵育过夜。TBST漂洗,继续孵育二抗(1 ∶10 000),室温孵育2 h。TBST漂洗擦干,按照化学发光试剂盒操作方法进行发光和成像。
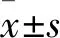
2 结果
2.1 RO诱导KCs细胞凋亡当RO(10.0 μmol/L)单独处理KCs后,细胞凋亡率随着作用时间的增加而增加,第2、3天细胞凋亡率与第0天相比,经方差分析,组间差异有统计学意义(F=152.59,P<0.05);而当RO 联合CH处理 KCs 细胞后,CH部分削弱RO对KCs凋亡诱导作用,在2、3 d细胞凋亡率与RO单独处理 KCs第2、3天细胞凋亡率相比,差异有统计学意义(t1=9.42、t2=10.98,P<0.05)。见图 1。
2.2 细胞凋亡蛋白表达RO单独处理KCs后,随着作用时间的增加,抑制细胞凋亡蛋白 Bcl-2和Bax的表达;当补充CH 处理KCs后,CH能部分减弱RO对Bcl-2的表达抑制作用;Bcl-2/Bax的比值分析表明在单独RO与KCs共培养时,Bcl-2/Bax的比值随着共培养时间的增加而降低,而补充CH后,RO对Bcl-2/Bax 比值降低作用减弱,在处理3 d时有显著性差异,各实验组与对照组相比差异有统计学意义(P<0.05)。见图2。

图1 RO单独或联合CH刺激KCs后对细胞凋亡的影响
2.3 细胞分化蛋白表达Western blot 结果显示RO单独与 KCs 细胞共培养,Ca2+处理1 d后, Ca2+诱导的分化标志蛋白Involucrin和 Loricrin 的表达下降;而补充CH到细胞共培养体系后,RO对Involucrin 及 Loricrin 的表达抑制作用未受到显著影响。见图 3。
3 讨论
甲羟戊酸途径作为细胞生命活动进程的基本途径,对于维持细胞正常的生理功能具有重要意义。皮肤是机体最重要的器官之一,主要由KCs组成的表皮构成,能够防止皮肤水分流失并且阻止体外有害物质损伤皮肤。甲羟戊酸途径在细胞中经过一系列生命活动过程可形成甾醇类,如CH,可进一步转化为胆汁酸、类固醇激素等。代谢产生的中间产物及终产物如法尼基焦磷酸,香叶基香叶基焦磷酸提供戊二烯基,参与细胞某些蛋白的翻译后修饰,对细胞内相关信号转导产生干扰,导致细胞的增殖、分化、基因表达、蛋白糖基化作用以及细胞骨架的形成等细胞生命活动发生变化。分化是细胞生命活动的必不可少的过程,角质形成细胞的分化成熟表现为从基底层向角质层的逐渐移行。有研究[9-10]表明甲羟戊酸代谢途径相关酶的抑制剂 ALD、PRA等可抑制由 Ca2+诱导的 KCs 细胞分化标志蛋白的表达,而 CH 补充能够促进 KCs 细胞分化相关蛋白的表达。在该研究中, RO对KCs细胞Ca2+诱导的分化标志蛋白Involucrin和Loricrin 的表达起抑制作用,而补充CH后对相关分化蛋白的表达抑制并没有补救作用,这提示RO与ALD和PRA抑制皮肤KCs分化的分子机制不同,可能与其下游产物CH的耗尽无关。细胞凋亡对维持机体内环境稳定起重要作用,它涉及一系列基因的激活、表达以及调控等。Bcl-2和Bax是凋亡途径中的两种重要蛋白,Bcl-2/Bax的比值变化影响着细胞凋亡的进程。当其比值下降时,促进细胞凋亡,反之则抑制细胞的凋亡[11]。该研究表明RO 刺激KCs 细胞后可时间性促进 KCs 细胞的凋亡,且细胞内凋亡蛋白 Bcl-2/Bax的比值下降;而补充下游产物 CH 后,可减弱由 RO 造成的细胞凋亡作用,且CH 对Bcl-2/Bax的比值下降有补救作用,该研究结果显示RO可能通过降低Bcl-2/Bax 的比值而诱导 KCs 细胞凋亡。因此, KCs 的分化和凋亡是一个由许多分子调节的复杂过程。该研究的结果部分解释了甲羟戊酸途径功能障碍所致的KCs 分化抑制和凋亡诱导机制。
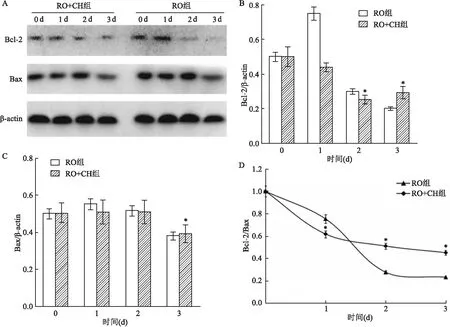
图2 Western blot 分析凋亡蛋白表达
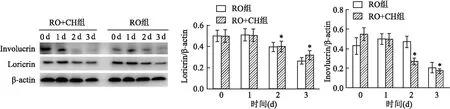
图3 Western blot 分析分化蛋白表达与同时段RO组比较:*P<0.05
