茶树菇多糖提取工艺优化及抗氧化活性研究
2022-03-04高雅倩马诗经杨宜婷
◎ 高雅倩,马诗经,林 丽,杨宜婷
(1.无限极(中国)有限公司,广东 广州 510623;2.广州市康伦生物技术有限公司,广东 广州 510000)
食用菌多糖是一种特殊的生物活性物质,具有增强体液免疫和细胞免疫的功能,国际上将食用菌多糖称为“生物反应调节物”[1]。茶树菇(Agrocybe aegerita)隶属于担子菌纲、伞菌目、粪锈伞科、田蘑属[2],是温带至亚热带地区从春季至秋季生长的一种食用菌[3],中医认为其具有健脾、利尿、止泻渗湿等多种效果。研究表明,茶树菇含有氨基酸、蛋白质、多糖、矿物质等营养成分[4-5]。茶树菇多糖基本结构以β-(1→6)-支链(1→3)-β-D-葡聚糖为主链[6-7],其单糖组成为葡萄糖、半乳糖、阿拉伯糖、甘露糖、鼠李糖和木糖等[8]。研究证实,茶树菇多糖具有抗衰老[9]、抗肿瘤[10]、增强免疫力[11]、抗氧化[12]等生物活性。
茶树菇多糖提取工艺研究包括以茶树菇子实体或粗碎粉为原料,经超声波与微波提取、碱法提、酶法提及热水浸提等工艺制备[13-14],而茶树菇多糖主要存在于茶树菇子实体细胞的细胞壁内,其细胞壁具有蛋白质、多糖结合的结构,因此,上述方法难以破坏细胞壁结构,充分释放出多糖。本研究对茶树菇采用超微粉碎处理后再进行热水浸提,通过单因素与正交试验方法优化分析了茶树菇多糖提取工艺中提取温度、料液比、提取时间、提取次数因素的影响,将最佳工艺所得茶树菇粗多糖通过不同浓度乙醇醇沉法进一步纯化,得到纯化后茶树菇多糖,测定并分析其抗氧化活性,为茶树菇在抗氧化食品方面的研究开发提供理论支持。
1 材料与方法
1.1 材料与试剂
茶树菇干制品,由广州市康伦生物技术有限公司提供;葡萄糖标准品(纯度>99%),购自阿拉丁(Aladdin)试剂公司;无水乙醇、浓硫酸、苯酚等均为分析纯,购自广州化学试剂厂;蒸馏水为实验室自制。
1.2 仪器与设备
酶标仪1510:美国Thermo Fisher公司;紫外可见光分光光度计UV-3600 Plus:SHIMADZU公司;超微粉碎机WZJ-6B:济南倍力粉体工程技术有限公司;电热恒温水浴锅DK-S22:上海精宏实验设备有限公司;离心机Z326K:德国Hermle公司;数控超声波清洗器KQ3200DE:昆山市超声仪器有限公司;高速万能粉碎机DYF-400C:上海利闻科学仪器有限公司。
1.3 实验方法
1.3.1 茶树菇多糖的提取
茶树菇干制品置于60 ℃烘箱干燥20 min后,经高速万能粉碎机粉碎并过100目筛,然后用超微粉碎机进行超微粉碎10 min,得到茶树菇超微粉,备用。
称取茶树菇超微粉按设定液料比加入水,浸泡20 min后,再按实验设计的液料比、提取温度、提取时间、提取次数进行提取;茶树菇提取液经300目过滤后,置于65 ℃减压浓缩至1/10体积,经5 000 r·min-1离心10 min,取上层清液加入4倍体积的95%乙醇进行沉淀后减压抽滤,沉淀物依次用无水乙醇、丙酮洗涤后冷冻干燥,得茶树菇多糖冻干粉,测定多糖得率。
1.3.2 茶树菇多糖含量测定
(1)葡萄糖标准曲线。采用苯酚硫酸法测定[15]。称取适量葡萄糖标准品,置于105 ℃烘箱中烘至恒重;称取100 mg葡萄糖标准品,在100 mL容量瓶中用蒸馏水定容至刻度,摇匀备用。精密吸取葡萄糖标准储备液0 mL、0.2 mL、0.4 mL、0.6 mL、0.8 mL和1.0 mL置10 mL容量瓶,加蒸馏水定容,配制成含 葡 萄 糖 0 mg·mL-1、0.02 mg·mL-1、0.04 mg·mL-1、0.06 mg·mL-1、0.08 mg·mL-1和 0.10 mg·mL-1的系列葡萄糖标准溶液。分别移取上述系列葡萄糖标准溶液各1 mL,置10 mL具塞玻璃试管中,依次加入0.5 mL 5%苯酚溶液,2.5 mL浓硫酸摇匀,静置5 min,于90 ℃水浴加热20 min,然后冰浴冷却至室温,另取1 mL蒸馏水,按照上述操作,作为空白对照。将上述溶液分别在490 nm波长处测定吸光度值,以葡萄糖标准溶液浓度为横坐标,以吸光度为纵坐标绘制标准曲线。
(2)茶树菇多糖含量与得率测定。茶树菇多糖得率测定。将茶树菇多糖溶于水中,并稀释至一定质量浓度,吸取1 mL于具塞试管中,测定吸光度,由标准曲线计算出粗多糖的质量分数,计算公式如下:
式中:X-茶树菇多糖提取率,%;C-测得茶树菇多糖的浓度,mg·mL-1;V-提取液的体积,mL;n-稀释倍数;0.9-葡萄糖换算成多糖的正交系数;M-原料质量,g。
1.3.3 茶树菇多糖提取单因素试验
以茶树菇多糖得率为指标,研究不同提取液料比、提取温度、提取时间、提取次数因素对茶树菇多糖提取效果的影响。①确定时间2 h、提取温度为100 ℃条件下,提取1次,探讨提取液料比(mL∶g)为10∶ 1、20∶ 1、30∶1、40∶1和 50∶1对茶树菇多糖提取率的影响。②确定提取液料比为30∶1、提取时间为2 h,提取1次条件下,探讨不同提取温度(70 ℃、80 ℃、90 ℃和100 ℃)对茶树菇多糖提取率的影响。③确定提取温度100 ℃,提取液料比为30∶1,提取1次条件下,探讨不同提取时间(1 h、2 h、3 h、4 h和5 h)对茶树菇多糖提取率的影响。④确定提取温度100 ℃,提取液料比为30∶1,提取2 h条件下,探讨不同提取次数(1次、2次、3次和4次)对茶树菇多糖提取率的影响。
1.3.4 正交试验
为了进一步确定最佳提取条件,在单因素试验结果基础上,以茶树菇多糖得率为指标,选取液料比A、提取温度B、提取时间C3个因素进行L9(33)正交试验对提取条件进一步优化,因素与水平见表1。
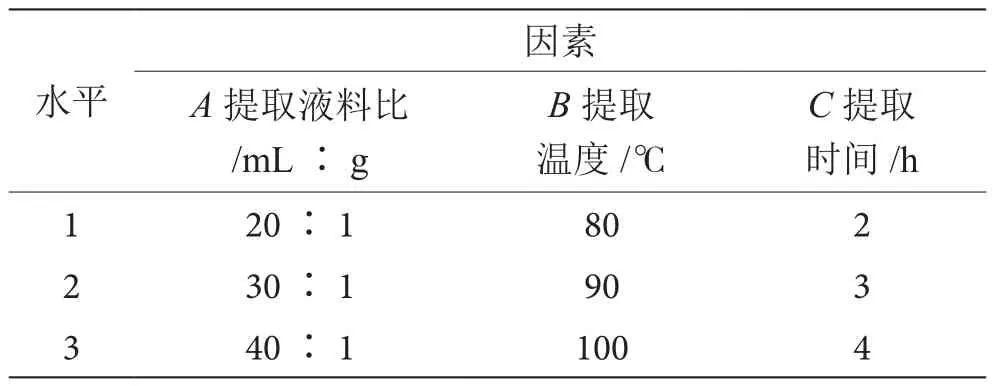
表1 正交试验因素水平表
1.3.5 茶树菇多糖醇沉处理试验
采用不同浓度乙醇醇沉获得茶树菇多糖,取最佳工艺所得茶树菇提取液,在65 ℃浓缩至提取液体积的1/10,浓缩液中加入4倍量体积的乙醇,使得溶液中乙醇终浓度为70%、80%,放置过夜后,于5 000 r·min-1离心10 min,去上清液得沉淀,冷冻干燥得茶树菇多糖,记为C1、C2,进行体外抗氧化活性测试。
1.3.6 茶树菇多糖体外抗氧化实验
参照文献方法[16],测定1.3.5项下的茶树菇多糖C1、C2的DPPH自由基清除能力。取1 mL不同浓度(0.01 mg·mL-1、0.05 mg·mL-1、0.10 mg·mL-1、0.20 mg·mL-1、0.40 mg·mL-1和 0.80 mg·mL-1)的 C1、C2溶液于试管中,分别加入1.0 mL 0.1 mmol·L-1DPPH溶液,充分混匀后避光反应20 min,在517 nm处测定吸光度为Ai;对照组以无水乙醇代替DPPH,测定吸光度Aj;空白组以蒸馏水代替多糖溶液,测定吸光度为A0。DPPH自由基清除率=[A0-Ai+Aj]/A0×100%。
2 结果与分析
2.1 葡萄糖标准曲线
以葡萄糖标准液浓度(mg·mL-1)为横坐标,吸光度(A)为纵坐标,绘制葡萄糖标准曲线见图1,得到回归方程y=8.875 7x-0.000 3,R2=0.999 6,表明葡萄糖标准品在0.00~0.10 mg·mL-1内浓度与吸光度值呈良好的线性关系。
2.2 茶树菇多糖提取工艺优化试验结果
超微粉碎茶树菇得到茶树菇超微粉,并采用单因素与正交试验优化茶树菇多糖的提取工艺,茶树菇多糖提取实验结果如图2~图5所示。
2.2.1 液料比对提取率的影响
由图2可知,在茶树菇超微粉热水浸提过程中,随着液料比的增加,茶树菇多糖的得率明显提高,表示较高的液料比增加了茶树菇多糖在水中的溶出,液料比为40∶1时,茶树菇多糖得率最高,液料比为50∶1的茶树菇多糖得率与液料比为30∶1相比,并非显著性增加,说明在此条件下,茶树菇提取液料比为(20~40)∶1最为适宜。
2.2.2 提取温度对提取率的影响
由图3可知,而随着提取温度增加,多糖得率显著增加,提取温度为100 ℃时,茶树菇多糖得率最高,表示温度升高提高了茶树菇超微粉中多糖的溶出速度。
2.2.3 提取时间对提取率的影响
由图4可知,在提取时间由1 h提高至2 h时,多糖得率显著增加,在提取3 h时多糖得率达到最大值,随着提取时间增加,多糖得率呈下降趋势,表示延长提取时间,促使茶树菇中非多糖的水溶性成分溶出,所以多糖得率降低。
2.2.4 提取次数对提取率的影响
由图5可知,进一步地增加提取次数,茶树菇多糖提取得率并非显著升高,提取1次与2次多糖得率相差很小,提取2次及以上时,多糖得率没有明显增加,说明在设定条件下提取1次时,茶树菇多糖已基本溶出完全。由上述结果可知,提取液料比、提取温度及时间对茶树菇多糖提取影响较大,需要进一步优化提取条件。
为对比茶树菇超微粉碎后的提取增益效果,取高速粉碎后的茶树菇碎粉按提取温度100 ℃、液料比为30∶1、提取3 h条件下,提取1次时(离心、浓缩及醇沉工艺一致),茶树菇多糖得率为6.36%±0.26%,明显低于茶树菇超微粉的多糖得率。由此可见,茶树菇经超微粉碎后,其细胞壁破碎,有利于多糖溶出而提高多糖得率。
2.2.5 提取工艺优化
通过表2和表3分析结果可知,影响因素主次顺序为B(提取温度)>A(液料比)>C(提取时间)。试验指标值越大越好,由K值大小得出茶树菇多糖的最佳提取条件为A2B3C2,即提取温度100 ℃,液料比为30∶1,提取时间3 h,提取1次;由方差分析得出,提取温度显著影响茶树菇多糖提取工艺(P<0.05),提取液料比和提取时间无显著影响。按最佳工艺条件提取茶树菇多糖,平行3次,结果显示茶树菇多糖的平均得率为11.96%±1.06%,高于正交试验中的最大值。

表2 提取工艺条件优化正交试验结果与分析表

表3 正交试验方差分析结果表
2.3 茶树菇多糖抗氧化实验结果
不同醇沉浓度获得茶树菇多糖的抗氧化结果见图6。结果显示,茶树菇多糖C1、C2对DPPH自由基的清除率呈现出浓度依赖性,C1、C2在质量浓度为0.01~0.80 mg·mL-1对DPPH自由基清除率范围分别为3.12%~36.77%、4.31%~46.88%。从以上结果分析,不同乙醇浓度醇沉所得的茶树菇多糖其抗氧化功效也有所差别,浓度越高效果较好。
3 结论
本研究用超微粉碎预处理热水浸提法从茶树菇中提取茶树菇多糖,结果表明,各因素影响茶树菇多糖提取率的主次顺序为:提取温度>液料比>提取时间,经正交试验方法得其最优化工艺条件为提取温度100 ℃,液料比为30∶1,提取时间3 h,提取1次。在最佳工艺条件下,茶树菇多糖平均得率为11.96%±1.06%,茶树菇多糖得率高于常规粉碎处理后热水浸提工艺,说明该工艺方法可有效提高茶树菇多糖得率。此外,不同乙醇浓度醇沉所得茶树菇多糖对DPPH自由基的清除率呈现良好的量效关系,以乙醇浓度高所得茶树菇多糖抗氧化效果更好。
