群体感应介导的溶藻行为对蓝藻水华控制的研究
2022-03-04李祎聂荷张惠科牛文芳李姗姗
李祎,聂荷,张惠科,牛文芳,李姗姗
(河南师范大学 生命科学学院,河南 新乡 453007)
近年来,由于人类活动的影响和自然条件的改变,水体接纳过量氮、磷等营养物质导致众多水体呈富营养化状态,加速了蓝藻水华的暴发[1].蓝藻水华目前已经成为全球普遍存在的环境问题,水华防治已迫在眉睫[2].研究表明,微生物在水华生消过程中起重要作用,部分细菌能够抑制藻类生长,利用细菌代谢产物多样、生物安全性高和作用高效等优势,开展以菌控藻研究,成为防治水华的重要手段[3-4].细菌群体生长过程中某些特定基因的表达与种群密度有关,这种现象被称为群体感应(quorum sensing,QS).群体感应系统是细菌之间进行交流的一种机制,它可以调节细胞内相关基因的表达,以此来调控其生理功能,例如生物发光现象、细胞毒力基因的表达、胞外多糖的合成、生物膜的形成以及DNA的交换和溶藻物质的分泌等[5-8].部分溶藻细菌通过群体感应调控其溶藻物质的分泌,从而造成蓝藻细胞的死亡.群体感应在细菌溶藻过程中发挥重要作用,而其在蓝藻水华防控治理中的研究还不够深入,本文通过对溶藻菌群体感应系统、蓝藻自身的群体感应及菌藻关系研究现状的综合分析,探讨溶藻细菌群体感应在蓝藻水华治理中的作用,为蓝藻水华的防控提供参考.
1 蓝藻水华的危害与溶藻细菌
蓝藻水华的暴发使水体中溶解氧含量下降,造成鱼、虾等生物的死亡,水体生物多样性降低,生态系统遭到破坏[9].水华暴发过程中覆盖于水体表面的大量藻类以及死去的动物尸体等,破坏了原有的生态景观,严重影响了养殖业和旅游业的发展[10].一些蓝藻释放的次级代谢产物具有毒性,如作用于肝脏的微囊藻毒素和作用于神经系统的鱼腥藻毒素等严重威胁了人体健康[11].目前,关于蓝藻水华的治理方法主要有物理法、化学法和生物法(表1),从生态环保的角度出发,生物法除藻是水华防治较为理想的方法,而其中的微生物控藻具有广阔的前景.目前已报道的可用于控藻的微生物主要有真菌、病毒、细菌等.自CANTER首次证实了真菌能够杀死藻细胞以来[12],一些真菌分泌的具有溶藻作用的活性物质如青霉素[13]、头孢菌素[14]等也陆续被分离鉴定出来.SAFFERMAN和 MORRIS首次分离并纯化到了能够杀死蓝藻的病毒[15],病毒具有繁殖快、传染性强的优点,但是由于其易突变和易受周围环境影响的特点,目前利用病毒治理蓝藻水华还需要深入研究.相较于真菌与病毒,细菌对于蓝藻水华的抑制具有优势,在暴发蓝藻水华的水体中存在有大量的溶藻细菌,这类细菌可以通过直接或间接的方式抑制藻类生长或杀灭藻类并溶解藻细胞.溶藻细菌的溶藻方式分为直接溶藻和间接溶藻.

表1 蓝藻水华治理措施优缺点对比
直接溶藻的细菌与藻细胞直接接触,从而使藻细胞裂解死亡或侵入藻细胞内部使藻细胞裂解死亡.SHILO研究表明粘细菌能够直接与蓝藻细胞接触进而溶解蓝藻营养细胞[16].CAIOLA等[17]研究发现类蛭弧菌细菌能够造成蓝藻细胞的裂解.这类细菌侵入宿主细胞后主要停留在宿主细胞壁和细胞膜之间,随后细胞膜部分增厚.随着细胞结构的破坏,蓝藻细胞开始溶解,细胞壁的许多部位出现断裂,最终蓝藻细胞完全溶解.表明细菌对铜绿微囊藻的溶解可能是导致蓝藻水华消亡的原因之一.
大部分的溶藻细菌都是通过分泌具有溶藻活性的胞外溶藻物质使藻细胞裂解从而间接溶藻.LIU等[18]研究发现菌株Sp34主要通过释放含有热量和酸性物质的化合物杀死铜绿微囊藻.LI等[19]发现微小杆菌h10通过分泌糖脂类物质造成铜绿微囊藻的死亡,在其溶藻作用下藻细胞叶绿素a合成能力受到抑制,且细胞结构和形态造成破坏,最终藻细胞溶解死亡.LUO等[20]报道链霉菌(Streptomycessp.)L74通过分泌胞外溶藻物质对铜绿微囊藻的生长有抑制作用,并且确定溶藻物质是2-羟基-12-油酸-3,28-O-D-吡喃葡萄糖基.LI等[21]从太湖分离到一株芽孢杆菌(Bacillussp.)Lzh-5通过分泌六氢吡咯[1,2-a]吡嗪-1,4-二酮和3-异丙基-六氢吡咯[1,2-a]吡嗪-1,4-二酮对铜绿微囊藻有溶藻效果.
由于大多数的溶藻细菌都是通过分泌溶藻物质实现水华的控制,这些溶藻物质的分泌通常由细菌的群体行为所调控.细菌群体行为是细菌之间的一种信息交流机制,通常称为群体感应,因此探究群体感应与溶藻物质分泌的关系有助于了解溶藻物质的分泌机制,为蓝藻水华的治理提供支撑.
2 细菌群体感应系统与溶藻细菌群体感应
2.1 细菌群体感应系统
目前研究已经发现的细菌QS系统主要包括:(1)由革兰氏阴性菌利用不同长度酰基侧键的高丝氨酸内酯类(AHLs)所介导的AI-1型QS系统;(2)由呋喃硼酸二酯类(autoinducer-2,AI-2)介导的AI-2型QS系统;(3)由革兰氏阳性菌利用寡肽(autoinducingpeptides,AIP)所介导的AI-3型QS系统[22].除此之外,还有由羟基-棕榈酸甲酯(PAME)、假单胞菌喹诺酮类信号分子(PQS)、来源于金黄色葡萄球菌的自诱导肽I(AIP-1)、扩散信号因子(DSF)等介导的QS系统[23].
2.1.1AI-1型QS系统
AI-1型QS系统又被称为 LuxR/I 型信息系统,该系统由AHLs分子介导,首先发现于费氏弧菌的生物发光现象[5].革兰氏阴性菌的群体感应系统包括LuxI和LuxR两个最基本的调控蛋白,其中LuxI是自诱导剂的合成酶,可以产生AHLs的信号分子.AHLs是一类小分子水溶性化合物,可作为QS系统的自诱导剂,当外界AHLs浓度达到一定阈值时,AHLs受体蛋白LuxR与AHLs结合形成的LuxR复合物能够激活并调控某些生物学特性的基因表达[24-25].
2.1.2AI-2型QS系统
通常将利用AI-2进行信息交流的系统称为LuxS/AI-2型群体感应系统, AI-2类信号分子是呋喃硼酸二酯类化合物,该信号分子广泛存在于革兰氏阴性菌和革兰氏阳性菌中.其合成主要依赖于细菌中的保守序列LuxS基因编码的S-核糖同型半胱氨酸酶(S-ribosylhomocysteinase,LuxS)和S-腺苷同型半胱氨酸核苷酶(S-adenosylhomocysteine nucleosidase,Pfs)的作用[26].研究表明AI-2信号分子的受体蛋白主要有哈维氏弧菌中的 LuxP 蛋白以及大肠埃希氏菌和沙门氏菌中的 LsrB 蛋白,其中,LuxP蛋白不是与转运系统直接作用,而是通过调节跨膜传感蛋白LuxQ,使它与AI-2结合[27].
2.1.3AI-3型QS系统
革兰氏阳性菌QS系统主要是用小分子多肽(oligopeptide)作为自诱导物(autoinducter peptide,AIP),AIP分子由体内产生前导肽AgrD蛋白加工,不能自由穿透细胞壁,需通过ABC转运系统(ATP-bind-ing-cassette)或其他膜通道蛋白作用才能到达胞外被AgrCTCSTS识别,从而引起毒性因子的表达[28].
2.2 溶藻细菌群体感应
研究发现在蓝藻水华暴发以及消亡的过程中,溶藻细菌的数量随着藻细胞数量的升高而增多.但是溶藻细菌增长有一个阈值,在细菌数量未达到阈值以前,并不表现出溶藻活性,只有当细菌数量达到阈值后才表现出溶藻作用,这表明在溶藻细菌中存在群体感应现象.这些细菌通过群体感应分泌胞外溶藻物质进行间接溶藻,目前,已发现具有群体感应现象的细菌主要有γ-蛋白细菌、气单胞菌、枯草芽孢杆菌、灵杆菌等.
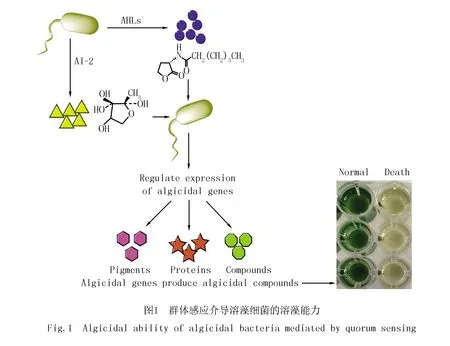
在群体感应参与的溶藻过程中,一般都是由群体感应信号分子AHLs介导的群体感应调控溶藻细菌的溶藻物质分泌.根据所分泌的溶藻物质不同,群体感应调控的溶藻细菌可分为溶藻色素型、溶藻蛋白型及溶藻化合物型(图1).细菌所产天然色素被应用为溶藻物质的重要优势就是细菌色素产量高、成本低且安全性高,有更大的潜力应用于水华防治,并且溶藻色素的产生由细菌的群体感应所调控.NAKASHIMA 等[29]发现从日本长崎沿海地区分离出的γ-蛋白细菌菌株MS-02-063可以通过群体感应系统控制合成红色色素PG-L-1来抑制藻类的活动,即该菌株密度达到一定值时,才可以产生抑藻物质PG-L-1,同时推测群体感应参与其他类型抑藻色素的合成.THOMSON等[30]研究发现Serratiasp.ATCC 39006通过群体感应系统smaIR调控其抑藻色素的生物合成,SmaI可以直接合成群体感应信号分子AHLs.TAO等[31]研究表明灵杆菌通过群体感应系统SmaI/SmaR调控其抑藻物质灵菌红素的合成,即只有当细胞密度增大到一定阈值时,灵杆菌才开始合成灵菌红素.溶藻细菌可以通过分泌胞外蛋白造成藻细胞壁的溶解,从而实现藻细胞的溶解,部分溶藻蛋白的分泌也是由群体感应调控的.ZHANG等[32]对鲍曼不动杆菌(Acinetobacterbaumanni)J1进行全基因组测序分析发现,该菌株包含的编码LuxI类似蛋白的假定基因具有通过AHLs信号分子操纵细胞密度的潜在能力,并且在LuxI的下游发现Chi基因编码的蛋白质有利于菌株溶解藻细胞,因此证明该菌株通过群体感应调控其抑藻效果.文献[33]研究证明溶藻菌株Kordiaalgicida可以通过群体感应系统释放可扩散的活性蛋白酶进而抑制硅藻的生长.溶藻细菌除了可以通过群体感应调控溶藻色素和溶藻蛋白的分泌外,还有其他细菌通过群体感应调控其溶藻化合物的合成.GUO等[34]研究表明从太湖分离出的气单胞菌菌株GLY-2107能够通过AHLs介导的群体感应释放两种热稳定的胞外碱性化合物3-苄基哌嗪-2,5-二酮和3-甲基吲哚进行溶藻.文献[35]发现细胞噬菌体菌株41-DBG-2的菌株密度只有在达到106个细胞/mL阈值之后,才能表现出抑藻活性.WU等[36]研究发现芽孢杆菌(Bacillussp.)S51107通过NprR-NprX 群体感应系统调控高分子量抑藻物质的合成.
在LuxS/AI-2群体感应系统中,信号分子AI-2是由LuxS酶催化合成4,5-二羟基-2,3-戊二酮(DPD)的衍生物,在革兰氏阳性、阴性菌都存在,是可用于细菌种间交流的信息系统.ZHANG等[37]对枯草芽孢杆菌(Bacillussubtilis)JA进行全基因组测序分析发现,该菌株包含的编码LuxS基因的假定基因具有通过AI-2信号分子调控细胞密度的潜在能力,同时在LuxS基因的下游发现多个蛋白酶编码基因,该基因编码的蛋白质有利于藻细胞的溶解,因此表明该菌株的抑藻效果也受群体感应调控.
3 蓝藻水华自身的群体感应
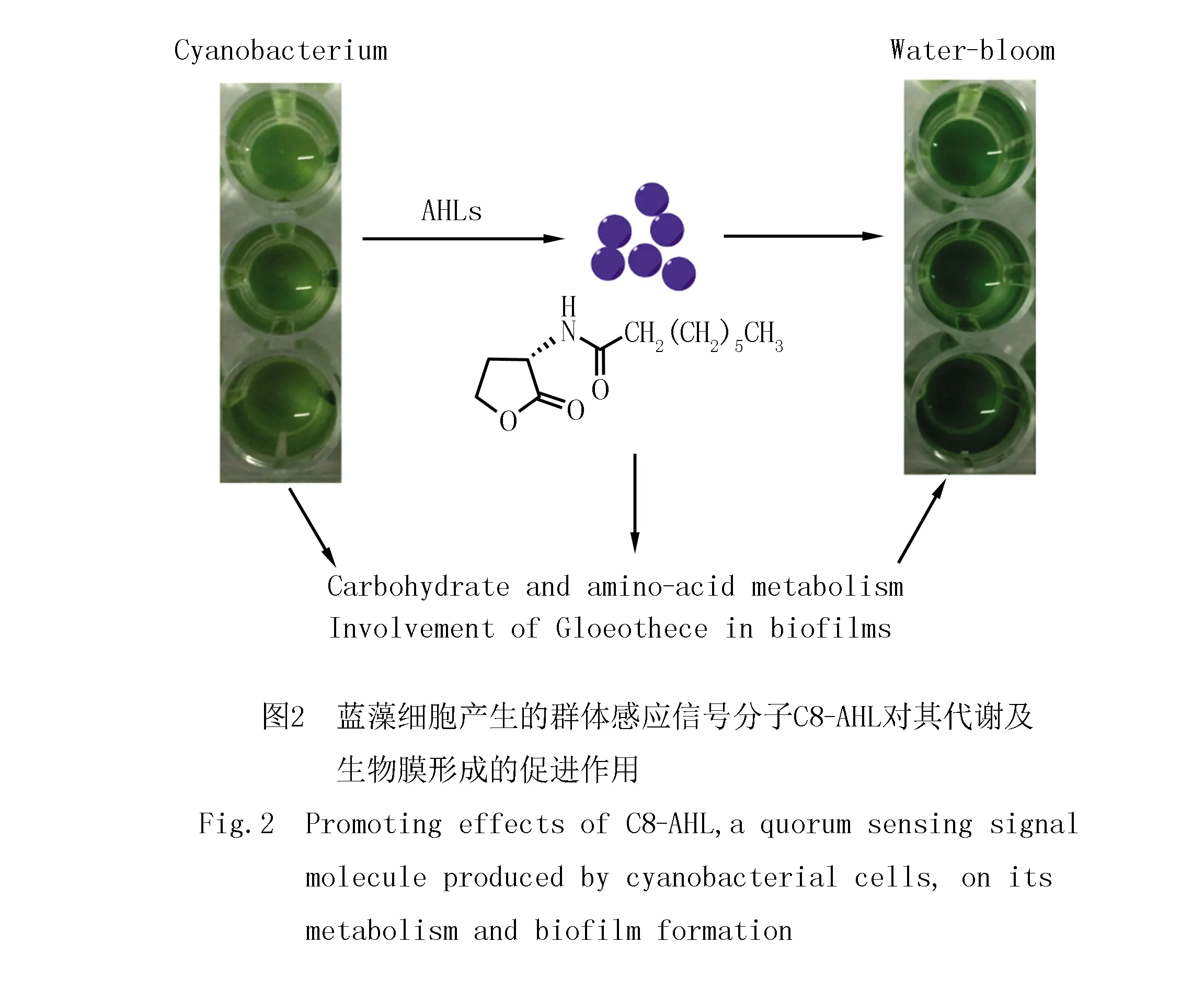
蓝藻群体形成的关键是蓝藻胞外多糖的合成,与群体感应存在一定的联系.蓝藻水华的优势种类微囊藻会产生胞外多糖形成胶被,促使单细胞藻类形成群体,在细胞密度达到阈值后上浮形成水华.这表明水华暴发具有跟其他细菌类似的群体感应调控机制,而蓝藻又称为蓝细菌,属于革兰氏阴性菌,此类群体感应信号分子为高丝氨酸内酯类(AHLs)物质[38].BRAUN等[39]对水华暴发水体中蓝藻的藻毒素和AHLs含量进行测定,发现所有的水华中均出现藻毒素,同时大部分的水体中检测到AHLs,表明蓝藻中存在AHLs,但是AHLs与藻毒素之间的直接关联并没有被证实.为了探究群体感应与蓝藻水华之间的直接关系,SHARIF等[40]对黏杆藻中的群体感应分子进行检测,发现随着藻细胞密度升高,培养基中C8-AHL的含量增加.经过C8-AHL处理后的藻细胞中有43个蛋白表达上调,这些蛋白与碳水化合物及氨基酸代谢、黏杆藻生物膜合成密切相关,表明C8-AHL的积累还可以促进蓝藻代谢和生物被膜的形成,从而有利于水华的发生(图2).同时ZHAI等[41]研究也发现在铜绿微囊藻7820的无菌代谢物中存在AHLs,并且AHLs的浓度跟藻细胞的密度呈正相关,AHLs在蓝藻水华形成过程中起一定作用.蓝藻细胞通过群体感应调控其生理功能和代谢水平,从而影响其细胞密度,最终对能否形成水华造成一定程度的影响.因此,群体感应对于蓝藻细胞自身的群体形成和维持有重要作用,通过对蓝藻群体感应的调控从而实现蓝藻水华的防控具有一定研究价值.
4 菌藻关系
近年来,研究人员对微生物和藻类如何调节自身行为以适应或维持共生环境进行了许多研究.藻类和细菌之间的复杂关系可能是由群体感应信号分子介导的,它可以影响藻类和细菌的种间关系,实现跨界交流,共同维持共生环境的平衡和稳定[42].在蓝藻-溶藻细菌体系中,两者是相互作用的,一些溶藻细菌通过释放胞外溶藻物质进行间接溶藻,而胞外溶藻物质的释放又依赖于溶藻细菌自身的群体感应,同样藻类也可以通过干扰细菌QS系统抑制溶藻细菌的数量来减少对自身的伤害[43].有研究表明,蓝藻门鱼腥藻属能够合成群体感应淬灭酶,从而抑制群体感应[44],一些蓝藻细菌也具有群体感应抑制剂活性并且含有大量QS淬灭基因[45].林升钦等[46]研究发现聚球藻 BN60 和具有溶藻作用的短波单胞菌 J4 共培养的上清液中存在抑菌类物质可以导致短波单胞菌J4浓度下降,且这些抑菌类物质是聚球藻 BN60 在短波单胞菌 J4 对其表现出溶藻效果时诱导性分泌的.说明蓝藻与溶藻细菌之间不只有单方面溶藻作用,某些蓝藻对于溶藻细菌也具有化学防御作用.
5 展 望
目前,群体感应在农业、环境治理、医学等领域展现出了广阔的应用前景.利用群体感应治理蓝藻水华,将为蓝藻水华的治理提出新方向,从而减少人力投入和化学药品的使用,为发展绿色治理方法提供理论和技术保障.利用群体感应治理蓝藻水华可以从以下两个方面入手:首先,可以通过添加外源AHLs或其结构类似物来调控蓝藻自身的群体感应,从而使蓝藻自身不能形成水华,从根源上解决问题;其次,可以对溶藻细菌的群体感应进行调控,通过提高溶藻菌溶藻基因的表达能力,促进溶藻物质的产生,增强溶藻能力,达到治理蓝藻水华的目的,为有效治理蓝藻水华提供参考.
