沉淀法深度处理高硬高COD焦化废水重金属研究
2022-03-02李兰廷
李 兰 廷
(1. 煤炭科学技术研究院有限公司 煤化工分院,北京 100013;2.煤炭资源高效开采与洁净利用国家重点实验室,北京 100013;3.国家能源煤炭高效利用与节能减排技术装备重点实验室,北京 100013)
0 引 言
工业废水中含有多种有机物、无机盐、重金属等污染物,其中重金属具有高毒性、不会被降解和易在生物体中累积的特点[1-2],会导致其在鱼类及其他水生生物体内富集,并通过饮水和食物链的生物积累、浓缩、放大等作用,对人类和周围的生态环境造成严重的危害。特别是煤化工焦化废水,因其自身高化学需氧量(COD)、高盐等独有的特点,处理的难度更大。许多焦化厂虽然对该废水进行了脱酚、高级氧化、膜技术等梯级净化工艺处理,但其中的金属离子却得到了不断的富集[3]。而后续RO反渗透膜处理工艺中对进水水质要求较高,尤其是铁、锰等重金属离子对反渗透膜的损害较大,因此如何有效除去焦化废水中的铁锰等重金属离子是业界与环保部门关注的重点之一,且越来越受到普遍的重视。
目前国内外对重金属废水的处理方法主要有三大类[4-11],分别是化学法、物理法和生物法。化学法主要是通过与重金属离子的化学反应进行的方法,物理法是指在不改变化学形态的前提下进行吸附、浓缩、分离的方法,生物法是借助微生物絮凝、吸收、积累、富集等作用去除废水中重金属的方法[12]。由于焦化废水中高浓度的无机盐和有机物对微生物具有抑制作用,不适宜采用生物法进行处理[13];化学法和物理法则是最主要的处理方法,其中尤以氢氧化物沉淀法和吸附法最为高效普遍[14]。
基于焦化废水中除了含有重金属离子外还含有较高的COD,而硫化物与重金属生成难溶的金属硫化物沉淀的溶度积比金属氢氧化物沉淀的溶度积要小得多,同时金属硫化物沉淀还可以吸附网捕水中的有机污染物,达到双重的除污效果。所以,用硫化物沉淀比氢氧化物沉淀更有效、渣量少、易脱水、沉渣品位高,同时更有利于重金属和有机物的双重去除,但目前在该方面缺乏较为系统性的研究。
以下研究拟通过使用硫化钠化学沉淀法,考察不同因素对焦化废水中铁锰离子去除效果的影响以获得优化的工艺参数,为深度去除高盐高COD焦化废水中重金属的工艺开发提供实验依据。
1 实 验
1.1 原料与仪器
主要原料为硫化钠、盐酸、氢氧化钠、硝酸锰、硝酸铁、聚丙烯酰胺(PAM)等化学品,均为分析纯;Thermoscientific铁、锰、硬度试剂(赛默飞世尔科技);活性炭(AC)自制,指标见表1;河北某焦化厂焦化废水,指标见表2。
仪器:XY3000-2C电子天平、THZ-D恒温振动器、pH计、堆形瓶、量筒、Thermoscientific分光光度计(Aquamate 8000)、HJ-6B数显恒温多头磁力搅拌器、5B-3A多组分水质分析仪及5B-1消解仪(连华科技)、0.45 μm滤膜、布氏漏斗等。

表1 活性炭主要参数分析Table 1 Analysis of main parameters of activated carbon

表2 焦化废水主要分析指标Table 2 Main analytical parameters of coking wastewater
1.2 实验方法
取一定量的废水水样放入具塞堆形瓶中,用1 mol/LHCl和1 mol/LNaOH溶液调节水样的pH值,放到磁力搅拌器上,按一定比例添加沉淀剂Na2S溶液于废水中。反应一段时间后,水样经0.45 μm滤膜过滤,取滤液进行金属离子测定分析。
1.3 分析方法
滤液中金属离子浓度及硬度在Thermoscientific分光光度计上进行测定,测定时在水样中加入不同的Thermoscientific试剂,反应10 min后测试,根据水样中金属离子浓度及硬度的变化量,计算金属离子及硬度的去除率,计算公式如下:
η=(C0-Ce)/C0×100
(1)
式中,η为去除率,%;C0为初始浓度,mg/L;Ce为平衡浓度,mg/L。
COD的测定按照《水和废水监测分析方法》的方法,先用COD快速密闭消解仪消解,然后用多组分水质分析仪测定水样的吸光度,对照校准曲线得到水样的COD值。
2 结果与讨论
由表2可知,该焦化废水偏碱性,其中硬度和COD含量均较高,而铁、锰离子的含量较低。考虑到该废水在实际处理中经过去除COD等多重的工艺处理后会导致重金属离子的不断浓缩富集和引入,为此将废水中铁离子和锰离子的浓度分别调整到0.2 mg/L和6.0 mg/L。采用沉淀法对该废水进行深度处理,研究结果表明沉淀法更有利于实际应用推广。
2.1 废水酸碱度对重金属去除效果的影响
室温下,取5组废水水样进行试验,按n(Mn+)∶n(Na2S)=1∶2.5分别添加沉淀剂Na2S于水样中(Mn+为铁锰离子摩尔数之和),搅拌速度为120 rpm,60 min后均有棕黑色沉淀出现。实验结果见表3和如图1所示。
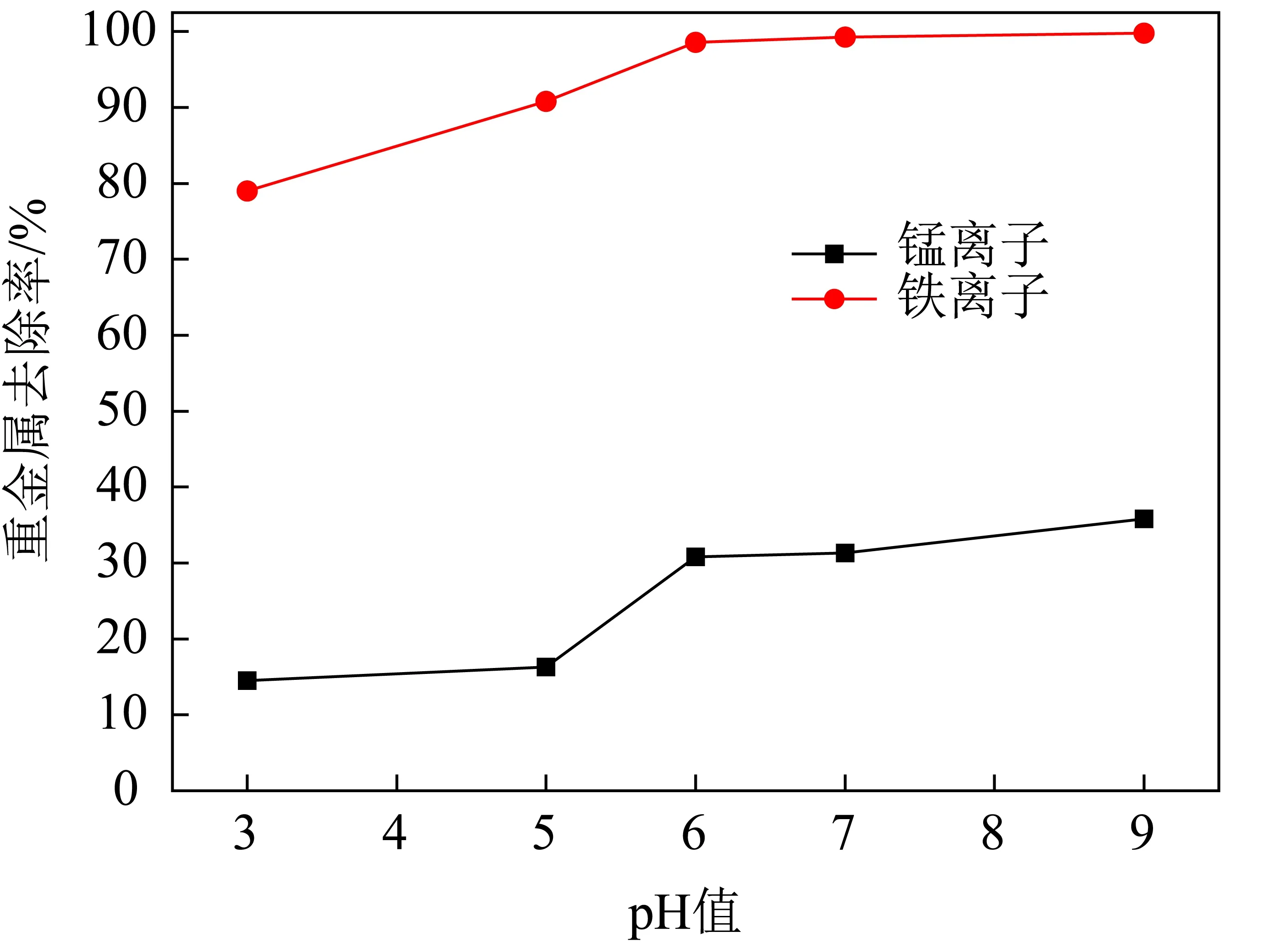
图1 重金属去除率随pH 的变化趋势Fig. 1 Trends in heavy metal removal rates with pH
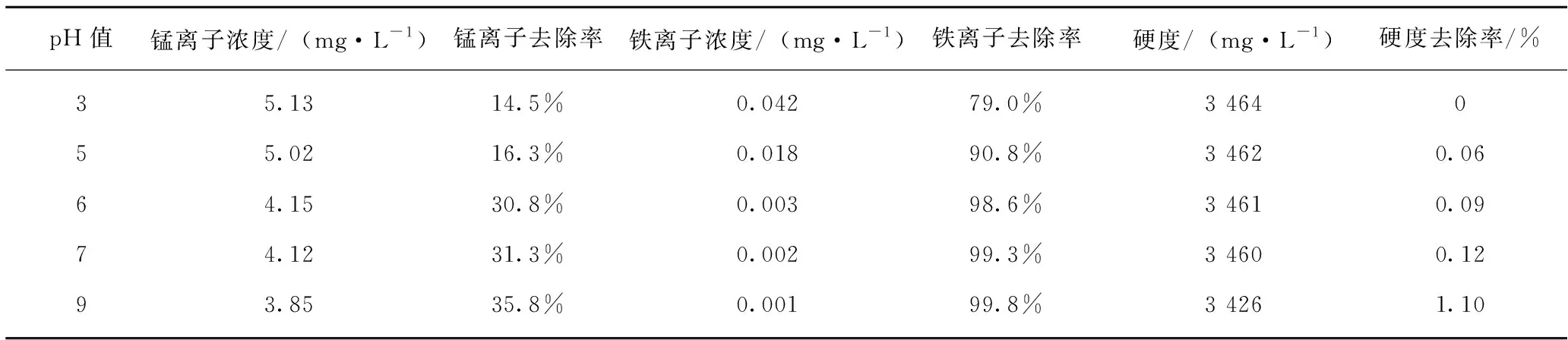
表3 pH值对重金属离子去除的影响Table 3 Effect of pH value on removal of heavy metal ions
由表3和图1可看出,pH对重金属离子的去除率影响较大,且2种重金属离子的去除率随着pH的升高均逐渐增大。其中,铁离子的去除效果较为明显,去除率均在79%以上;而Mn2+的去除率却相对很低,基本在30%左右,尤其在酸性条件下的去除率更低。分析产生该种现象的原因,可能主要包括以下几个方面:当pH低于6时,2种金属离子仅生成了金属硫化物沉淀,硫化钠水解产生的S2-在与重金属离子产生沉淀的同时,常会与水中的H+反应生成H2S气体逸出,不利于与重金属离子生成沉淀,且易造成Na2S的投加量偏大,进而增加处理成本;但当pH高于7时,重金属离子的去除率明显提高,其根源在于金属离子在与硫离子生成金属硫化物沉淀的同时,水中的 OH-与部分铁离子还产生了Fe(OH)3沉淀,所以此时对铁离子的去除较为彻底;而锰离子去除率增高是因为在碱性条件下溶解在水中的氧将部分Mn2+氧化成MnO2的缘故。另外,从表3中还发现焦化废水的硬度去除率在酸性条件下几乎没变,在碱性条件下仅稍有增加,可能是由于硬度离子与氢氧根离子作用的结果。从表3中硬度的去除率随着pH值的升高呈增大趋势来看,可能存在硬度离子的同离子效应导致了重金属离子的去除率减缓,但该种负面影响极其有限。考虑到实际水样的pH值为8.3,若过低地调整pH值会消耗更多的酸,成本也会有所增加,所以从综合角度分析,试验最佳pH值定为8.0较为适宜。
2.2 Na2S加入量对重金属去除效果的影响
室温下取5组废水水样,调整pH值为8.0,分别按n(Mn+)∶n(Na2S)=1∶1.0、1∶1.5、1∶2.0、1∶2.5、1∶3.0添加沉淀剂Na2S进行实验。加入沉淀剂并搅拌,搅拌速度保持在120 rpm,均有棕黑色沉淀出现,搅拌60 min后进行测定,其测试结果见表4及如图2所示。

图2 沉淀剂对重金属去除率的影响Fig. 2 Effect of precipitant on removal rate of heavy metals
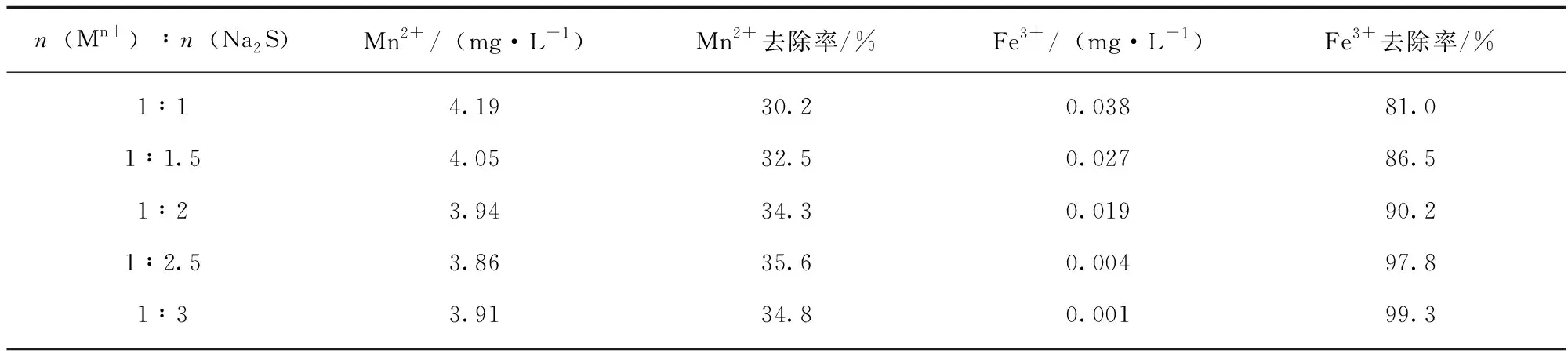
表4 沉淀剂加入量对重金属离子去除的影响Table 4 Effect of the amount of precipitant on removal of heavy metal ions
由表4和图2可看出,Na2S对于铁离子的去除效果明显好于对锰离子的去除效果,铁离子的去除率在n(Mn+)∶n(Na2S)为1∶1时已能达到80%以上,而对Mn2+的去除率仅达到30%。随着添加剂Na2S的增多,重金属离子的去除率均呈增大的趋势,但锰离子的增大趋势也不太明显。导致此现象的主要根源应是MnS的溶度积(2.5×10-13)较大,而FeS的溶度积为6.3×10-18,相对而言要小得多,Fe2S3的溶度积则极小,所以硫化钠对铁离子的沉淀程度较为彻底,而对锰离子的沉淀就不甚彻底,致使水中还含有较高浓度的锰离子,远高于水中铁离子的含量。
另外,废水中的硬度随沉淀剂的变化几乎没有改变,可能是由于硫化钠不能与钙镁离子反应生成沉淀的缘故。所以,沉淀剂的合适添加量应为n(Mn+)∶n(Na2S)=1∶2.5。
2.3 反应时间对重金属去除效果的影响
室温下取5组废水水样,调整pH值为8.0,分别按n(Mn+)∶n(Na2S)=1∶2.5添加沉淀剂Na2S进行实验。沉淀剂加入并搅拌,搅拌速度为120 rpm,搅拌反应时间分别为10 min、20 min、30 min、60 min和90 min,反应后经0.45 μm滤膜过滤,测试结果见表5及如图3所示。
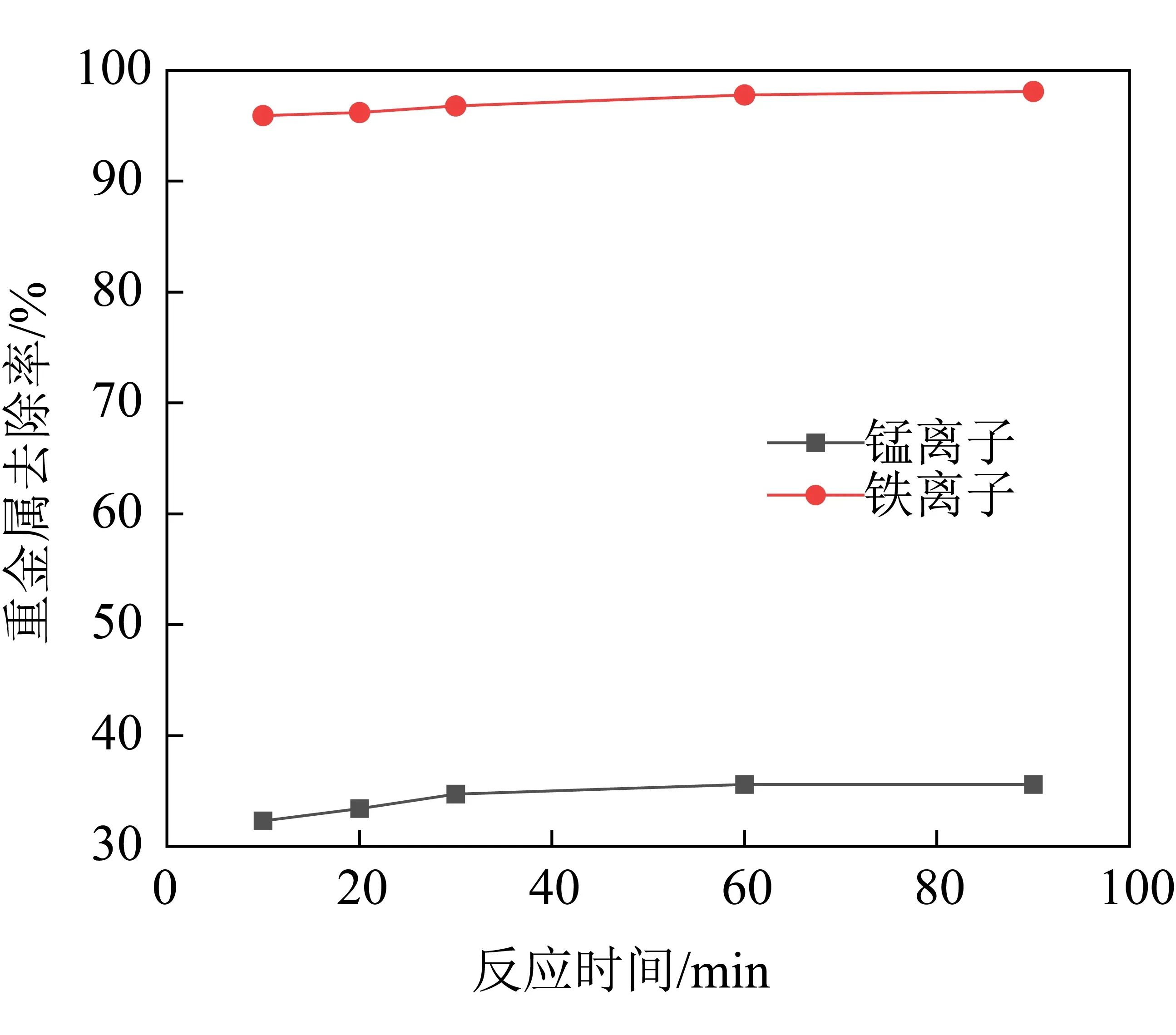
图3 重金属去除率随反应时间的变化趋势Fig. 3 Trends in heavy metal removal rates over reaction time
表5 反应时间对重金属离子去除的影响Table 5 Effect of reaction time on removal of heavy metal ions
由表5和图3可看出,反应时间的长短对金属离子的去除效果不是很明显,随着反应时间的延长,金属离子的去除率变化不大,基本上反应60 min后重金属离子的浓度变化就极其微小。其原因在于,一般来说化学沉淀反应的速度较快,当硫化钠加入到废水中时,迅速地水解成钠离子和硫离子,且硫离子与金属离子快速地发生了化学沉淀反应,并基本上达到反应的动态平衡状态,所以反应时间的过长对金属离子的去除影响并不是太大。
因而将试验适宜的反应时间定为60 min。
2.4 搅拌速度对重金属去除效果的影响
室温下取废水水样,调整pH值至8.0,再按n(Mn+)∶n(Na2S)=1∶2.5添加沉淀剂Na2S进行实验。沉淀剂加入后随即搅拌,调整搅拌速度为80 rpm、120 rpm、150 rpm和200 rpm,反应时间均为60 min。
实验结果见表6和如图4所示。
图4 重金属去除率随搅拌速度的变化趋势Fig.4 Trends of heavy metal removal rate with stirring speed
表6 搅拌速度对重金属离子去除的影响Table 6 Effect of stirring speed on removal of heavy metal ions
由表6和图4可看出,随着搅拌速度的变化,铁离子和锰离子去除率的变化趋势是一致的,即重金属离子的去除率先增大然后减小,出现峰值。分析原因可能是,重金属离子在溶液中并不以简单的离子形态存在,而是经溶剂化、水解和聚合等作用,形成了多核离子水合团簇结构。离子水合团簇与简单离子尺寸有很大差异,水合离子中水分子数目越大,其直径越大。随着搅拌速度的增大,硫离子和重金属离子碰撞的几率增大,由此提高了反应的速率,生成的沉淀颗粒较大,并对水中的COD等有机污染物进行吸附、网捕,从而使得颗粒迅速增大下降。
但若搅拌速度太高,沉淀形成的颗粒则易被打碎,不容易形成较大的沉降颗粒,此与实验中观察到的现象一致,即虽都有棕黑色沉淀生成,但搅拌速度越高的实验中生成的黑色沉淀颗粒较小,由此导致重金属的去除率略为变低。由此可见,较为适宜的搅拌速度为120 rpm。
2.5 助剂对重金属去除效果的影响
通过上述的系列试验发现,单纯的硫化钠沉淀剂虽然对铁离子的去除效果较好,但对锰离子的去除效果却并不理想,满足不了后续工艺对水中锰离子的要求。而聚丙烯酰胺(PAM)分子能与分散于水溶液中的悬浮粒子架桥吸附,有着极强的絮凝作用,是1种常用的絮凝剂[15];活性炭(AC)作为1种广谱吸附剂,具有较大的比表面积、孔隙率和丰富的官能团,对重金属离子也有极强的吸附能力[16-17]。如果将PAM和AC作为助剂使用,也许会起到较好的协同效果。
为此,试验中将10 mg/L的PAM或/和5g/L的AC作为助剂添加到硫化钠沉淀剂中,室温下调整水样pH=8.0,按n(Mn+)∶n(Na2S)=1∶2.5添加沉淀剂Na2S,搅拌速度设定为120 rpm,反应时间为60 min。助剂对重金属离子去除影响的实验结果见表7。

表7 助剂对重金属离子去除的影响Table 7 Effect of pitantion aid on removal of heavy metal ions
由表7可见,单一地采用PAM或AC助剂虽能在一定程度上提高对铁锰离子的去除率,但都不能实现对锰离子的深度去除。而将2种助剂复合添加到沉淀剂中,对铁离子和锰离子的去除率都明显高于添加单一助剂的情况,原因如下:
(1)由于AC的孔结构比较发达(见表1),对金属离子及沉淀剂离子都有较强的吸附与静电作用;
(2)由于AC上较为丰富的羧基(-COOH)以及-OH等含氧官能团具有亲水性,增强了其对重金属离子的络合和离子交换吸附能力,导致金属离子的吸附阻力变小[18];
(3)同时焦化废水中含有较高的芳香族COD(见表2),而有机物与重金属离子易形成络合离子或络合物[19-20]。
为此,AC通过其表面芳香环与废水中的芳香族化合物间的π-π电子供体-受体(EDA)的相互作用也实现了对COD和重金属的双重吸附[21]。而PAM则通过对包含AC的颗粒进行吸附、架桥、网捕等作用,不断形成可沉降的颗粒,最终实现对废水中重金属离子、有机污染物等多组分的协同去除综合效果。
3 结 论
煤化工高盐废水中重金属难以有效脱除,致使后续分质分盐工艺中得到的杂盐为危废,严重制约煤化工废水的资源化回用。以焦化废水为研究对象,采用化学沉淀法深度去除焦化废水中重金属离子的实验研究,考察硫化钠沉淀剂在各种条件下对铁锰离子的去除效果,即考察影响去除率的主要因素,结果如下:
(1)当含有重金属的焦化废水呈现弱碱(pH=8.0)的情况下,沉淀剂硫化钠与重金属离子的比例为1∶2.5,搅拌速度为120 rpm、反应60 min时,可达到最佳的重金属去除效果,铁的去除率为97.8%,锰的去除率为35.6%,铁离子的去除效果好于锰离子的去除效果。
(2)影响重金属沉淀效果的主要因素为沉淀剂加入量、沉淀助剂和pH值,水中硬度对重金属的去除影响较小,而水中COD等有机物的存在有利于沉淀颗粒的聚大沉降,从而提高重金属的去除率。
(3)通过添加助剂可有效地实现硫化钠化学沉淀法对铁锰重金属离子的深度去除,铁锰离子的去除率均可达到99%以上,满足了废水后续治理工艺对铁锰离子含量均不高于0.05 mg/L的要求。
