臭氧催化剂对煤化工高盐废水有机物去除性能研究
2022-03-02王吉坤
王 吉 坤
(1.煤炭科学技术研究院有限公司 煤化工分院,北京 100013;2.煤炭资源高效开采与洁净利用国家重点实验室,北京 100013;3.国家能源煤炭高效利用与节能减排技术装备重点实验室,北京 100013)
0 引 言
煤化工生产过程产生大量高浓盐水[1-3],其中总溶解固体(TDS)含量达到10 g/L以上,COD一般在300 mg/L~500 mg/L或更高,可生化性差,COD的组成多为难降解复杂有机物,诸如多环芳烃、杂环化合物等,该类有机物难以被普通的生化法处理,同时由于TDS含量高,导致膜浓缩、蒸发结晶无法正常运行,造成结晶盐须按危废处置,显著增加废水处理成本及环境污染风险,严重制约煤化工产业绿色可持续发展,是亟待解决的问题。现有技术[4]难以有效处理高盐环境下有机物及重金属,是煤化工废水资源化利用的技术瓶颈,对项目所在地生态环境造成了严重的威胁。
近年对煤化工高浓盐水难降解有机物的去除引起广泛关注。难降解有机物去除的方式众多,包括混凝沉淀法、活性炭吸附法、生物法、铁炭微电解法、高级氧化法等。其中混凝沉淀法主要针对废水中细小悬浮颗粒和胶体微粒,对分子量<1 k Dalton的有机物去除效果有限[5];活性炭吸附法虽对有机物去除率高,但活性炭吸附容量有限,吸附饱和后再生困难,耗量大,运行费用高[6];生物法[7-11]处理高盐废水有机物过程中,废水的高盐度抑制微生物的生长,导致较低的COD去除率,且由于所含有机物基本上很难生物降解,更增加了生物法处理的难度;铁炭微电解法[12]存在处理规模较小且受电解范围等制约,不宜处理大规模废水的问题。相比而言,高级氧化法[13-14]是利用强氧化性的羟基自由基(·OH)氧化分解水中难降解有机物的方法,羟基自由基的氧化性能仅次于F2,可快速、无选择性、彻底氧化各种有机与无机污染物。
高级氧化法包括传统Fenton氧化[15]、光催化氧化[16]、电化学氧化[17]、臭氧催化氧化[18-19]等技术,其中传统Fenton氧化技术存在H2O2耗量大、铁泥产生量大等缺点;电催化氧化法存在能耗高,电极寿命低,并且该过程产生有毒副产物;光催化氧化虽对有机物的降解效率更高,同时能耗降低50%左右,但该技术尚未进行工业化应用,究其原因需开发出适宜工业化应用的新型光催化剂(如可见光催化剂)以及解决粉体催化剂的回收问题。相对上述3种技术,臭氧催化氧化采用非均相催化剂催化臭氧产生·OH,彻底矿化水中难降解有机物,且具有臭氧利用效率高,催化效果好,无二次污染的优点。Pi等[20]采用臭氧催化氧化剂深度降解草酸溶液,对比纯臭氧氧化,总有机碳去除率提高了30%;陈炜彧[21]采用铁基催化剂深度降解煤化工废水,其中催化剂投加量、pH及臭氧投加量等因素对COD去除率影响显著;Rosal等[22]采用臭氧催化氧化剂深度降解非诺贝酸溶液,·OH产生速率是纯臭氧氧化的8倍。综上所述臭氧催化氧化技术在煤化工高盐废水处理上具有广泛的应用前景。
笔者对煤化工高盐废水中难降解有机物进行臭氧催化氧化实验研究,考察催化剂制备工艺,载体及活性组分类型对COD去除率的影响,确定催化剂制备工艺及催化剂;采用宁夏某煤化工高盐废水,开展工艺条件优化实验,确定最佳工艺参数并开展催化剂稳定性能评价,最后对臭氧催化氧化的反应动力学进行探讨,以期为煤化工高盐废水臭氧催化氧化体系的建立及完善提供一定的指导。
1 实验材料和方法
1.1 主要仪器及试剂
试剂:COD专用试剂、硫酸(分析纯)、硝酸铁(分析纯)、硝酸锰(分析纯)、硝酸铈(分析纯)。
仪器:pH计、COD测定仪、GC-MS仪、分析天平。
活性氧化铝为白色球状,粒径3 mm ~5 mm,堆积密度(0.723 ~0.83) g/cm3,比表面积262 m2/g。
1.2 实验水样
1.2.1基本水质分析
水样选自宁夏某煤化工高盐废水,对废水的分析结果见表1。废水TDS为7 050 mg/L,氯离子为3 500 mg/L,属于高盐废水且无机盐含量高,COD为460 mg/L,即水中难降解有机物较多,有必要采用臭氧催化氧化技术高效去除。

表1 废水水质指标Table 1 Wastewater quality index
1.2.2煤化工高盐废水中有机物分析
对煤化工废水中有机物分析方法如下:将100 mL二氯甲烷与100 mL废水置于分液漏斗中震荡15 min后,收集萃取相,随后采用自动进样针将萃取相打入GC/MS,分析有机物组成。色谱条件:毛细管柱DB25(30 m×0.25 mm×0.25 μm),气体总流量为50 mL/min,气化室温度为270 ℃,MS离子源温度为300 ℃,进样口温度为270 ℃,GC/MS接口温度为270 ℃。
对废水中有机物定性分析结果如图1所示。由图1可知,有机物主要为含氮有机化合物,其中含量最多的是吡咯烷、吡啶、吲哚、酰胺、腈等。
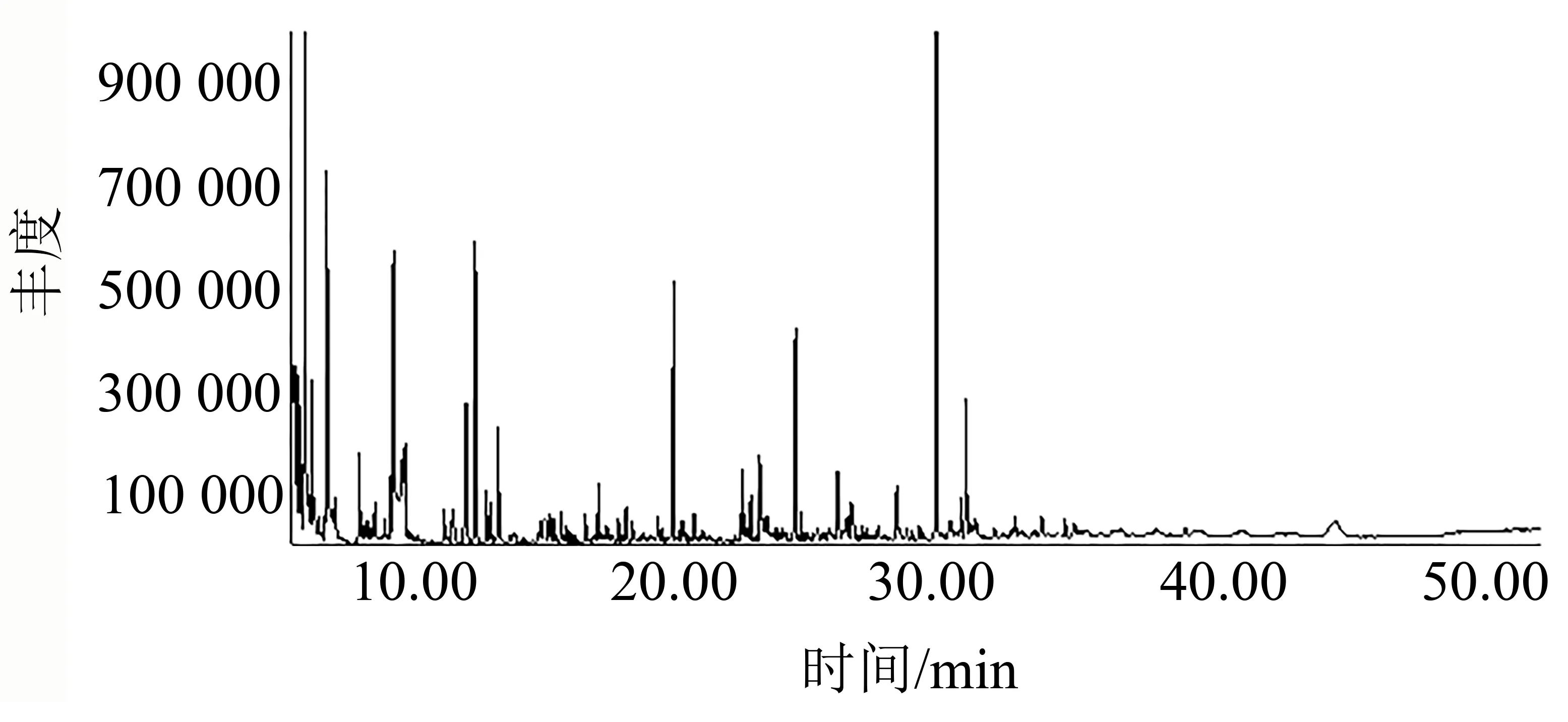
图1 废水有机物分析Fig.1 Analysis of organic matter in wastewater
1.3 实验装置
臭氧催化氧化实验装置如图2所示。
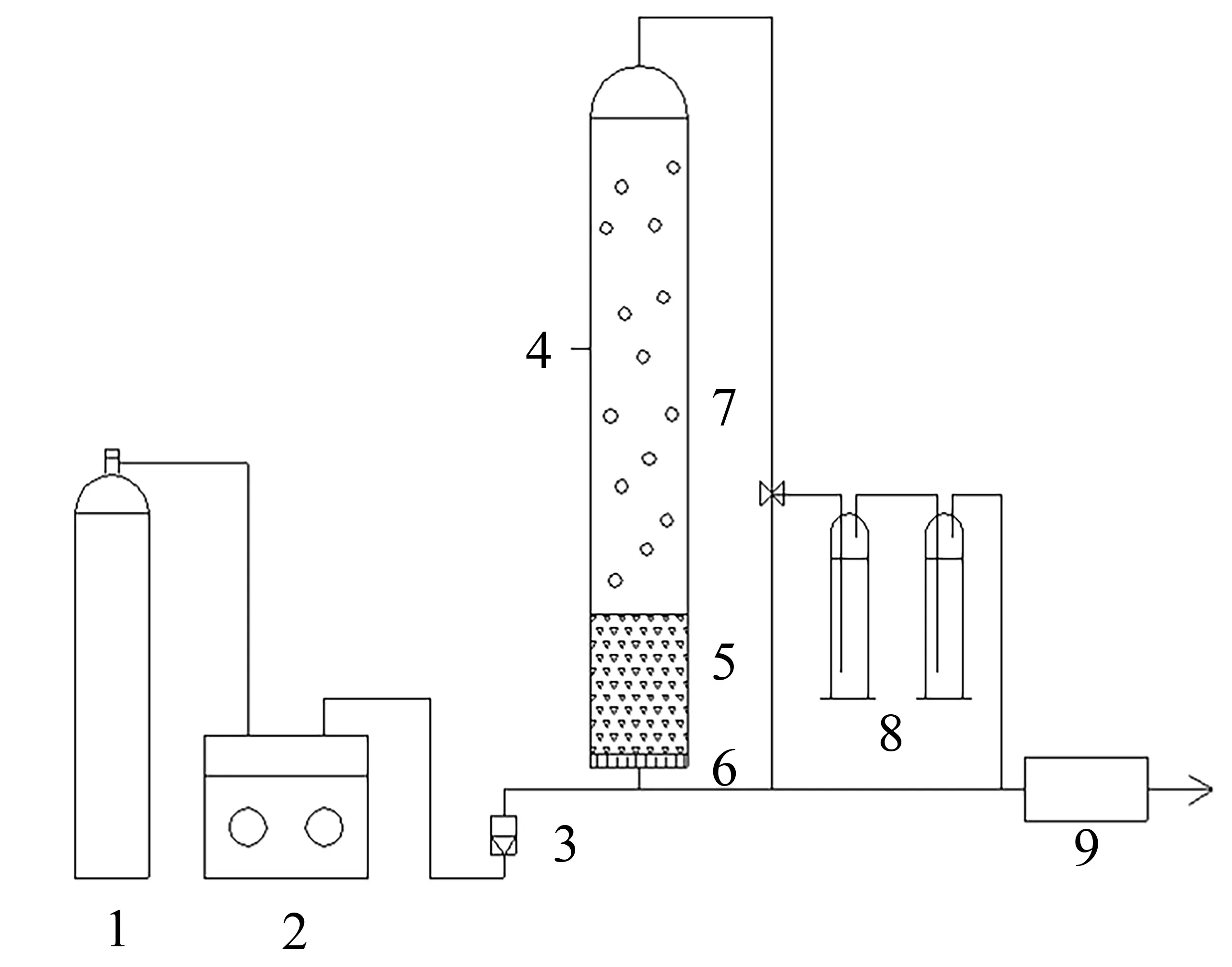
图2 臭氧催化氧化实验装置Fig.2 Ozone catalytic oxidation experimental device
氧气经臭氧发生器通过布气板在催化剂作用下与水相接触,生成羟基自由基氧化水中有机物,未反应的臭氧进入尾气收集装置。臭氧浓度由臭氧发生器调节,臭氧通气量由流量计及臭氧发生器调节。定时取样分析COD含量。COD去除率计算公式见式(1):
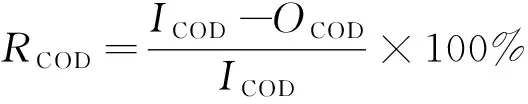
(1)
式中,RCOD为COD去除率,%;ICOD为进水COD含量,mg/L;OCOD为出水COD含量,mg/L。
1.4 实验内容
实验内容分为以下4个部分:① 分别采用混合法、浸渍法制备催化剂,考察不同活性组分下催化剂的催化性能;比较不同制备工艺下COD的去除效果,确定最佳的催化剂制备工艺及催化剂;② 实验研究不同工艺条件下COD的去除效果,优化确定最佳工艺条件;③ 在最佳工艺参数下,进行催化剂稳定性能评价;④ 对臭氧催化氧化的反应动力学模型进行探讨。
2 结果及讨论
2.1 催化剂制备工艺选择
混合法催化剂制备工艺:造粒机内放置100 mL活性氧化铝,随后缓慢加入100 mL硝酸铁浆液,造粒机转速为20 r/min,转动时间20 min;随后将其置于烘箱内在80 ℃下干燥10 h,再将其放于马弗炉内焙烧。马弗炉升温方式:以5 ℃/min由室温升至200 ℃,恒温40 min,随后5 ℃/min升至300 ℃,恒温30 min,再3 ℃/min升至550 ℃,恒温1.5 h,降至室温即可。
浸渍法催化剂制备方法:将100 mL活性氧化铝与100 mL硝酸铁置于500 mL锥形瓶中,将锥形瓶放于振荡器中,以50 rpm/min振荡24 h,随后将其置于烘箱内在80 ℃下干燥10 h,再将其放于马弗炉内焙烧。马弗炉升温方式:以5 ℃/min由室温升至200 ℃,恒温40 min,随后5 ℃/min升至300 ℃,恒温30 min,再3 ℃/min升至550 ℃,恒温1.5 h,降至室温即可。
对上述两种制备工艺的催化剂开展性能评价,实验条件:废水流量2 L/h,臭氧浓度200 mg/L,催化剂投加量1 L/L废水。实验过程中分别在60 min、90 min及120 min下取样分析,实验结果如图3所示。
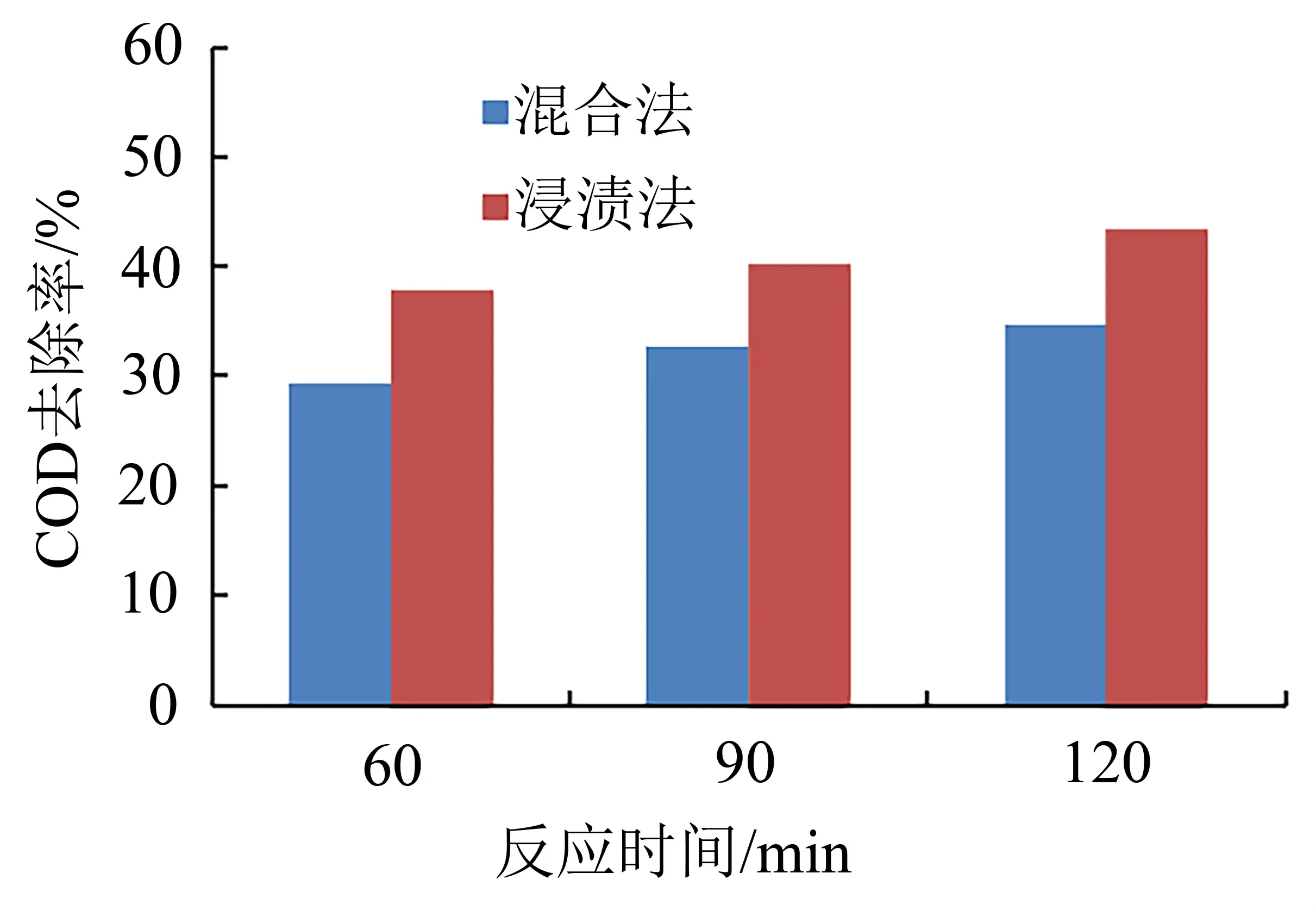
图3 制备工艺对COD去除率的影响Fig.3 Effect of preparation process on COD removal rate
由图3可知,催化剂制备工艺对COD去除率影响显著,其中浸渍法催化剂的COD去除率高于混合法。因相比混合法,浸渍法使活性组分充分均匀地负载于载体表面,且负载量大于混合法,同等臭氧条件下产生的羟基自由基数量更多,进而COD去除率更高。因此催化剂制备选择浸渍法。
2.2 臭氧催化剂选择确定
2.2.1载体选择
研究载体对COD去除率的影响,以确定最佳载体。载体选择陶粒及活性氧化铝,活性组分选择硝酸铁。对制备的催化剂开展性能评价,实验条件为废水流量2 L/h、臭氧浓度200 mg/L、催化剂投加量1 L/L废水。实验60 min后取样分析,结果如图4所示。
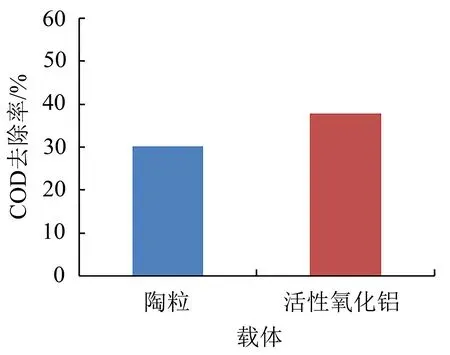
图4 载体对COD去除率的影响Fig.4 Effect of carrier on COD removal rate
由图4可知,载体对COD去除率影响显著,即当活性组分一致时,活性氧化铝基催化剂COD去除率高于陶粒基催化剂。究其原因是因为相比陶粒,活性氧化铝比表面积更大,具有更多活性位点,从而臭氧吸附至活性位点上产生更多羟基自由基,促进有机物降解。因此载体选择活性氧化铝。
2.2.2催化剂活性组分选择
研究活性组分对COD去除率的影响,以确定最佳活性组分。载体选择活性氧化铝,活性组分选择硝酸铁、硝酸锰、硝酸铈。对制备的催化剂开展性能评价,实验条件为废水流量2 L/h,臭氧浓度200 mg/L,催化剂投加量1 L/L废水。实验60 min后取样分析,实验结果如图5所示。

图5 活性组分对COD去除率的影响Fig.5 Effect of active components on COD removal rate
由图5可知,活性组分不同对COD去除率影响显著,铈基催化剂>锰基催化剂>铁基催化剂;反应时间60 min时,铈基催化剂的COD去除率为45.6%,锰基催化剂的COD去除率为42.4%,铁基催化剂的COD去除率仅为37.8%。究其原因是因为臭氧催化剂的表面羟基一般被认为B酸(布朗斯特酸),而催化剂表面的金属氧化物及不饱和氧原子分别为Lewis酸和Lewis碱,它们被认为是臭氧催化生成羟基自由基的关键,其中活性组分不同,则酸碱性也会不同,导致臭氧与其作用方式不同,进而产生羟基自由基的数量不同,因此COD的去除率也会不同。因此活性组分选择硝酸铈。
综上所述,催化剂制备工艺选择浸渍法,载体选择活性氧化铝,活性组分选择硝酸铈。
2.3 臭氧催化氧化工艺条件优化
按上述制备工艺制备活性氧化铝-铈基催化剂,考察不同工艺条件(催化剂投加量、臭氧投加量)对COD去除率的影响,确定最佳工艺参数。
2.3.1催化剂投加量对COD去除率的影响
研究催化剂投加量对COD去除率的影响,以确定最佳催化剂投加量。实验条件为臭氧投加量200 mg/L,废水处理量2 L/h,催化剂投加量为0.5 L/L ~2.0 L/L,定时从取样口4取样分析COD。投加量对COD去除率的影响如图6所示。
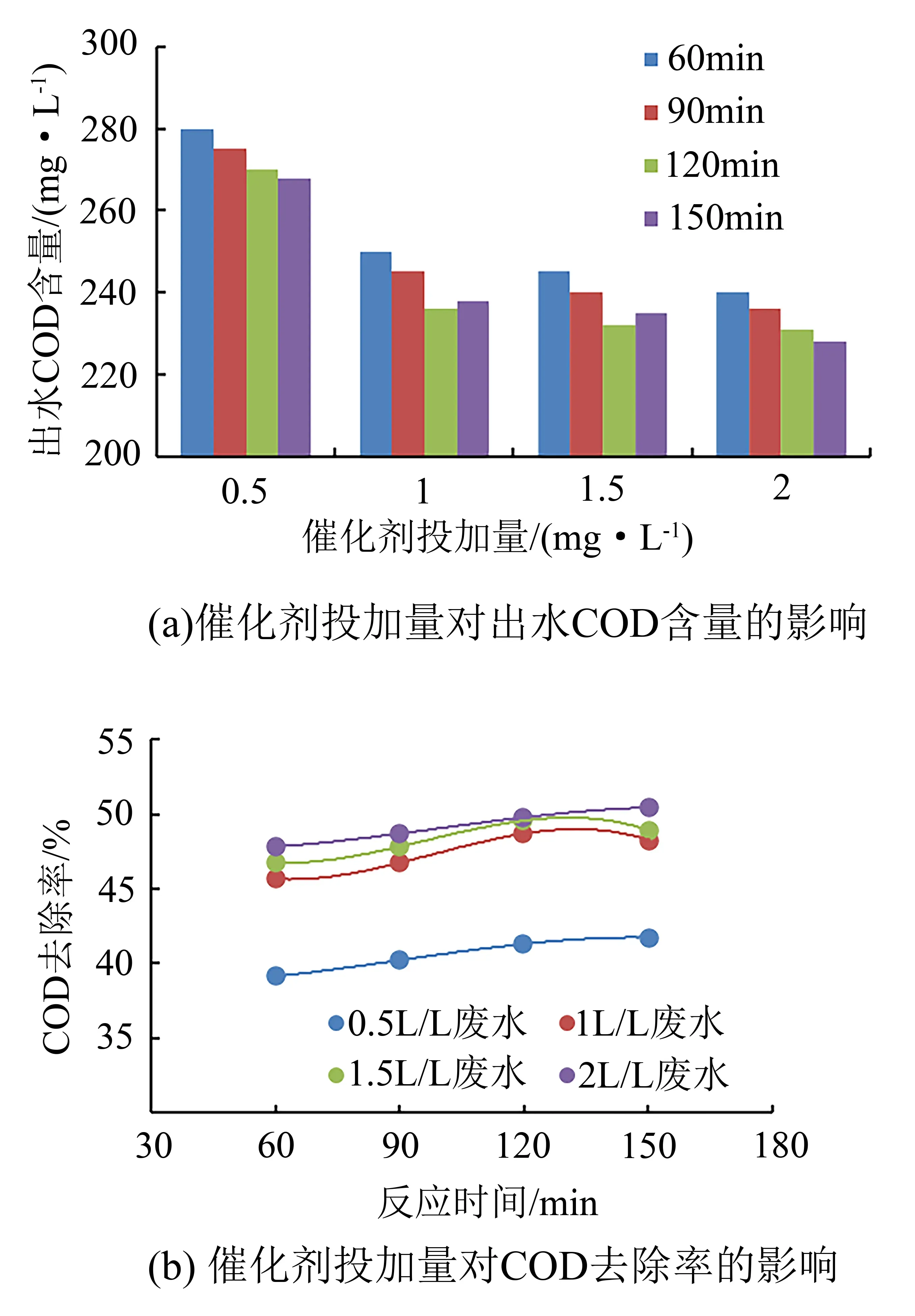
图6 催化剂投加量对COD去除率的影响Fig.6 Effect of catalyst dosage on COD removal rate
由图6可知:①催化剂投加量越大,COD去除率越高,且COD去除率随时间延长而提高,当反应时间达120 min后基本反应完全。② 投加量为0.5 L/L时,150 min后COD去除率为41.73%,出水COD含量268 mg/L;当投加量为1.0 L/L时,150 min后COD去除率为48.26%,出水COD含量238 mg/L;当投加量为1.5 L/L时,150 min后COD去除率为48.91%,出水COD含量235 mg/L;当投加量为2.0 L/L时,150 min后COD去除率为50.43%,出水COD含量228 mg/L。③ 分析催化剂投加量越大,COD去除率越高的原因是当臭氧投加量一定时,催化剂投加量越大意味着提供臭氧反应生成羟基自由基的活性位点越多,但催化剂投加量若继续增加,催化剂不再是绝对羟基自由基生成量的决定因素(决定因素变为臭氧投加量),因此COD去除率不会继续升高,反而会导致催化剂投加过剩,因此综合考虑催化剂投加量选择1.0 L/L废水。
2.3.2臭氧投加量对COD去除率的影响
研究臭氧投加量对COD去除率的影响,以确定最佳臭氧投加量,实验条件为催化剂投加量1.0 L/L废水、废水处理量2 L/h、臭氧投加量100 mg/L ~250 mg/L,定时从取样口4取样进行COD分析。臭氧投加量对COD去除率的影响如图7所示。

图7 臭氧投加量对COD去除率的影响Fig.7 Effect of ozone dosage on COD removal rate
分析图7可知:① 臭氧投加量越大,COD去除率越高,且COD去除率随时间延长而提高,当反应时间达120 min后其基本反应完全。②反应时间150 min时,臭氧投加量100 mg/L的COD去除率为43.48%、出水COD含量为260 mg/L;臭氧投加量为150 mg/L的COD去除率为46.52%、出水COD含量为246 mg/L;臭氧投加量200 mg/L的COD去除率为49.13%、出水COD含量为234 mg/L;臭氧投加量250 mg/L的COD去除率为49.57%、出水COD含量为232 mg/L。③ 分析臭氧投加量越大则COD去除率越高的原因如下:催化剂投加量一定时,臭氧投加量提高,意味着更多的臭氧与催化剂活性位点结合反应生成羟基自由基,直到臭氧量与活性位点数饱和,此时再增加臭氧投加量,臭氧量不再是决定羟基自由基生成的决定因素,反而会导致臭氧利用率的降低及臭氧的无效消耗。因此,综合考虑将臭氧投加量选择为200 mg/L。
2.4 臭氧催化剂稳定性评价
对浸渍法制备的活性氧化铝-铈基催化剂开展稳定性评价实验。实验条件为催化剂投加量1.0 L/L废水,废水处理量2 L/h,臭氧投加量250 mg/L,定时从取样口4取样分析COD。结果如图8所示。
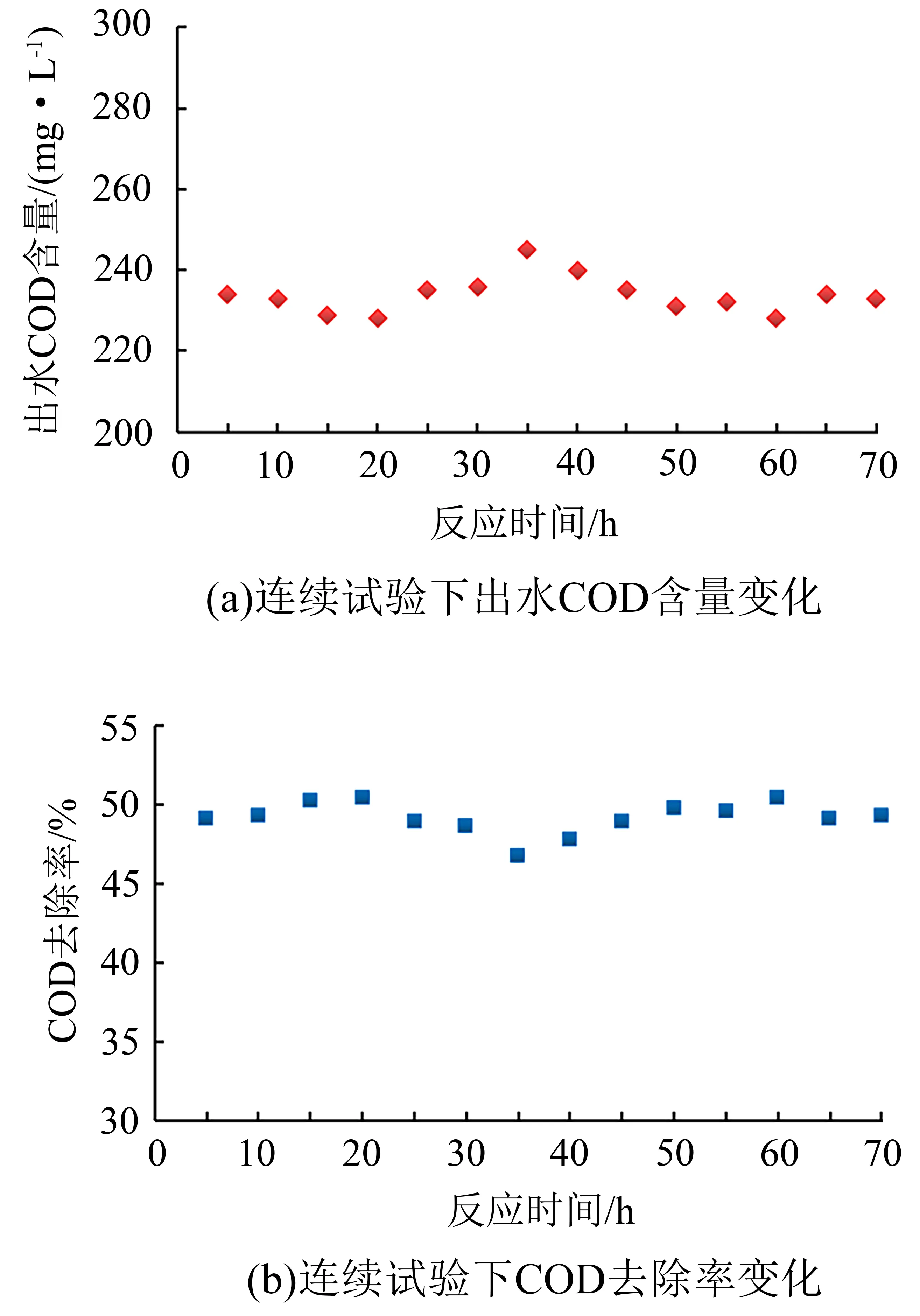
图8 臭氧催化剂稳定性实验效果Fig.8 Experimental results of ozone catalyst stability
由图8可知:对制备的臭氧催化剂开展稳定性评价实验,当臭氧投加量为200 mg/L,催化剂投加量为1.0 L/L废水时反应70 h,COD去除率稳定在47%~50%;出水COD含量稳定在230~245 mg/L,即浸渍法制备的活性氧化铝-铈基催化剂具有足够的稳定性。
2.5 臭氧催化氧化反应动力学探讨
通过文献调研,确定臭氧催化氧化降解废水中有机物的过程模型属于一级反应动力学模型,因此可认为反应动力学模型能确定臭氧催化氧化降解废水有机物的反应速率。其中反应动力学方程见式(2):
-ln(C/C0)=kt
(2)
其中,C0为进水COD初始浓度,mg/L;C为反应一段时间后COD浓度,mg/L;k为反应速率常数;t为反应时间,min。
以活性氧化铝为载体,活性组分为硝酸铈、硝酸铁、硝酸锰,采用浸渍法制备3种催化剂,与臭氧氧化进行对比实验,实验条件:催化剂投加量1.0 L/L废水,水处理量2 L/h,臭氧投加量200 mg/L,定时从取样口4取样分析COD。以时间为横坐标,-ln(C/C0)为纵坐标作图,如图9所示。
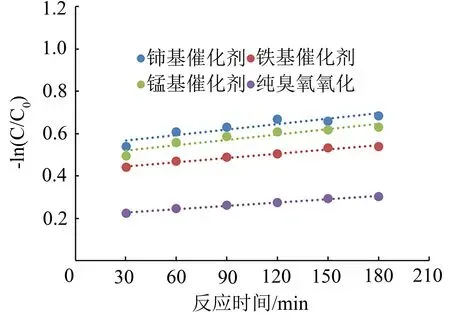
图9 臭氧催化氧化反应动力学模型Fig.9 Kinetic model of ozone catalytic oxidation reaction
由图9可知,铈基反应动力学曲线为:y=0.000 9x+0.541 2,锰基反应动力学曲线为:y=0.000 7x+0.0.425 4,铁基反应动力学曲线为:y=0.000 8x+0.496 4,臭氧氧化反应动力学曲线为:y=0.000 5x+0.211 3;其中铈基催化剂的反应速率常数为0.000 9,铁基催化剂的反应速率常数为0.000 8,锰基催化剂的反应速率常数为0.000 7,而纯臭氧氧化的反应速率常数为0.000 5。
所以反应速率常数大小顺序为铈基催化剂的催化效率>锰基催化剂>铁基催化剂,其中铈基催化剂的反应速率常数是纯臭氧氧化的1.8倍,铁基催化剂的反应速率常数是纯臭氧氧化的1.6倍,锰基催化剂的反应速率常数是纯臭氧氧化的1.4倍。即臭氧催化氧化可有效降解水中有机物,提高COD去除率。
3 结 论
以宁夏某化工高盐废水为水样,开展臭氧催化氧化实验,得到以下结论:
(1)通过废水水质表征发现:废水TDS为7 050 mg/L,氯离子为3 500 mg/L,属于高盐废水,且无机盐含量高,同时COD为460 mg/L,即水中难降解有机物较多,其中难降解有机物主要为含氮有机化合物,具体有吡咯烷、吡啶、吲哚、酰胺、腈等,因此需采用臭氧催化氧化法有效处理。
(2)通过臭氧催化剂制备工艺及催化剂选择实验发现:制备工艺、载体及活性组分类型对COD的去除率影响显著;浸渍法催化剂对COD去除率高于混合法,载体活性氧化铝的COD去除率高于陶粒;活性组分对COD去除率由大到小为铈率>锰>铁;综上考虑催化剂制备工艺选择浸渍法,载体选择活性氧化铝,活性组分选择硝酸铈。
(3)通过臭氧催化氧化工艺优化及稳定性评价实验发现最佳工艺条件:催化剂投加量1.0 L/L废水,臭氧投加量250 mg/L;反应70 h时COD去除率稳定在47% ~50%,出水COD稳定在230~245 mg/L,即臭氧催化剂具有足够的稳定性。
(4)通过探讨臭氧催化氧化的反应动力学模型发现:活性组分对反应速率常数影响显著,且由大到小顺序依次为:铈>锰>铁;臭氧催化剂的反应速率常数远大于纯臭氧氧化,即铈基催化剂的反应速率常数是纯臭氧氧化的1.8倍,铁基催化剂的反应速率常数是纯臭氧氧化的1.6倍,锰基催化剂的反应速率常数是纯臭氧氧化的1.4倍。
