芦苇根际对有色溶解性有机质的脱色机理及环境行为
2022-03-02阿丹潘袁黄汉杰陶雪琴卢桂宁杜建军邹梦遥
阿丹 潘袁 黄汉杰 陶雪琴 卢桂宁 杜建军 邹梦遥
摘 要:有色溶解性有機质(CDOM)是水体中天然有机质的重要组成成分,它的过量输入会造成湖泊、水库等水体的富营养化,甚至直接污染饮用水。植物修复技术具有经济有效、绿色环保等特点,适用于环境中CDOM面源污染的控制与治理以及污水处理厂尾水中CDOM的深度净化。研究植物净化过程中CDOM的脱色原理及环境行为,对水环境保护和饮用水安全具有十分重要的意义。通过CDOM在植物根际中的脱色、分布和组成分析,探究植物对CDOM的脱色性能以及CDOM在根际环境的分布特征和组成成分;结合植物根系分泌物和酶提取液的脱色实验,考察根系分泌物和植物酶对CDOM脱色反应的影响机制。结果表明:CDOM难以自然水解,其有效脱色依赖于植物的存在;植物对CDOM的作用方式以根系吸收为主、根表吸附为辅,形成了大部分CDOM以低分子形态累积在植物体内(92.2%)、少部分CDOM以高分子形态附着在植物表面(7.7%)的分布特征;植物根系分泌物虽然不能直接影响CDOM的脱色过程,但可以通过改善根际微环境、促进微生物生长、富集相关降解菌种、改变CDOM生物可利用性等方式来强化根际微生物对根表附着的高分子CDOM的碳源利用能力;经生物降解生成的低分子CDOM通过根系吸收进入植物体内,并在植物酶的作用下进一步代谢分解,从而达到植物净化CDOM的目的。
关键词:有色溶解性有机物;植物修复;根际效应;根系分泌物;酶提取液
中图分类号:X524 文献标志码:A 文章编号:2096-6717(2022)03-0119-07
收稿日期:2020-06-16
基金项目:国家自然科学基金(41907293);广东省自然科学基金(2019A1515012217);广州市科技计划(201704020187)
作者简介:阿丹(1985- ),女,博士,副教授,主要从事生物修复研究,E-mail:adan@zhku.edu.cn。
邹梦遥(通信作者),女,副教授,E-mail:mengyaozou@zhku.edu.cn。
Received:2020-06-16
Foundation items:National Natural Science Foundation of China (No. 41907293); Natural Science Foundation of Guangdong Province (No. 2019A1515012217); Science and Technology Plan Project of Guangzhou City (No. 201704020187)
Author brief:A Dan (1985- ), PhD, associate professor, main research interest: biological remediation, E-mail: adan@zhku.edu.cn.
ZOU Mengyao (corresponding author), associate professor, E-mail: mengyaozou@zhku.edu.cn.
Decolorization mechanism and environmental behavior of colored dissolved organic matter in the rhizosphere of Phragmites australis
A Dan1, PAN Yuan1, HUANG Hanjie1, TAO Xueqin1, LU Guining2, DU Jianjun1, ZOU Mengyao1
(1. College of Resources and Environment; Engineering and Technology Research Center for Agricultural Land Pollution Integrated Prevention and Control of Guangdong Higher Education Institutes, Zhongkai University of Agriculture and Engineering,Guangzhou 510225, P. R. China; 2. School of Environment and Energy; The Key Laboratory of Pollution Control and Ecosystem Restoration in Industry Clusters, Ministry of Education, South China University of Technology, Guangzhou 510006, P. R. China)
Abstract: Colored dissolved organic matter (CDOM) is an important component of natural organic matter in water. CDOM with high concentrations may cause eutrophication of drinking water sources such as lakes and reservoirs, and even directly pollute municipal tap water. Phytoremediation is regarded as an effective, economical, and ecological technology for the treatment of CDOM non-point pollution, and the purification of CDOM polluted wastewater treatment plant discharge. For the sake of aquatic environmental protection and drinking water safety, it is very necessary to study the decolorization mechanism and environmental behavior of CDOM by plants. In the present study, the decolorization, distribution, and composition of CDOM in the rhizosphere of Phragmites australis were investigated, as well as the influence mechanism of plant root exudates and enzyme extracting solution on the CDOM removal. The results showed that CDOM was difficult to be hydrolyzed, and its effective decolorization depended on the effect of plants. In the rhizosphere, CDOM was mainly removed by plant uptake and supplemented by root adsorption, forming the distribution characteristics that most of the CDOM were accumulated by plants as low molecules (92.2%) and the rest were adhered to root surface as high molecules (7.7%). Although root exudates cannot directly affect the decolorization process of CDOM, they can enhance the carbon source utilization ability of rhizosphere microbes to the high molecular CDOM, by improving the rhizosphere microenvironment, promoting the microbial growth, enriching the related-degrading bacteria, and changing the CDOM bioavailability. Low molecular CDOM generated by microbial degradation was transported into the plant through root uptake, and then were metabolized under the effect of plant enzymes, so as to achieve the purpose of CDOM purification by plants.
Keywords: chromophoric dissolved organic matter; phytoremediation; rhizosphere effect; root exudate; enzyme extracting solution
有色溶解性有机质(CDOM)是由腐殖酸、富里酸和芳香烃等组成的复杂有機质,也是水体中天然有机质的重要组成成分[1]。CDOM是水生态系统中重要的碳赋存形式之一,对生物地球化学循环、能量流动及水质安全有着重要的影响[2-3]。由于自身的吸附性和络合性,CDOM还是水体中有机污染物和重金属的重要载体[4-5],对污染物的归趋、毒性效应和生物有效性有着深远影响[6]。CDOM常被用来表征湖泊、水库等水体的富营养化程度[7],过量的CDOM输入会对水源水质造成威胁[8]。此外,高浓度的CDOM还可能与水处理中的氯发生反应,生成卤乙酸和三卤甲烷等致癌物质[9],并为饮用水中细菌的生长提供碳源[10],从而影响人类健康[11]。可见,控制水体中的CDOM含量对水环境保护和饮用水安全都具有十分重要的意义。
植物修复技术因其效果好、成本低、无二次污染等特点,有望应用于环境中CDOM面源污染的控制与治理以及污水处理厂尾水中CDOM的深度净化。Cano等[12]研究表明,种有红鸟蕉和纸莎草的湿地系统比无植物对照组的脱色效果高出20%~21%。Huang等[13]研究证实,使用海马齿的植物浮床技术可以有效去除水体中CDOM,且根际效应起到主要作用。A等[14]发现芦苇湿地系统对污水中腐殖酸的脱色效果(76%~90%)显著高于无植物湿地系统(59%~86%)。因此,有必要进一步研究植物对CDOM的脱色原理以及CDOM在植物根际的环境行为。
笔者以常见湿地植物芦苇(Phragmites australis)为受试植物,以腐殖酸为代表性CDOM,旨在通过CDOM在芦苇根际的脱色、分布和组成分析,探究植物对CDOM的脱色性能,以及CDOM在根际环境的分布特征与组成成分;通过芦苇根系分泌物的脱色实验,考察植物根系分泌物对CDOM脱色的影响;通过芦苇酶提取液的脱色实验,了解植物酶对CDOM脱色的作用。研究结果有助于揭示CDOM在植物根际的脱色机理及其环境行为,为植物修复CDOM的研究和应用提供技术支持和理论依据。
1 材料与方法
1.1 CDOM在芦苇根际的脱色、分布和组成分析
1.1.1 CDOM脱色效果分析
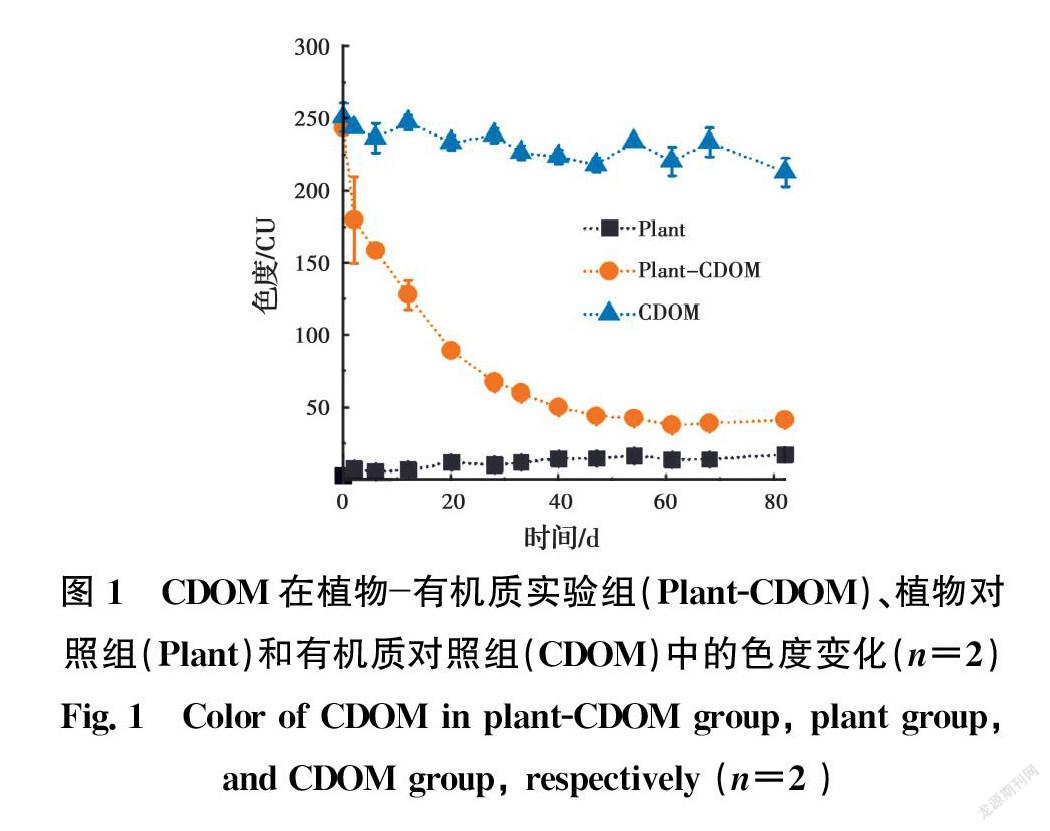
向每个玻璃瓶中添加500 mL浓度为50 mg/L的腐殖酸钠(Sigma Aldrich,上海)溶液,然后移入3株长势相同的芦苇幼苗。所有玻璃瓶用锡纸包裹进行遮光处理,并置于温室条件(24 ℃、1 950 lx、16 h light/8 h dark)下进行为期82 d的植物水培实验。实验共设置3个处理组:1)有植物且添加腐殖酸的植物有机质实验组;2)有植物且不添加腐殖酸的植物对照组;3)无植物且添加腐殖酸的有机质对照组,每组设两个平行。实验期间在82 d里连续采样13次,每次采样10 mL测定色度,且采样前补充蒸发掉的水量并搅拌均匀,以避免水分耗损对色度的影响。色度的定量以390 nm波长下的吸光度换算得到[14]。
1.1.2 CDOM分布特征分析
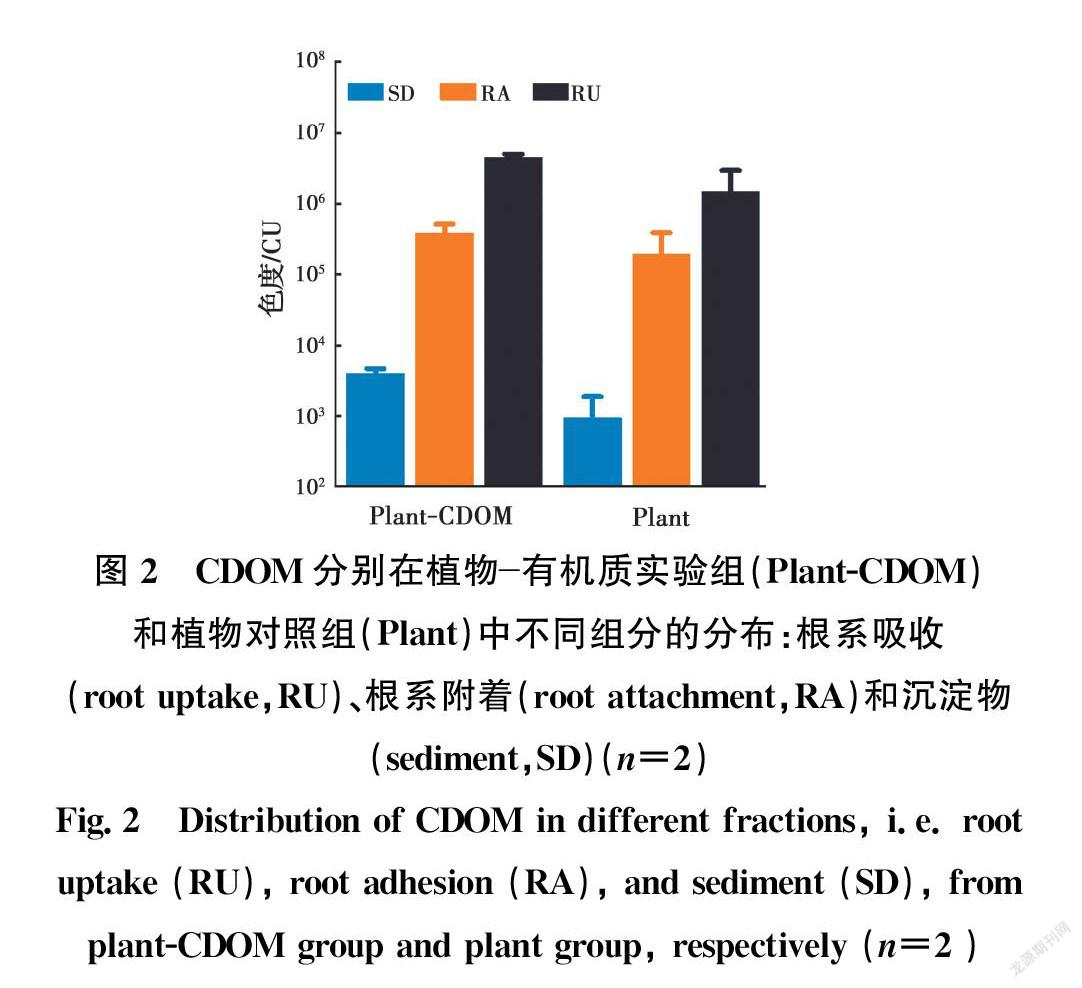
待CDOM脱色效果实验结束,立即回收芦苇的根系、根系附着物及容器底部沉淀物。将上述3种样品放入烘箱干燥(65 ℃,48 h)后称重。使用0.02 mol/L的NaOH作为CDOM洗脱液,根系样品使用30 mL洗脱液洗脱至洗脱液没有色度为止(n=7)(n为采样次数),根系附着物和容器底部沉淀物样品均使用10 mL洗脱液洗脱至洗脱液没有色度为止(n=5),然后测定所有样品洗脱液的色度。
1.1.3 CDOM组成成分分析
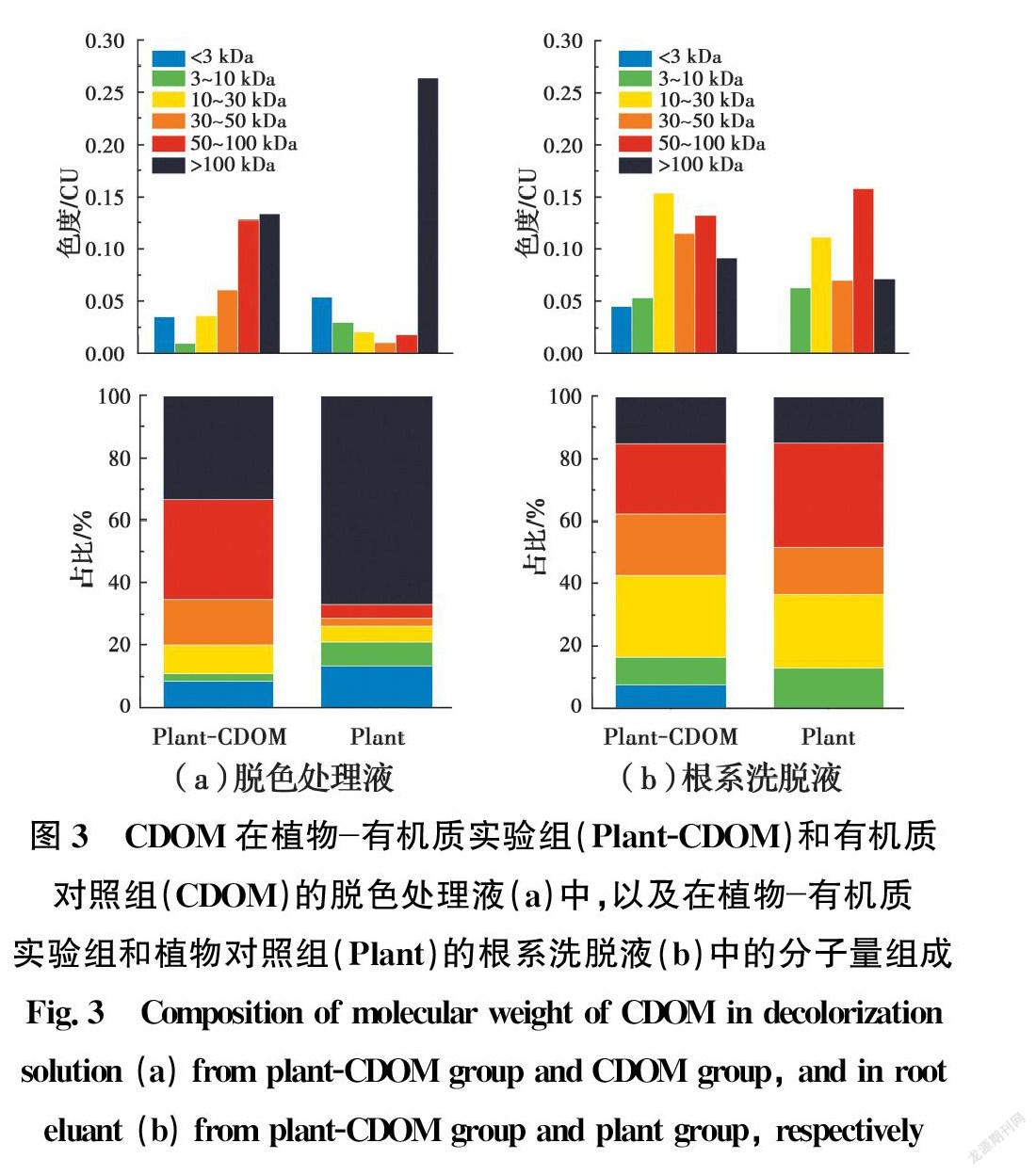
待CDOM脱色效果分析结束,立即回收植物有机质实验组和有机质对照组的剩余溶液;待CDOM分布特征分析结束,立即回收植物有机质实验组和植物对照组的根系洗脱液。将上述样品调节到pH值为8.0、色度为20 CU的状态后,用超滤离心管(Amicon Ultra-4、Milipore、美国)超滤,然后计算滤液中5种不同截留分子量(3 000、10 000、30 000、50 000、100 000 NMWL)的浓度来分析不同样品中CDOM的组成成分,具体操作步骤参照超滤离心管的使用说明书。
1.2 芦苇根系分泌物的脱色实验
芦苇根系分泌物的制备分为两部分:1)水溶性分泌物样品的制备:待CDOM脱色效果实验结束,立即回收植物有机质实验组的芦苇根,并称取一定湿重(11.7 g)的根系样品;将根系样品浸入200 mL超纯水中,置于振荡培养箱((28±1) ℃、120 r/min、3 min)内振荡以清洗根系附着物;将根系样品取出,重新浸入200 mL超纯水中,置于人工气候培养箱((28±1) ℃、8 000 lx、16 h light/8 h dark)内静置培养1 d;将根系样品取出,并将剩余溶液经0.2 μm醋酸纤维膜针头过滤器(DISMIC-25CS,ADVANTEC,日本)过滤,所得滤液作为水溶性分泌物样品。2)根系附着分泌物样品的制备:将上述根系样品浸入100 mL超纯水中,使用超声粉碎机和旋转震荡仪交替进行超声(20 kHz、130 W、1 min)和振荡各6次;将根系样品取出,并将剩余溶液经0.2 μm醋酸纤维素膜针头过滤器过滤,所得滤液作为根系附着分泌物样品。
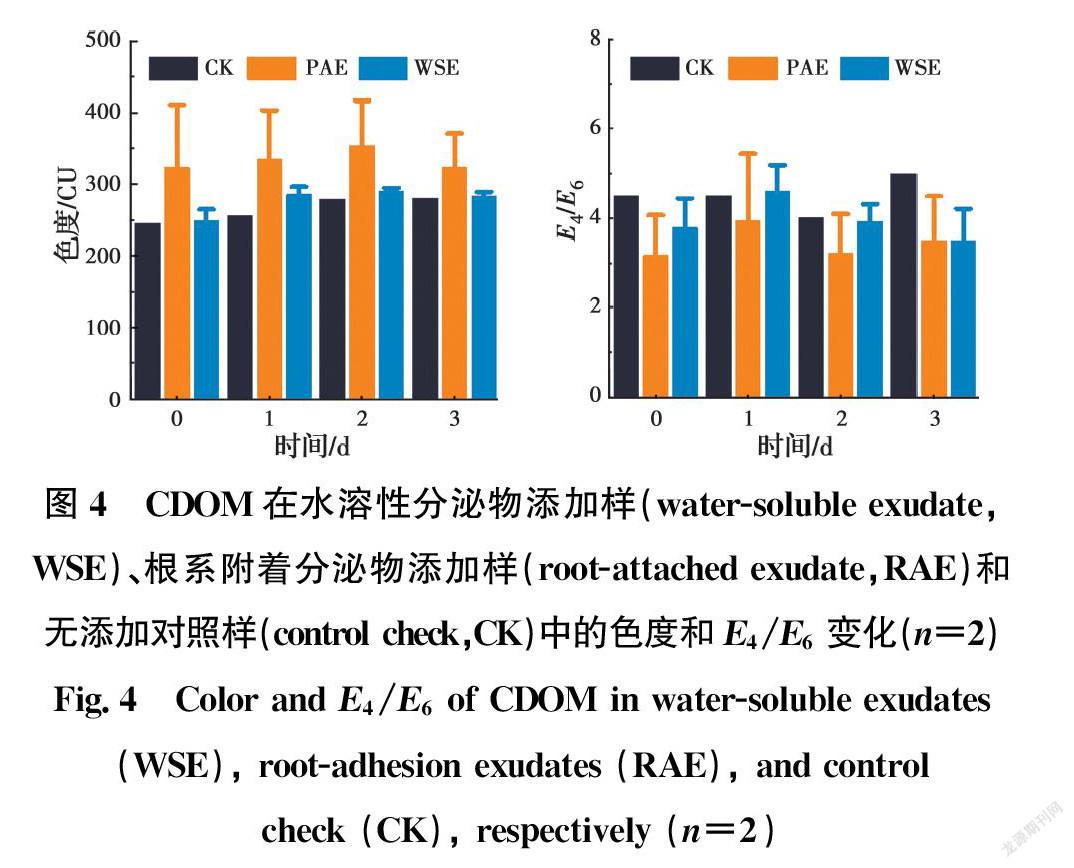
将上述水溶性分泌物样品和根系附着分泌物样品经冷冻干燥机浓缩干燥后,分别复溶于乙腈中,制成5倍浓缩根系分泌液。取0.5 mL上述浓缩液和4.5 mL浓度为50 mg/L的腐殖酸钠溶液(pH值8.0)混合,然后注入褐色试管中,并置于振荡培养箱(25 ℃、100 r/min)内培养。同时设置不添加根系分泌液的空白对照一起培养。连续4 d定时采取0.1 mL水样进行吸光度测定,以390 nm波长下的吸光度换算成色度(CU),以465、665 nm波长下吸光度的比值(E4/E6)来表征CDOM的腐殖化程度。E4/E6值越小,表明CDOM的芳香性越高、分子量越高[15]。
1.3 芦苇酶提取液的脱色实验
待CDOM脱色效果实验结束,立即回收植物有机质实验组的芦苇根,并称取湿重240 mg的根系样品。使用P-PER植物总蛋白抽提试剂盒(P-PER Plant Protein Extraction Kit,Thermo Scientific,美国)抽提芦苇根系的组织蛋白,所得溶液作为植物酶提取液。取酶提取液按照0%、1%、5%的体积比与50 mg/L腐殖酸钠溶液(pH值8.0)混合,然后注入褐色试管中,并置于振荡培养箱(20 ℃、100 r/min)内培养。连续2 d定时采取0.1 mL水样,并在390、465、665 nm波长下测定吸光度并计算其色度与E4/E6值。
2 结果和分析
2.1 CDOM在芦苇根际的脱色、分布和组成
2.1.1 CDOM脱色效果
不同处理组中芦苇对CDOM的脱色效果见图1。在整个实验过程中,植物有机质实验组表现出较好的脱色效果(84%),在前40 d,植物便将色度从244 CU降至50 CU,此后色度稳定在37~44 CU之间。植物对照组因为没有添加CDOM,其初始色度接近于零(2.6 CU),但随着实验的进行,其色度缓慢上升到17 CU,这可能是植物释放的分泌物中含有CDOM所致,但整体色度变化不大,可以忽略不计。有机质对照组因为缺少植物的作用,色度在82 d里仅从251 CU下降到213 CU。可见CDOM的自然水解速度十分缓慢,其脱色效应主要依赖于植物的作用。一方面,植物可以通过直接吸收和吸附CDOM来减少其环境含量;另一方面,植物根系可以为微生物提供生长介质,从而间接促进CDOM的生物降解。
2.1.2 CDOM分布特征
植物根系、根系附着物及容器底部沉淀物中CDOM提取液的色度见图2。根系吸收、根系附着、沉淀物中CDOM色度分别为4.6×106、3.8×105、4.0×103 CU,且色度在这3种组分中的占比依次为92.20%、7.71%、0.08%。由此可见,CDOM大部分被根系吸收到植物体内,少部分吸附在植物根表,只有极少量残渣与根系分泌物共同絮凝沉降在容器底部。虽然浓度相差甚远,植物有机质实验组和植物对照组中CDOM的分布规律基本一致,说明植物本身也含有一定量的CDOM[16],且植物对不同浓度CDOM的去除方式均为根系吸收为主、根表吸附为辅。
2.1.3 CDOM组成成分
脱色处理液中CDOM不同分子量占比如图3(a)所示。有机质对照组中高分子CDOM(分子量>100 kDa)的占比(67%)高于植物有机质实验组(33%),表明植物可以促进CDOM分解,从而达到低分子化的效果。然而,有机质对照组中低分子CDOM(分子量<10 kDa)的占比(21%)也高于植物有机质实验组(11%),这可能是因为低分子有机质容易被植物吸收,从而转移进入植物体内[17]。
根系洗脱液中CDOM不同分子量占比如图3(b)所示。植物对照组中低分子CDOM(分子量<30 kDa)的占比(37%)低于植物有机质实验组(43%),特别是植物有机质实验组中发现了低分子CDOM(分子量<3 kDa)(8%),而植物對照组中没有(0%),说明只有低分子有机质才能通过细胞膜进入植物体内,这进一步解释了图3(a)中植物有机质实验组的脱色处理液中低分子CDOM含量少的原因。
2.2 芦苇根系分泌物对CDOM的脱色效果
根系分泌液脱色实验结果如图4所示。随着时间的推移,CDOM的色度和E4/E6值在不同根系分泌物中均十分稳定,分别为249~290 CU和3.5~4.6(水溶性分泌物)、322~353 CU和3.2~4.0(根系附着分泌物)、245~280 CU和4.0~5.0(无添加对照样)。其中,水溶性分泌物的色度范围与无添加对照样非常相近,但低于根系附着分泌物;而根系附着分泌物的E4/E6值则略低于另外两种。由此可知,
不但芦苇根系分泌物对CDOM的脱色及其腐殖化过程均无直接影响,而且植物分泌的CDOM分子量较大,附着在植物根表上不易随水流动,这与前面发现的低分子CDOM易被吸收进入植物体内的结果相呼应。
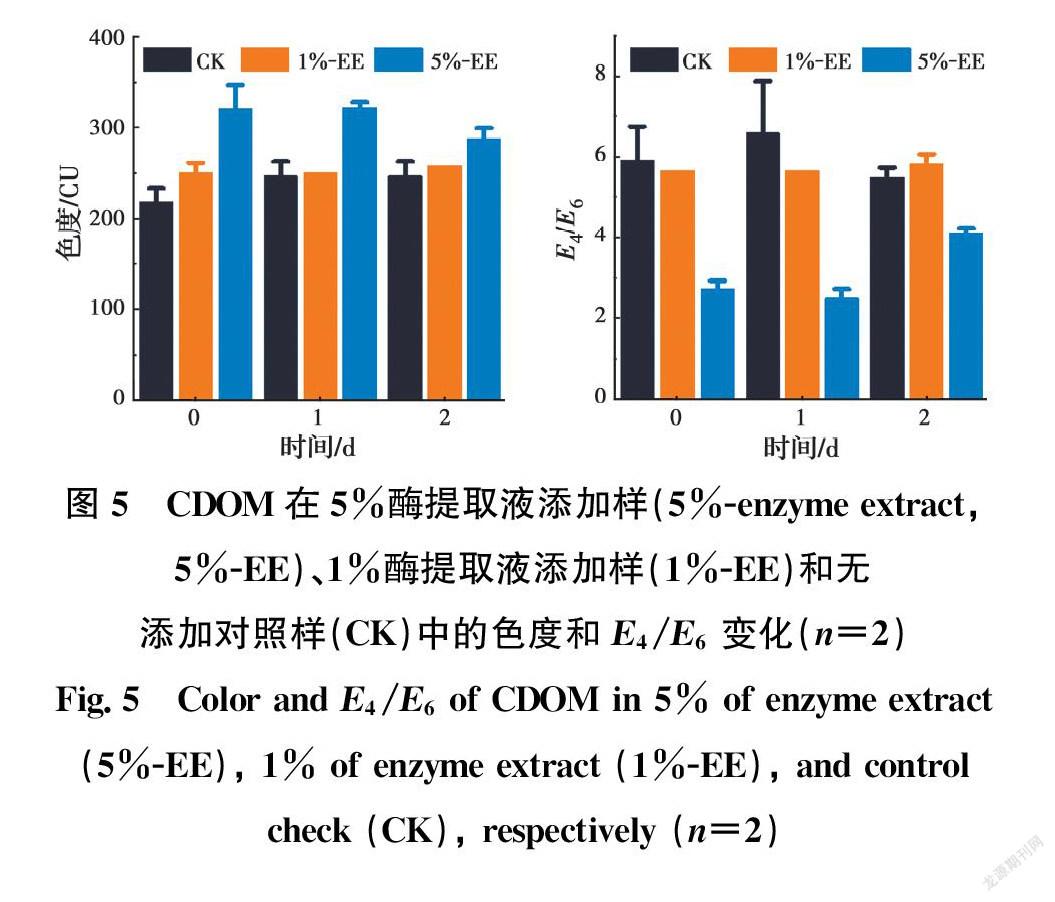
2.3 芦苇酶提取液对CDOM的脱色效果
酶提取液脱色实验的结果如图5所示。随着酶提取液添加量的提高,CDOM的反应呈现如下规律:在无添加对照样中,色度从217 CU上升到246 CU,且E4/E6值从5.9下降到5.5;在1%酶提取液添加样中,色度和E4/E6值均十分稳定,分别为250 CU和5.6;而在5%酶提取液添加样中,色度从321 CU下降到288 CU,且E4/E6值从2.7上升到4.1。表明植物酶可以作用于CDOM的低分子化进程,从而起到脱色的效果,这就解释了在CDOM组成成分分析中观察到植物能够使CDOM低分子化的原因。
3 讨论
在自然水解条件下,CDOM难以发生脱色反应,其有效脱色依赖于植物作用。绝大部分CDOM累积在植物体内,少量吸附在根系表面,只有极少量与根系分泌物共同絮凝沉淀。因此,植物以根系吸收为主、根表吸附为辅的途径对CDOM进行脱色,这就决定了CDOM在植物不同组分中的分布规律;高分子有机物(分子量>3.5 kDa)容易附着在植物细胞壁上,而低分子有机物(分子量<3.5 kDa)可以通过植物细胞膜进入植物体内[17]。这与本研究的结果相一致,可见植物的存在有助于CDOM的低分子化,而这些低分子CDOM易被根系吸收进入植物体内。
虽然研究发现根系分泌物对CDOM的脱色反应并无明显影响,但这并不表示它毫无作用。一方面,根系分泌物可以作为碳源而被微生物直接利用[18];另一方面,植物释放的有机酸不但能够使细胞表面吸附的腐殖酸结构发生变化[15],而且可以刺激植物根系生长与ATP合成酶生成[19-20]。由此认为,植物根系分泌物并不是直接作用于CDOM的脱色过程,而是通过改变CDOM的形态结构以增强其生物可利用性,以及刺激相关功能菌的富集,从而促进CDOM的生物降解[21-23]。此外,植物的存在不但可以通过提供生长介质、释放营养物质和氧气等根际效应来改善根际微生物的生长条件[24],而且可以通过生成过氧化物酶等代谢酶来促进CDOM的低分子化过程[25]。
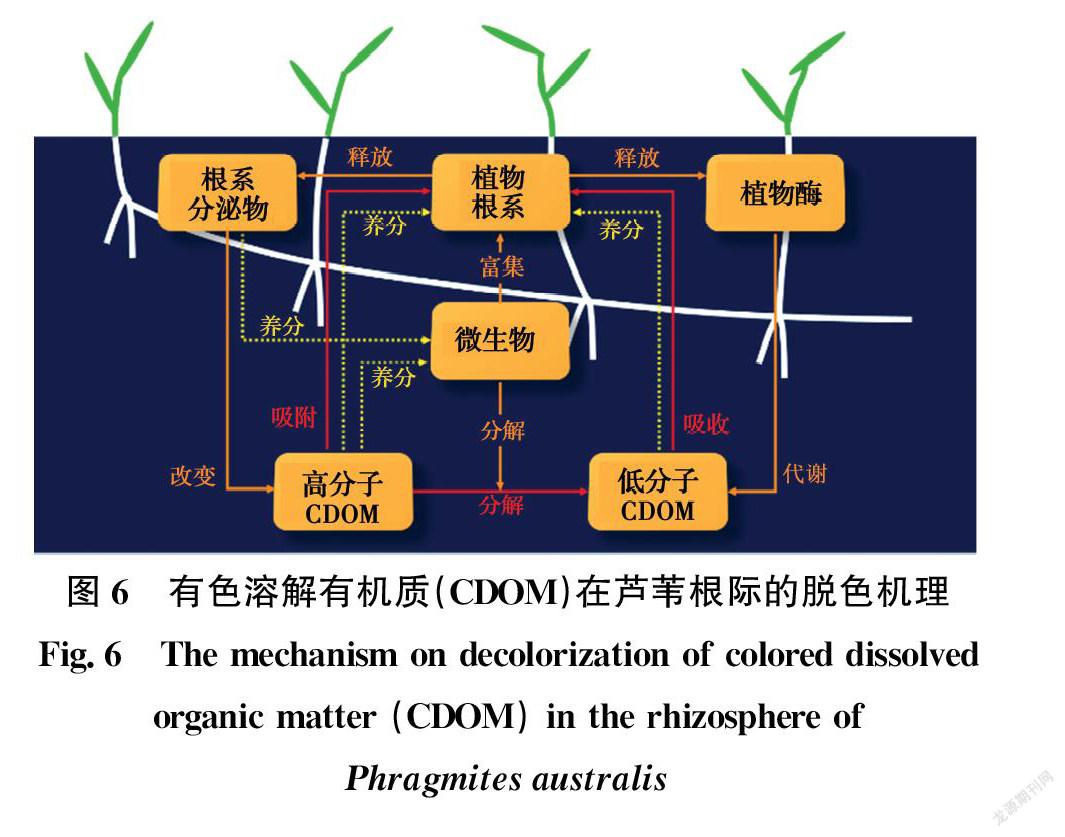
结合植物脱色实验和已知的微生物相关特性,图6汇总了CDOM在芦苇根际的脱色机理:1)高分子CDOM吸附在根表的细胞壁上,低分子CDOM通过细胞膜进入植物体内;2)植物的存在为微生物的富集提供了适宜的界面和微环境;3)CDOM的存在为植物和根际微生物的生长提供了碳源;4)植物释放的根系分泌物可以改变CDOM结构,增强微生物活性;5)步骤2)~4)均有利于附着在植物根表的CDOM发生生物降解,从高分子有机质分解成低分子有机质;6)经低分子化过程的CDOM被根系吸收进入植物体内,从而被植物酶进一步代谢分解。
4 结论
1)CDOM难以发生自然水解,其有效脱色依赖于植物作用。以根系吸收为主、根表吸附为辅的植物作用途径决定了CDOM大量累积于植物体内、少量附着在植物表面的分布特征。其中,高分子CDOM往往附着在植物细胞壁上,而低分子CDOM能够通过细胞膜进入植物内。
2)植物根系分泌物不能直接作用于CDOM的脱色反应,但可以通过提供生长介质和碳源促进根际微生物生长、改变CDOM形态结构以改善其生物可利用性,以及富集相关降解菌群强化生物降解功能等方式来间接调控CDOM的脱色降解过程。
3)吸附在根系表面的高分子CDOM能作为碳源被根际微生物利用,经降解变成低分子CDOM后可通过根系吸收进入植物体内,并受到植物酶的代谢作用被进一步分解矿化,从而完成植物对CDOM的净化作用。参考文献:
[1] 闫淑霞, 刘春花, 梁岩. 腐殖酸的结构特性与应用研究进展[J]. 天然产物研究与开发, 2017, 29(3): 511-516.
YAN S X, LIU C H, LIANG Y. Review on structural properties and multiple functionalities of humic acids [J]. Natural Product Research and Development, 2017, 29(3): 511-516. (in Chinese)
[2] COBLE P G. Marine optical biogeochemistry:The chemistry of ocean color [J]. ChemInform, 2007, 38(20): 402-418.
[3] ZHOU Y Q, ZHOU L, ZHANG Y L, et al. Autochthonous dissolved organic matter potentially fuels methane ebullition from experimental lakes [J]. Water Research, 2019, 166: 115048.
[4] CLEMENTS W H, BROOKS M L, KASHIAN D R, et al. Changes in dissolved organic material determine exposure of stream benthic communities to UV-B radiation and heavy metals: Implications for climate change [J]. Global Change Biology, 2008, 14(9): 2201-2214.
[5] DU Y X, ZHANG Q Y, LIU Z W, et al. Composition of dissolved organic matter controls interactions with La and Al ions: Implications for phosphorus immobilization in eutrophic lakes [J]. Environmental Pollution, 2019, 248: 36-47.
[6] LIPCZYNSKA-KOCHANY E. Humic substances, their microbial interactions and effects on biological transformations of organic pollutants in water and soil: A review [J]. Chemosphere, 2018, 202: 420-437.
[7] 刘新, 王友权, 徐华成, 等. 富营养化湖泊藻型及草型区微生物群落对有色可溶有机物组成的影响[J]. 生態环境学报, 2017, 26(8): 1403-1409.
LIU X, WANG Y Q, XU H C, et al. Effects of microbial communities on the composition of algae-derived and grass-derived chromophoric dissolved organic matter in eutrophic lake [J]. Ecology and Environmental Sciences, 2017, 26(8): 1403-1409. (in Chinese)
[8] ZHOU Y Q, ZHANG Y L, JEPPESEN E, et al. Inflow rate-driven changes in the composition and dynamics of chromophoric dissolved organic matter in a large drinking water lake [J]. Water Research, 2016, 100: 211-221.
[9] ZHANG X R, MINEAR R A. Formation, adsorption and separation of high molecular weight disinfection by products resulting from chlorination of aquatic humic substances [J]. Water Research, 2006, 40(2): 221-230.
[10] SHI Y, ZHANG L Q, LI Y P, et al. Influence of land use and rainfall on the optical properties of dissolved organic matter in a key drinking water reservoir in China [J]. Science of the Total Environment, 2020, 699: 134301.
[11] CHEN Y L, ARNOLD W A, GRIFFIN C G, et al. Assessment of the chlorine demand and disinfection by product formation potential of surface waters via satellite remote sensing [J]. Water Research, 2019, 165: 115001.
[12] CANO V, VICH D V, ROUSSEAU D P L, et al. Influence of recirculation over COD and N-NH4 removals from landfill leachate by horizontal flow constructed treatment wetland [J]. International Journal of Phytoremediation, 2019, 21(10): 998-1004.
[13] HUANG L F, ZHUO J F, GUO W D, et al. Tracing organic matter removal in polluted coastal waters via floating bed phytoremediation [J]. Marine Pollution Bulletin, 2013, 71(1/2): 74-82.
[14] A D, FUJII D, SODA S, et al. Removal of phenol, bisphenol A, and 4-tert-butylphenol from synthetic landfill leachate by vertical flow constructed wetlands [J]. Science of the Total Environment, 2017, 578: 566-576.
[15] CANELLAS L P, TEIXEIRA JUNIOR L R L, DOBBSS L B, et al. Humic acids crossinteractions with root and organic acids [J]. Annals of Applied Biology, 2008, 153(2): 157-166.
[16] 高参, 杜晓丽, 韩强, 等. 湿地植物芦苇根系分泌物的三维荧光光谱表征分析[J]. 安全与环境学报, 2017, 17(2): 641-644.
GAO C, DU X L, HAN Q, et al. Characterization analysis for Phragmites australis root exudates of wetland plant via three-dimensional excitation emission matrix fluorescence spectroscopy [J]. Journal of Safety and Environment, 2017, 17(2): 641-644. (in Chinese)
[17] NARDI S, PIZZEGHELLO D, MUSCOLO A, et al. Physiological effects of humic substances on higher plants [J]. Soil Biology and Biochemistry, 2002, 34(11): 1527-1536.
[18] 吳林坤, 林向民, 林文雄. 根系分泌物介导下植物土壤微生物互作关系研究进展与展望[J]. 植物生态学报, 2014, 38(3): 298-310.
WU L K, LIN X M, LIN W X. Advances and perspective in research on plant-soil-microbe interactions mediated by root exudates [J]. Chinese Journal of Plant Ecology, 2014, 38(3): 298-310. (in Chinese)
[19] CANELLAS L P, OLIVARES F L, OKOROKOVA-FACANHA A L, et al. Humic acids isolated from earthworm compost enhance root elongation, lateral root emergence, and plasma membrane H+-ATPase activity in maize roots [J]. Plant Physiology, 2002, 130(4): 1951-1957.
[20] ZANDONADI D B, CANELLAS L P, FAANHA A R. Indolacetic and humic acids induce lateral root development through a concerted plasmalemma and tonoplast H+ pumps activation [J]. Planta, 2007, 225(6): 1583-1595.
[21] YANAGI Y, TAMAKI H, OTSUKA H, et al. Comparison of decolorization by microorganisms of humic acids with different 13C NMR properties [J]. Soil Biology and Biochemistry, 2002, 34(5): 729-731.
[22] COLLADO S, OULEGO P, SU REZ-IGLESIAS O, et al. Biodegradation of dissolved humic substances by fungi [J]. Applied Microbiology and Biotechnology, 2018, 102(8): 3497-3511.
[23] 李元鵬, 张柳青, 江威, 等. 千岛湖有色可溶性有机物的生物可利用性特征及其环境指示意义[J]. 光谱学与光谱分析, 2021, 41(3): 858-864.
LI Y P, ZHANG L Q, JIANG W, et al. Variability of the bio-labile fraction of chromophoric dissolved organic matter in Lake Qiandao, a large drinking water reservoir [J]. Spectroscopy and Spectral Analysis, 2021, 41(3): 858-864. (in Chinese)
[24] 吴彩霞, 傅华. 根系分泌物的作用及影响因素[J]. 草业科学, 2009, 26(9): 24-29.
WU C X, FU H. Effects and roles of root exudates [J]. Pratacultural Science, 2009, 26(9): 24-29. (in Chinese)
[25] GRAMSS G, VOIGT K D, KIRSCHE B. Oxidoreductase enzymes liberated by plant roots and their effects on soil humic material [J]. Chemosphere, 1999, 38(7): 1481-1494.
(编辑 黄廷)
