大鳞副泥鳅蛋白中血管紧张素转化酶抑制肽的计算机模拟评估
2022-02-28何泽贺陈笑迎郭明珠刘建朝孙纪录吴小禾
何泽贺,陈笑迎,郭明珠,刘建朝,孙纪录,吴小禾
(1.河北农业大学食品科技学院,河北 保定 071000;2.唐山市水产技术推广站,河北 唐山 063000;3.中山火炬职业技术学院健康产业学院,广东 中山 528436)
生物活性肽一般是包含3个~20个氨基酸的蛋白质片段[1]。通常,生物活性肽存在于母体蛋白结构中,少部分是自然的游离生物活性肽[2]。天然生物活性肽广泛存在于植物、动物和微生物中,如小麦[3]、绿豆[4]、绿茶[5]、鸡蛋[6]、羊肉[7]、鲑鱼[8]和蓝藻[9]等。生物活性肽对人类健康具有积极作用。食源性生物活性肽可分为抗癌肽、抗氧化肽、抗糖尿病肽、抗高血压肽、抗菌肽、降胆固醇肽和多功能肽[10]等。
鱼蛋白是生物活性肽的潜在来源。近年来,使用传统方法,从不同水生物种的蛋白质水解物中提取了生物活性肽[11]。通过酶水解[12]、化学合成[13]或微生物发酵[14],也都可以产生生物活性肽。在传统生产过程中,通常使用超滤、凝胶层析[15]、反相超快速液相色谱(reverse phase-ultra fast liquid chromatography,RP-UFLC)、反相高效液相色谱(reverse phase-high performance liquid chromatography,RP-HPLC)以及超高效液相色谱串联质谱(ultrahigh performance lipid chromatography-tandem mass spectrometry,UPLC-MS/MS)等分离和纯化方法[16]。这些生产、分离、纯化和表征方案既耗时又耗溶剂,因此,越来越多的研究开始应用生物信息学工具,以达到节省时间和资源的目的[17]。由于天然来源的蛋白质中潜在的生物活性肽种类及序列可搜索数据库的增加 [如BIOPEP(http://www.uwm.edu.pl/biochemia/index.php/pl/biopep)、抗菌肽数据库(antimicrobial pepteide database,APD)(http://aps.unmc.edu/AP/main.php)和 Pepbank(http://pepbank.mgh.harvard.edu/)],使用序列信息预测的研究也逐渐增多。已有对鲤鱼[18]、牦牛奶[19]和亚麻籽[20]等蛋白中的生物活性片段进行计算机模拟消化预测的研究。目前,依赖于计算机模拟方法的食源性生物活性肽的研究已成为热点[21]。
大鳞副泥鳅(Paramisgurnus dabryanus)大部分用于鲜食,被人体消化吸收后具有一定的降压作用。市售降压药物目前大多是合成类的血管紧张素转化酶(angiotensin converting enzyme,ACE)抑制剂,长期服用可能会产生一些副作用。因此,现阶段更多的研究是寻找食源性的ACE抑制肽来代替合成药物。本研究针对大鳞副泥鳅的生物学活性,提出了一种替代的、可持续的方法,通过计算机模拟胃肠道内消化大鳞副泥鳅蛋白来分析大鳞副泥鳅蛋白产生ACE抑制肽的潜力。
1 材料与方法
1.1 大鳞副泥鳅中的蛋白质氨基酸序列查找
输入“Paramisgurnus dabryanus”到 UniProtKB 数据库(http://www.uniprot.org/),检索出所有种类大鳞副泥鳅蛋白,并下载各种蛋白质的氨基酸序列[22]。
1.2 蛋白质氨基酸序列比对分析
使用默认设置的ClustalW2多序列比对程序(http://www.ebi.ac.uk/Tools/msa/clustalw2/),消除相似性小于90%的蛋白序列。
1.3 BIOPEP分析
生物活性肽序列获自BIOPEP数据库[23]。应用此数据库预测大鳞副泥鳅蛋白中潜在的ACE抑制肽,并与数据库中已存在的体内外具有ACE抑制活性的肽序列相匹配。此外,将大鳞副泥鳅蛋白质序列导入到BIOPEP数据库可用的“酶促作用”工具中,预测被胃蛋白酶、胰蛋白酶和胰凝乳蛋白酶的作用形式,模拟胃肠消化过程。将从模拟胃肠消化获得的理论肽提交给“寻找活性片段”选项。最后,显示潜在的生物活性肽列表,从中选择具有潜在ACE抑制活性的肽作进一步分析。
潜在生物活性的概况用于定义蛋白质分子中生物活性片段的类型和位置。根据以下公式,计算参数A(定义为蛋白质序列中生物活性片段的出现频率)和参数B(定义为蛋白质的潜在ACE抑制活性)。

式中:a为蛋白质序列中具有特定生物活性的片段数;N为蛋白质氨基酸残基数。
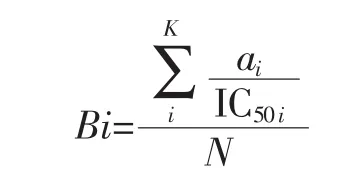
式中:ai为蛋白质序列中第i个ACE抑制肽片段的重复次数;IC50i为第i个ACE抑制肽对应其半数最大活性的浓度,μmol/L;K为具有ACE抑制活性的不同片段的数量;N为蛋白质中氨基酸残基的数量。
1.4 模拟胃肠道消化
在BIOPEP中,用胃蛋白酶(EC 3.4.23.1)来模拟胃消化,用胃蛋白酶、胰蛋白酶(EC 3.4.21.4)和胰凝乳蛋白酶(EC 3.4.21.1)模拟胃肠消化。在水解物中,根据以下公式确定蛋白质序列中由选定的酶释放ACE抑制肽片段的频率(AE)以及潜在ACE抑制活性(BE)。

式中:d为可以被酶释放的具有特定生物活性的蛋白质序列片段的数量;N为蛋白质氨基酸残基数。
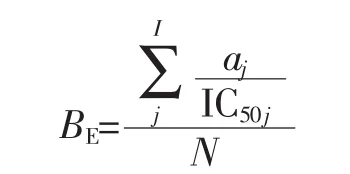
式中:aj为给定的酶从蛋白质序列释放的第j个ACE抑制肽片段的重复次数;IC50j为第j个ACE抑制肽对应其半数最大活性的浓度,μmol/L;I为由给定的酶释放的具有ACE抑制活性的不同片段的数量;N为蛋白质中氨基酸残基的数量。
1.5 大鳞副泥鳅蛋白和计算机模拟水解后释放的肽的理化特性
使用“Peptides”包(2.4版)在R中的应用或者Ex-PASy 的 ProtParam 工具(https://web.expasy.org/protparam/),分析大鳞副泥鳅蛋白经胃肠消化后得到的ACE抑制肽的理化特性,包括氨基酸组成、分子量(MW)、等电点(pI)、Boman指数、净电荷、亲水性的总平均值(grand average of hydropathy,GRAVY)。使用计算机分析产生的ACE抑制肽,使用ToxinPred(http://crdd.osdd.net/raghavaltoxinpred/)预测毒性。
1.6 分子对接
从蛋白质数据库(PCSB protein Data Bank)下载ACE蛋白晶体三维结构文件(PDB ID:1O86)。使用分子模拟软件Discovery Studio(2017)绘制大鳞副泥鳅肽三维结构,进行加氢处理,并通过CHARMM程序将能量降至最低,Zn2+被保留在ACE模型中。DS 2017软件根据自身评分和每个结果的组合自由能,选择最好的匹配结果。
2 结果与分析
2.1 大鳞副泥鳅蛋白中生物活性片段的出现频率及潜在生物活性
运用ClustalW2比对Uniprot数据库中228种大鳞副泥鳅蛋白,将其中氨基酸序列相似性小于90%的42种蛋白的基本信息进行总结,结果见表1。

表1 Uniprot数据库中的42种大鳞副泥鳅蛋白Table 1 42 kinds of loach proteins in Uniport database

续表1 Uniprot数据库中的42种大鳞副泥鳅蛋白Continue table 1 42 kinds of loach proteins in Uniport database
由表1可知,将42种大鳞副泥鳅蛋白分为3组:肉和血液蛋白,头部、尾部、皮和内脏中的蛋白(废料蛋白)以及不特定存在于某一部分的其他蛋白。分析结果显示,大鳞副泥鳅蛋白的分子量范围介于7 171Da~70 624 Da,氨基酸残基数为67个~668个。
蛋白质种类和结构往往影响着生物体的生物活性。使用BIOPEP数据库分析42种大鳞副泥鳅蛋白质的潜在功能活性,结果见图1。
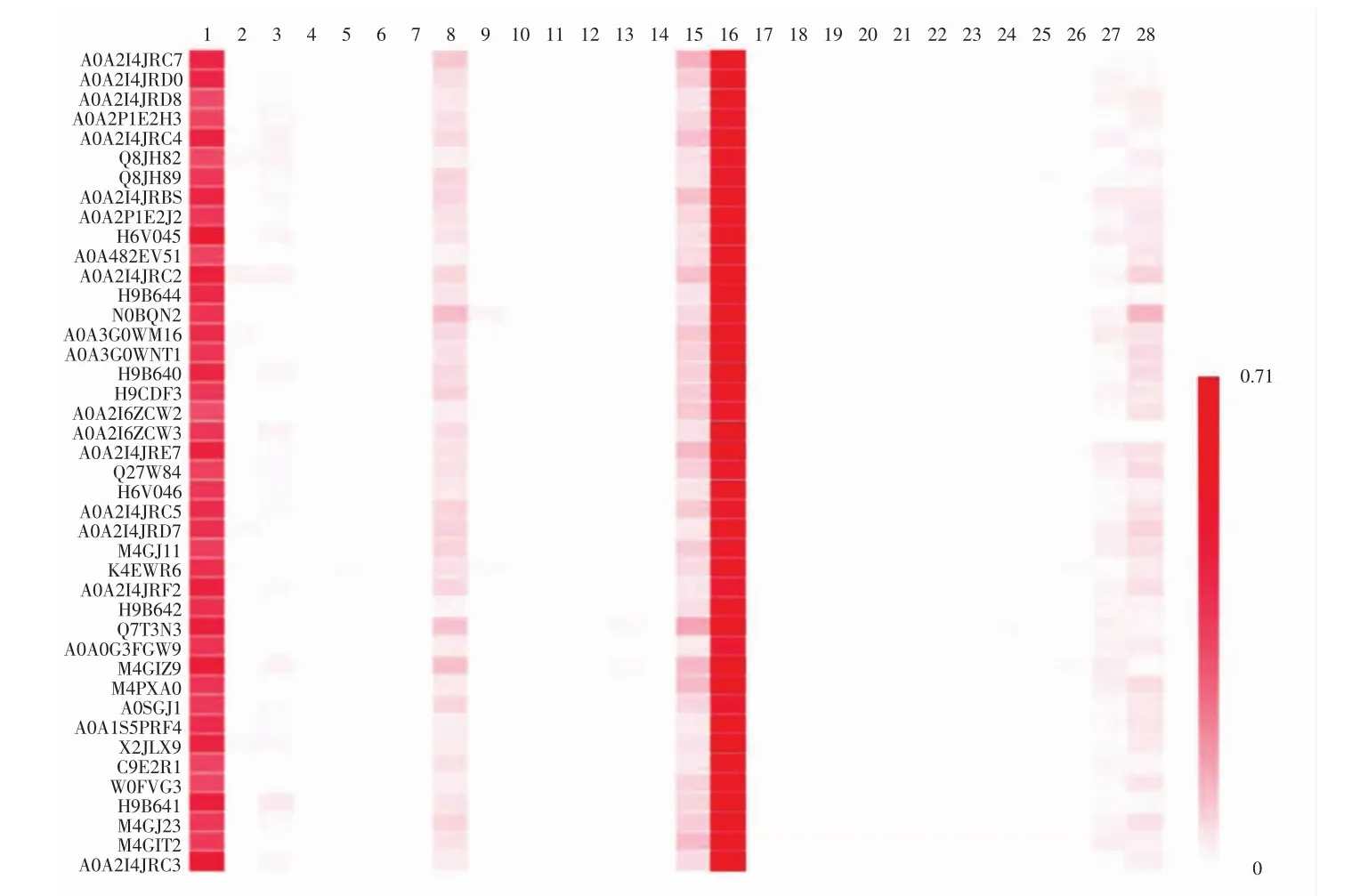
图1 BIOPEP数据库中具有给定活性的大鳞副泥鳅肽的出现频率Fig.1 The frequency of the occurrence of peptides with given activity in loach protein performed by BIOPEP
在BIOPEP生物活性谱中,支持鉴定48种活性片段,如ACE抑制、抗氧化、抗记忆删除、抗血栓形成、免疫调节、抑制二肽基肽酶IV、激活泛素-介导的蛋白水解、细菌渗透酶配体、趋化性、阿片样物质、抗癌、调节离子流、调节胃黏膜活性和磷酸肌醇代谢等。由图1可知,大鳞副泥鳅蛋白与28种生物活性相关,其中二肽基肽酶IV抑制活性最高,ACE抑制活性其次。ACE抑制活性在42种大鳞副泥鳅蛋白中均有存在。此外,通过分析大鳞副泥鳅蛋白中生物活性肽出现频率,发现ACE抑制肽出现频率较高。因此,本研究将ACE抑制活性作为主要活性进行分析。
将42种大鳞副泥鳅蛋白分为3组进行潜在生物活性肽数量以及频率和潜在活性分析,结果见表2。

表2 在大鳞副泥鳅蛋白中鉴定出的潜在生物活性肽数量(a)以及频率(A)和潜在活性(B)(每种蛋白分子)的最小值和最大值Table 2 Maximum and minimum values of potential bioactive peptides numbers identified(a),release frequency(A)and activity(B)in the loach proteins(each protein molecule)
如表2所示,在42种大鳞副泥鳅蛋白中检测到生物活性肽数量最多为942种,最少为99种。肉类和血液蛋白中,尤其是基质金属蛋白酶9,是包括ACE抑制肽在内的生物活性片段的丰富来源。载脂蛋白中所有生物活性片段的出现频率最高,A=1.576 7;ACE抑制肽出现频率最高的是在β-肌动蛋白中,A=0.536 0。在大鳞副泥鳅蛋白中,具有最高潜在ACE抑制活性的蛋白质是 β-防御素,B=0.047 4 μmol/L。
2.2 大鳞副泥鳅蛋白理化性质分析
从42种蛋白质中选择具有最大ACE抑制活性潜力的3种蛋白质。其中,基质金属蛋白酶9蛋白具有最多的ACE抑制活性片段,β-肌动蛋白出现ACE抑制活性片段的频率最高,β-防御素潜在ACE抑制活性最高。3种蛋白的理化性质分析结果见表3。

表3 3种蛋白质的理化性质Table 3 Physicochemical properties of three proteins
由表3可知,β-肌动蛋白和基质金属蛋白酶9是酸性蛋白,β-防御素是碱性蛋白。碱性蛋白β-防御素的GRAVY值为0.842,酸性蛋白β-肌动蛋白和基质金属蛋白酶9的GRAVY值分别为-0.215和-0.454。说明β-肌动蛋白和基质金属蛋白酶9蛋白亲水性更好,而β-防御素是疏水性蛋白。
Boman指数用来评价蛋白质或肽与蛋白质受体的结合潜力。因此,具有高Boman指数的肽和蛋白能够在与一系列胞质蛋白相互作用过程中表现出多功能行为。由表3可知,β-防御素的Boman指数为-0.432,表明与其他蛋白质结合的可能性较低。β-肌动蛋白和基质金属蛋白酶9蛋白的Boman指数分别为1.446和1.596,显示这些蛋白与其他蛋白结合的可能性更高。推测Boman指数与GRAVY值存在一定关联性,即蛋白亲水性越好,Boman指数越大。
2.3 经计算机模拟胃和十二指肠消化后ACE抑制肽释放数量、释放频率和活性
β-防御素、β-肌动蛋白和基质金属蛋白酶9蛋白使用计算机模拟胃和胃肠消化后,将得到的ACE抑制活性指标进行对比,结果见表4。
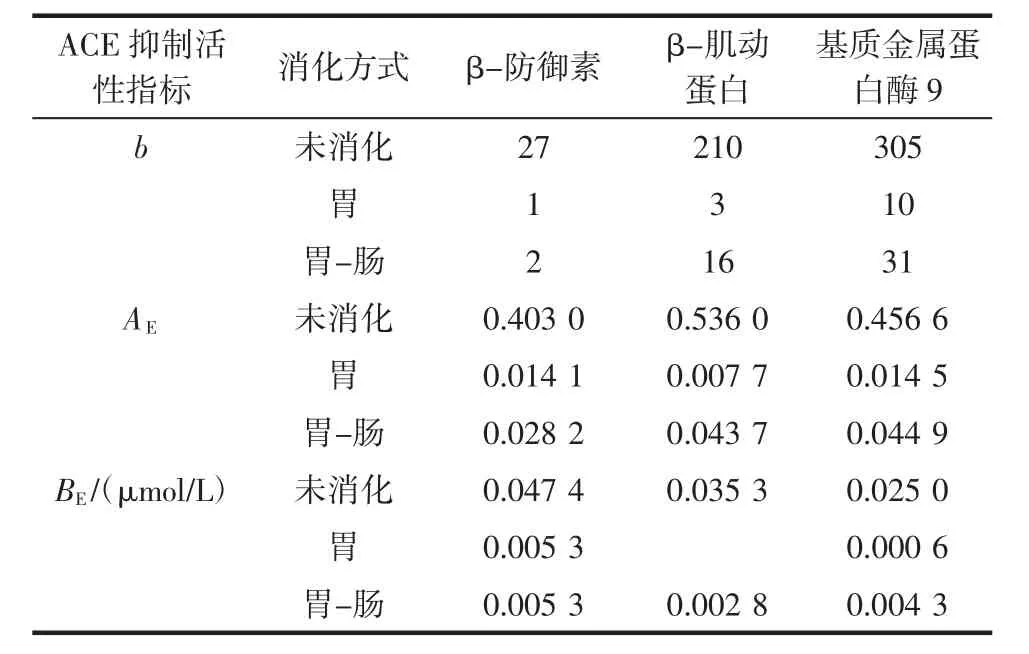
表4 大鳞副泥鳅蛋白经计算机模拟胃和胃肠连续消化后ACE抑制肽释放数量(b)、释放频率(AE)和潜在活性(BE)Table 4 The release amount(b),release frequency(AE)and activity(BE)of ACE inhibitory peptides after gastric and gastrointestinal in silico digestion of loach proteins
由表4可知,β-防御素经胃和胃肠道消化后得到ACE抑制肽的数量为1和2,β-肌动蛋白经胃和胃肠道消化后得到ACE抑制肽的数量为3和16,基质金属蛋白酶9蛋白经胃和胃肠道消化后的ACE抑制肽数量分别为10和31。经胃和胃肠道消化大鳞副泥鳅蛋白产生的ACE抑制肽数量远低于由这3种蛋白可产生的ACE抑制肽数量(β-防御素,β-肌动蛋白,基质金属蛋白酶9蛋白的b值为27、210、305)。大鳞副泥鳅蛋白中β-肌动蛋白的ACE抑制肽释放频率最高AE=0.536 0,经过胃肠道消化的β-肌动蛋白AE为0.043 7,在连续的消化阶段,AE值降低。在胃肠道消化后,释放ACE抑制肽频率最高的是基质金属蛋白酶9蛋白其AE为0.044 9。同时基质金属蛋白酶9生物活性肽出现数量最多,所以将其作为ACE抑制肽来源比β-肌动蛋白丰富(表2,参数A)。推测可能是蛋白质分子的生物学活性分布越丰富(表2,参数a),生物活性肽释放的可能性就越大。
由表4可知,经过胃消化后3种蛋白质的BE值降低。β-肌动蛋白的BE值几乎为0,这意味着β-肌动蛋白在胃消化后几乎不存在ACE抑制活性。胃肠消化后,与胃消化相比,β-防御素的活性几乎没有变化,胃和胃肠消化后BE均降低为0.005 3 μmol/L。基质金属蛋白酶9的BE为0.025 0 μmol/L,胃肠消化后BE值为0.004 3 μmol/L。综上分析,大鳞副泥鳅蛋白经胃肠消化后产生ACE抑制肽,但是未完全释放大鳞副泥鳅蛋白的潜在ACE抑制活性。
2.4 大鳞副泥鳅蛋白中鉴定出的ACE抑制肽的分析
β-防御素、β-肌动蛋白和基质金属蛋白酶9蛋白经胃肠消化后产生ACE抑制肽,将产生的ACE抑制肽进行分析,结果见表5。
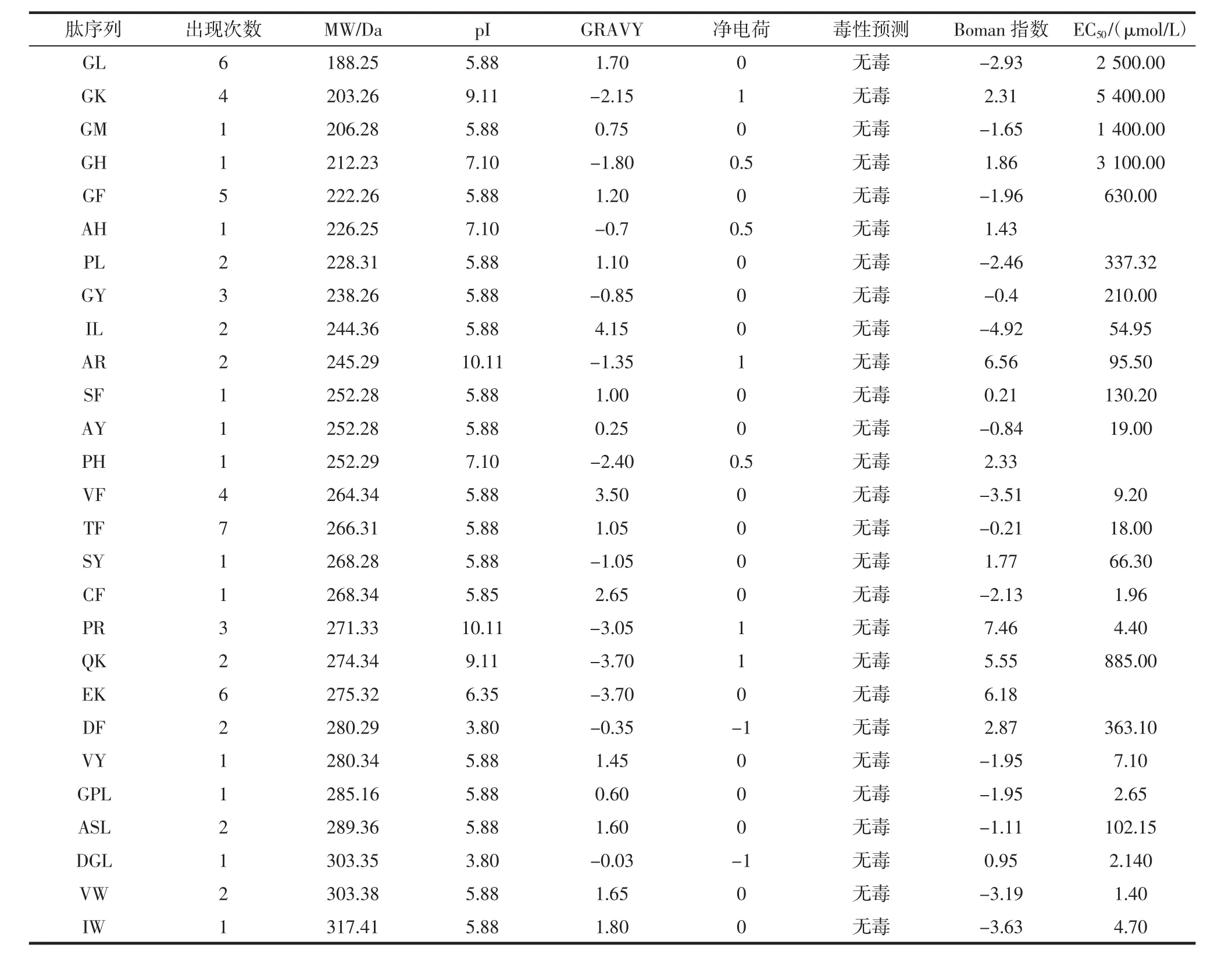
表5 鳞副泥鳅蛋白中鉴定出的ACE抑制肽的序列、EC50、理化性质和毒性预测Table 5 Sequences,EC50,physicochemical property and toxicity prediction of ACE inhibitory peptide identified in loach proteins
由表5可知,大鳞副泥鳅蛋白获得的27种ACE抑制肽均为二肽和三肽,分子量范围188.25 Da~317.41 Da。DF 和 DGL 的 pI≤4.5,净电荷均为-1;其中18种肽的pI在5.5~6.5之间,净电荷为0,3种肽的pI为 7.1,净电荷为 0.5;4 种肽的 pI>9,净电荷为 1。因此,大多数大鳞副泥鳅ACE抑制肽是酸性且带负电荷,而少量为碱性带正电荷。大鳞副泥鳅ACE抑制肽的Boman指数范围为-4.92~7.46。大多数肽的Boman指数<2,有8个肽的Boman指数>2。Boman指数更大的肽更有可能与细胞内的几种蛋白质结合或表现出多种功能。肽的GRAVY范围为-3.70~4.15。本研究获得的27种ACE抑制肽中,12种为疏水值介于-3.70~-0.50的亲水性肽,13种为疏水值介于0.50~2.65的疏水性肽,而疏水性值在-0.50~0.50之间的两亲性肽只有两种。
在27种ACE抑制肽中,大多数肽出现1次~2次,TF出现多达7次。高活性的TF可能是主要的ACE抑制肽。胃肠消化后的β-防御素与胃消化相比仅产生GF,而B值几乎不变,所以GF的产生无法增加酶解蛋白体系的ACE抑制活性。GF的EC50为630 μmol/L,因此,经胃肠消化后的大鳞副泥鳅蛋白产生的GL、GK、GM、GH和GF的EC50值大于或等于630 μmol/L,无法增加总体ACE抑制肽的活性。具有较高EC50值的ACE抑制肽的分子量高于222,所以,并不是分子量越低,ACE抑制肽的活性越高。同时,将蛋白与胃肠消化后蛋白的ACE抑制活性相比,虽然胃肠消化释放一部分ACE抑制活性,但是并没有充分利用大鳞副泥鳅蛋白中潜在的ACE抑制活性。
毒性预测由ToxinPred进行,该软件使用基于二肽组成和基序扫描的混合模型来预测肽的毒性或识别蛋白质中的毒性区域。在本研究中,从大鳞副泥鳅蛋白释放的ACE抑制肽均没有潜在的毒性,表明它们适合进一步开发并用于食品和药品。
2.5 大鳞副泥鳅ACE抑制肽与ACE的分子对接
大鳞副泥鳅蛋白经计算机模拟水解后,选取其中的三肽DGL和GPL进行分子模拟和分子对接,结果见图2。
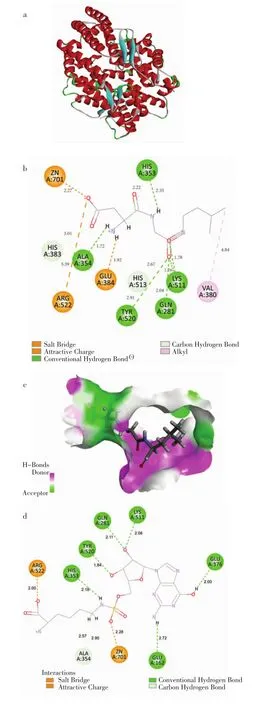
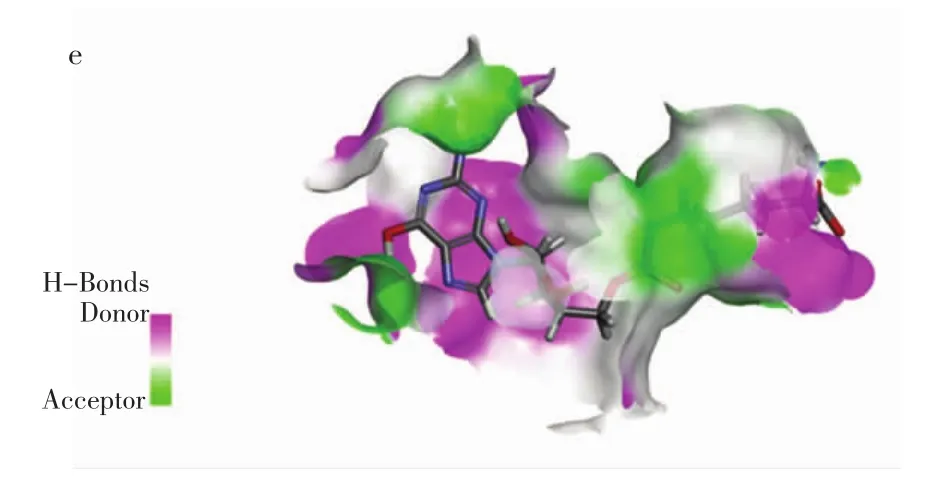
图2 ACE-肽分子对接相互作用Fig.2 Molecular docking between peptides and ACE
分子对接是基于配体和受体的“锁-钥原理”,模拟了小分子配体与受体生物大分子之间的相互作用,从分子角度阐述GPL与DGL和ACE的作用机制。ACE是一种依赖Zn2+的羧基二肽酶,其中Zn2+是ACE活性中心的重要组成部分。ACE活性中心有S1、S2、S33个必需结合位点,S1为 Ala354、Glu384 和Tyr523,S2为 Gln281、His353、Lys511、His513 和 Tyr520,S3为Glu162。选择三肽ASL、DGL、GPL中ASL的作用位点S1和S2[24],将DGL和GPL分别进行分子对接。
由图2b可知,在DGL-ACE复合物中,DGL与ACE 的氨基酸残基 Gln281(2.04 Å)、His353(2.35 Å)、Ala354(1.72 Å)、Lys511(1.76 Å/1.78 Å)和 Tyr520(2.91 Å)形成了6个距离不同的氢键,与Ala354之间的氢键最短,结合最紧密;与 His353(2.22 Å)、His383(3.01 Å)和His513(2.67 Å)形成了3个距离不同的碳氢键。DGL与氨基酸残基Glu384(1.92 Å)形成盐桥,DGL中的C原子与Val380(4.84 Å)形成烷基键,DGL中的O原子与 Arg522(5.59 Å)和 Zn701(2.27 Å)间形成静电相互作用。其中DGL和ACE活性位点S1中Ala354形成氢键;活性位点 S2中的 Gln281、His353、Lys511、Tyr520形成氢键与His513形成碳氢键。ACE的活性中心含有Zn2+的活性口袋,DGL和活性位点中的残基发生作用,且与Zn2+有较强的结合能力,占据ACE的活性中心,使其活性降低。
由图2d可知,GPL与ACE的氨基酸残基Glu162(2.72 Å)、Gln281 (2.11 Å)、His353 (2.18 Å)、Glu376(2.00 Å)、Lys511(2.08 Å)和 Tyr520(1.84 Å)之间形成了6个距离不同的氢键,其中GPL和氨基酸残基Tyr520之间的氢键最短,结合最紧密;GPL与Ala354形成了距离为 2.57 Å 和 2.90 Å 的两个碳氢键,与Zn701(2.28 Å)形成金属受体相互作用,与Arg522(2.00 Å)形成盐桥。其中GPL和ACE活性位点S1中Ala354形成碳氢键;活性位点 S2中的 Gln281、His353、Lys511、Tyr520 形成氢键;活性位点S3Glu162形成氢键。但是,DGL可以与Zn2+形成离子键,直接导致ACE分子失活。
3 结论
本研究初步筛选出大鳞副泥鳅蛋白中的潜在ACE抑制肽;发现ACE抑制活性是大鳞副泥鳅蛋白的主要生物活性,同时具有较高的ACE抑制肽产生频率。基质金属蛋白酶9蛋白、β-肌动蛋白和β-防御素蛋白经胃和胃肠消化后可得到27种ACE抑制肽,其中,DGL 和 GPL 与 ACE 活性位点 S1、S2、S3结合。但是,大鳞副泥鳅蛋白经胃肠消化后ACE抑制肽产生数量、频率和潜在活性均降低。这些结果为在食品工业中开发大鳞副泥鳅蛋白作为ACE抑制肽的前体提供了理论基础。