功能性和普通蛹虫草的差异代谢物对比分析
2022-02-28李梦雪王升厚柳叶飞王泽赵洪新赵晓云徐方旭
李梦雪,王升厚,柳叶飞,王泽,赵洪新,赵晓云,徐方旭*
(1.沈阳师范大学生命科学学院,辽宁 沈阳 110034;2.沈阳师范大学实验教学中心,辽宁 沈阳 110034;3.浙江理工大学生命科学与医药学院,浙江 杭州 310018;4.沈阳药科大学生命科学与生物制药学院,辽宁 沈阳 110016)
蛹虫草(Cordyceps militaris)隶属于子囊菌亚门的肉座菌目、麦角菌科、虫草属,又名北虫草、北冬虫夏草,与冬虫夏草(Cordyceps sineisis)为同属异种[1-3],是虫草属的模式种之一[4],研究表明其营养成分丰富,不仅具有食用价值,同时具有保健价值和药用价值[5-7]。功能性蛹虫草是以成分指标作为蛹虫草质量标准的评价体系,因此在人工栽培功能性蛹虫草的过程中与普通蛹虫草的区别主要在于有目的地改变培养基的配方,添加一些独特的营养元素和营养物质等,以提高所得到的蛹虫草的虫草素、腺苷、喷司他丁、虫草酸、虫草多糖等多种活性成分[8-9]。使其不仅具有普通蛹虫草的延缓衰老、抗肿瘤、抗氧化、抗病毒、免疫调节、降血糖血脂、保护神经、肝脏等多种生物功效[10-12],还有很高的抗菌、抗病毒以及抗辐射等多种作用。目前的技术水平完全可以工厂化人工培养功能性蛹虫草[13-16]。
然而,功能性蛹虫草在培养基中所添加的独特的营养元素和营养物质等是否能引起其子实体的成分发生改变,从而使其品质优于普通小麦蛹虫草,尚无理论依据。由于代谢组学能研究生物体内源性代谢物质的种类、数量及其在内外因素影响下的变化规律,进而从整体上探讨生命活动在代谢物层面发生的特征和规律,是目前发现潜在活性成分的最佳方法之一[17-21]。因此,本试验采用液相色谱-质谱联用法(liquid chromatography-mass spectrometry,LC-MS)对功能性蛹虫草[22-24]和普通小麦蛹虫草的代谢组学进行分析,对二者的化学成分特征进行全面比较,以期从整体代谢物层面分析二者的相似性和差异性。为功能性蛹虫草相比于普通小麦蛹虫草的成分优势提供理论依据,为功能性蛹虫草的深入开发应用提供科学支撑。
1 材料与方法
1.1 材料与试剂
功能性蛹虫草(检测号:PA)(试验组:小麦500g+清水650 g+鲜蛹浆30 g+黄豆粉10 g+硒元素46 mg/kg)、普通小麦蛹虫草(检测号:PB)(对照组:小麦500 g+清水650 g):沈阳师范大学特种菌业研究所栽培,蛹虫草菌种均为YT-7。
甲醇、乙腈、甲酸(色谱级):德国CNW科技公司;L-2-氯苯丙氨酸(≥98%):上海恒柏生物科技有限公司。
1.2 仪器与设备
Nexera UHPLC LC-30A超高效液相色谱仪:日本岛津公司;Triple TOF 5600高分辨质谱仪:美国应用生物系统公司;Heraeus Fresco17离心机:赛默飞世尔科技有限公司;JXFSTPRP-24研磨仪:上海净信科技有限公司;PS-60AL超声仪:深圳市雷德邦电子有限公司;AcQ2uity UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm):美国沃特世科技有限公司;5424R冷冻离心机:德国艾本德股份公司。
1.3 方法
1.3.1 代谢物质提取
称取100 mg功能性蛹虫草粉末(55℃烘干2 h,磨粉,过 100目铜筛),加入 1 000 μL提取液(甲醇∶水=4∶1,体积比),涡旋 30 s冰水浴 50 Hz超声处理 1 h,-20℃静置1 h后将样本置于冷冻离心机中4℃条件下12 000 r/min离心15 min,取出上清液过0.22 μm滤膜,置于进样瓶中待上机检测。对照组处理同上。
1.3.2 上机检测
超高效液相色谱流动相条件见表1。

表1 超高效液相色谱流动相条件Table 1 Mobile phase condition of UPLC
根据表1中的超高效液相色谱(ultra performance liquid chromatography,UPLC)流动相参数进行分析,流动相A∶水(0.1%甲酸)、流动相B∶乙腈(0.1%甲酸),进样体积为5 μL。质谱仪在Analyst TF 1.7,AB Sciex软件控制下基于交互式反汇编器专业版(interactive dis assembler professional,IDA)功能进行一级、二级质谱数据采集。在每个数据采集循环中,筛选出强度最强且大于100的分子离子进行采集对应的二级质谱数据。测试条件为轰击能量40 eV,碰撞能差20 V,每50 ms 15张二级谱图。ESI离子源参数设置为雾化气压55 psi(1 psi=6 895 Pa),辅助气压55 psi,气帘气压35 psi,温度550℃,喷雾电压5 500 V(正离子模式)或-4 000 V(负离子模式)[25-26]。
1.3.3 检测分析
对总离子流色谱、主成分、正交偏最小二乘法-判别及其置换检验进行分析,筛选显著差异代谢物,做显著差异代谢物的聚类分析,寻找其代谢通路。
1.4 数据处理
采用Progenesis Q2I软件将质谱原始数据导入,进行保留时间矫正、峰识别、峰提取、峰积分、峰对齐等工作,同时查询复方中相应中药代谢库(委托方:上海阿趣生物科技有限公司),利用委托方自建的二级质谱数据库及相应裂解规律匹配法对含有串联质谱数据的峰进行物质鉴定。
2 结果与分析
2.1 总离子流色谱分析
总离子流色谱见图1。

图1 总离子流色谱图Fig.1 Total ions chromatogram
由图1可知,样品色谱峰保留时间和信号强度重叠较好,说明仪器稳定性很好,在整个试验过程中仪器误差引起的变异较小,可以排除一部分系统误差。
2.2 主成分分析结果
主成分分析(principal component analysis,PCA)得分图结果见图2。
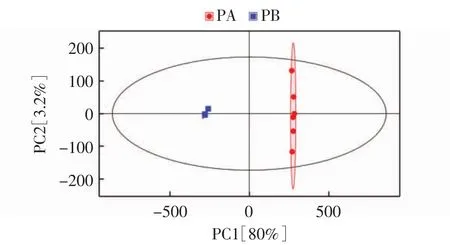
图2 PCA得分图Fig.2 PCA score plots
由图2可知,样本全部处于95%置信区间内,功能性蛹虫草和普通小麦蛹虫草的数据点在PCA得分散点图中被显著区分。理论上讲,样品都是相同的,但是在物质提取、检测分析过程中会有误差,导致重复样品间会有差异。这个差异越小说明整个方法稳定性越好数据质量越高。由图2可知,功能性蛹虫草和普通小麦蛹虫草的6次生物学重复数据集中性很强,证明数据的重现性和可信度较强。
2.3 正交偏最小二乘法-判别分析结果
正交偏最小二乘法-判别分析(orthogonal projections to latent structures-discriminant analysis,OPLS-DA)结果见图3。

图3 OPLS-DA得分图Fig.3 OPLS-DA score plots
通过OPLS-DA分析,可以排除代谢物中与分类变量不相关的正交变量,并对非正交变量和正交变量分别分析,从而获取更加可靠的代谢物的组间差异与试验组的相关程度信息。如图3所示,普通蛹虫草样本代谢物主要分布在右侧,功能小麦蛹虫草样本代谢物主要分布在置信区的左侧,两种样本区分明显,OPLS-DA模型能够进一步佐证PCA模型的结果,增强结果的真实性。
2.4 OPLS-DA置换检验结果
OPLS-DA置换检验结果见图4。
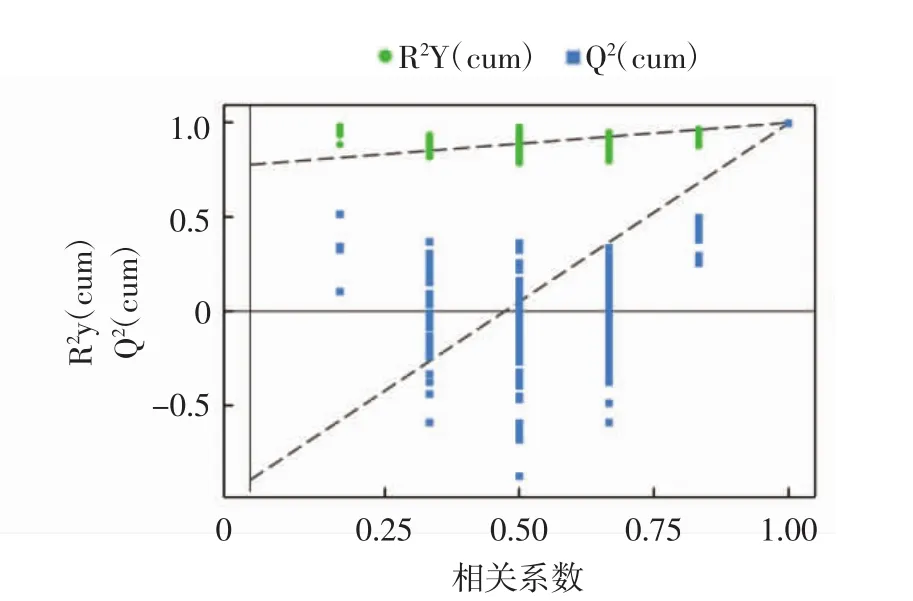
图4 OPLS-DA置换检验结果图Fig.4 OPLS-DA replacement test results
由图4可知,原模型R2Y非常接近1,说明建立的模型符合样本数据的真实情况;原模型Q非常接近1,说明如果有新样本加入模型,会得到近似的分布情况,总体来看原模型可以很好地解释两组样本之间的差异。置换检验随机模型的Q值均小于原模型的Q值;Q的回归线与纵轴的截距小于零;同时随着置换保留度逐渐降低,置换的Y变量比例增大,随机模型的Q逐渐下降。说明原模型具有良好的稳定性,不存在过拟合现象。
2.5 显著差异代谢物的筛选
显著差异代谢物的筛选结果见表2。

表2 差异代谢物筛选Table 2 Differential metabolites screening
采用多维分析和单维分析相结合的方法对试验数据进行统计和分析。根据OPLS-DA生成的变量投影重要度(variable importance in the projection,VIP)值来筛选组间差异代谢物。筛选条件为P<0.05、VIP≥1。VIP值越大,说明差异代谢物对样品间的分类判别的影响强度和解释能力越强。如表2所示,功能性蛹虫草显著差异代谢物共有8个。分别是腺苷、α-亚麻烯基乙醇酰胺、L-组氨酸、(-) 核黄素、9-氧代-10E,12Z十八碳二烯酸、9,10-二羟基-12Z-十八烯酸和 1,2-苯二甲酸二(2-甲基丙基)酯、1-十六烷基-2-锡-甘油-3-磷酸。除1-十六烷基-2-锡-甘油-3-磷酸分类未知以外,其它7种显著差异代谢物分别属于嘌呤核苷类、有机含氮化合物、羧酸和衍生物、蝶啶和衍生物、脂肪酰、苯和取代衍生物。
2.6 显著差异代谢物的聚类分析
选用R(v3.3.2)对数据进行缩放,得到聚类热图对33种差异代谢物在两种蛹虫草样本中的分布状况进行分析,结果见图5。
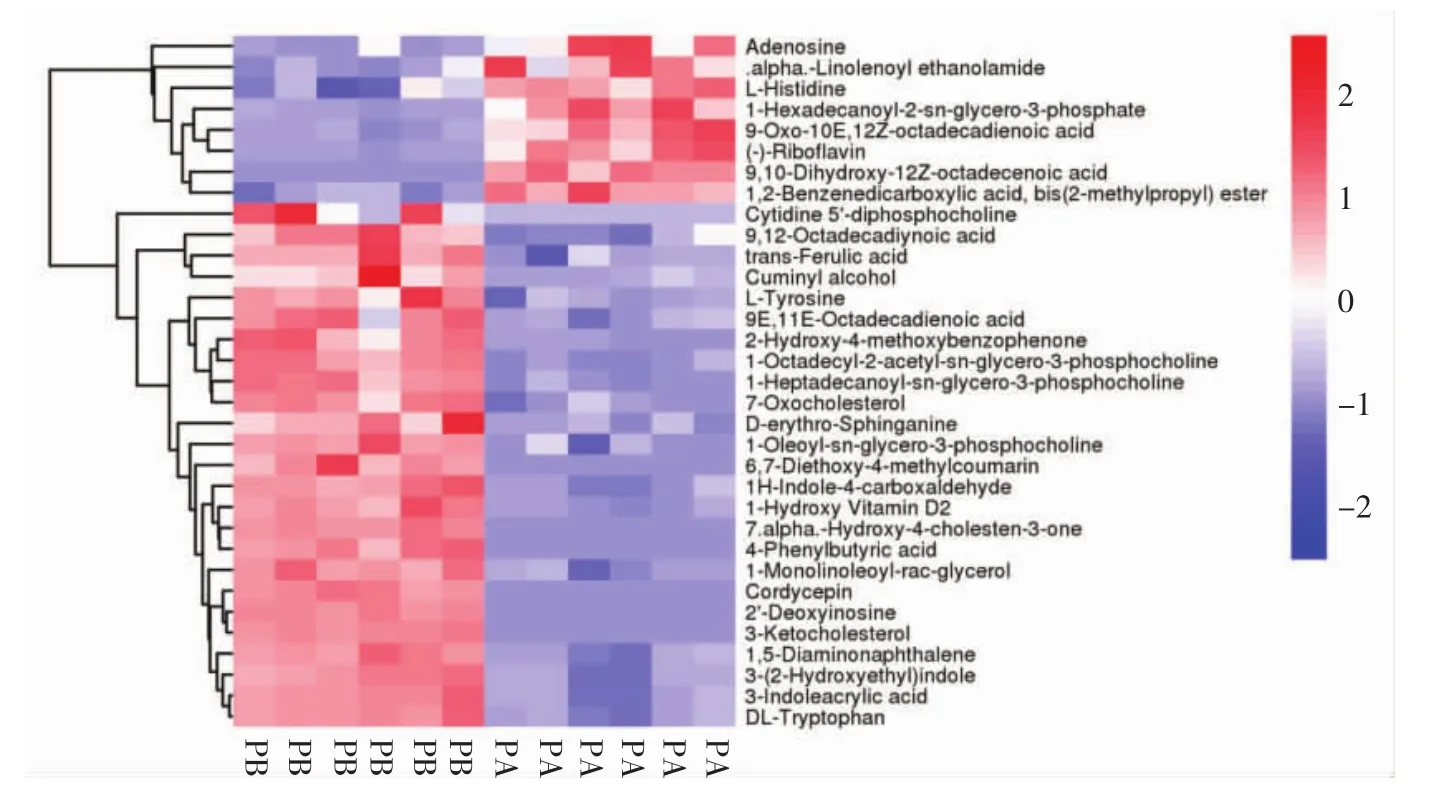
图5 显著差异代谢物的热图分析Fig.5 Heat map analysis of differential metabolites
通过以上分析得到的差异代谢物,在生物学上往往具有结果和功能相似性/互补性,或者受同一代谢通路的正调控/负调控,表现为在不同试验组间具有相似或相反的表达特征。对这类特征进行层次聚类分析,有助于将具有相同特征的代谢物归为一类,并发现代谢物在试验组间的变化特征。由图5可知,功能性蛹虫草和普通小麦蛹虫草对比的差异代谢物,其代谢物的相对表达量不同。
2.7 显著差异代谢物的代谢通路
蛹虫草的部分差异代谢途径分析见表3。

表3 部分差异代谢产物途径Table 3 Partial differential metabolite pathways
差异代谢物途径分析以KEGG数据库为基础,有助于了解代谢物所涉及的信号转导和代谢途径,进而探索相关代谢物和基因[27-28]。然而部分差异代谢物代谢途径在KEGG数据库中无法找到,因此,表3为部分差异代谢产物途径。在功能性蛹虫草和普通小麦蛹虫草中获得的16种差异代谢物参与了多种途径,如组氨酸代谢、精氨酸生物合成、酪氨酸代谢、乙醛酸与二羧酸代谢、苯丙酸生物合成、丙酮酸代谢、己内酰胺降解、异喹啉生物碱生物合成、二甲苯降解、甘氨酸,丝氨酸和苏氨酸代谢等。
3 讨论
本论文选用液相色谱-质谱联用技术(LC-MS)和多元统计分析法,分析对比同一菌种在同一环境条件下,仅在培养基中添加了特殊的元素和营养物质的功能性蛹虫草和普通小麦蛹虫草的差异代谢产物,希望为功能性蛹虫草的开发和利用提供有力的参考[29]。为了提高普通蛹虫草作为保健食品的品质而研发的功能性蛹虫草,影响其品质的化学成分和含量是人们关注的重点,也是开发功能性蛹虫草的意义所在[30-31]。本试验采用的液相色谱-质谱联用技术可以普遍应用于药物的成分分析、代谢产物分析研究等,从代谢差异物的种类、数量等方面对试验对象进行对比,发现二者存在明显的代谢差异。这些差异代谢物产生的原因很可能是由于功能性蛹虫草在栽培过程中所添加的特殊的元素和营养物质,这也是本试验探究的目的所在。对于保健食品而言,成分决定功能,蛹虫草要想发挥保健价值,依赖于其子实体内含有的发挥作用的物质。本研究是在代谢产物的层面初步对功能性蛹虫草和普通小麦蛹虫草的成分进行比对,发现其含有丰富的特殊性代谢产物。然而,这些成分和代谢物的差异是否会直接导致虫草间保健价值的不同,目前还没有直接证据。但其中一些功效成分的如腺苷、核黄素、组氨酸等,其含量的增加应当对蛹虫草的品质有所提升。由于试验材料的差异仅在于培养基中添加的鲜蛹浆、黄豆粉和硒元素,那么两者的差异代谢物来源就很可能是这些特殊添加物导致的。其中鲜蛹浆可以为功能性蛹虫草提供普通小麦草所不具备的动物蛋白,富含脂肪酸、α-亚麻酸、氨基酸等;黄豆粉作为优质的植物蛋白,富含蛋白质、脂肪及核黄素等;硒元素是动物体内必需而人体内无法合成的营养元素,它的添加对于增加蛹虫草的保健功能具有重要意义。可见,功能性蛹虫草所具有的差异代谢物有一部分确实是添加物所富含的,而这些也是普通小麦蛹虫草培养基中所不具备的。
4 结论
在经过检测分析后发现功能性蛹虫草较普通小麦蛹虫草而言有69种差异代谢物,其中显著差异代谢物有8种,部分代谢产物参与的途径对于维持人体健康有着重要意义,充分体现出功能性蛹虫草对于普通小麦蛹虫草而言的成分优越性。此外,两种蛹虫草的差异是否源于在栽培过程中添加的特殊物质,还需进一步研究。本试验的结果为功能性蛹虫草的进一步研究与开发提供了方向和有力的支持。