咸蛋真空腌制过程中蛋清的理化性质变化
2022-02-28陈艺郑萍刘会平张晓维高忠东
陈艺,郑萍,刘会平*,张晓维,高忠东
(1.天津科技大学食品科学与工程学院,天津 300457;2.山西农业大学功能食品研究院,山西 晋中 030801)
咸蛋作为我国最为出名的传统再制蛋,营养丰富、风味独特、保质期长[1]。腌制咸蛋一般采用新鲜鸭蛋,鸭蛋蛋黄的脂肪含量高于其他禽蛋,容易使蛋黄出油,经过熟化后会变得松沙[2]。早在600多年以前,已有关于制作和食用咸蛋的记录[3]。高邮地区盛产的双黄咸鸭蛋早在清朝末年好评如潮、声名远扬[4]。
将新鲜鸭蛋腌制成为成熟咸蛋的过程,本质是NaCl的渗透使得蛋黄蛋清发生一系列的变化,如含水量降低,碳水化合物、矿物质和微量元素增加,蛋白质和脂肪含量基本不变,维生素E含量升高等[5]。鲜鸭蛋的蛋清是一种以水作为分散介质,以蛋白质作为分散相的胶体物质。蛋清中主要化学成分包括水分、蛋白质、灰分、碳水化合物和脂肪[6]。水分是蛋白清中的主要成分,其主要是作为分散介质存在,只有少部分水会和蛋白结合存在,蛋清分为浓厚蛋白和稀薄蛋白。浓厚蛋白含水量约为84%,稀薄蛋白中含水量约为89%。蛋清中蛋白质的含量为11%~13%,经过蛋白质组分分析,目前已经发现100多种蛋白,如卵白蛋白、卵转铁蛋白、卵类黏蛋白、溶菌酶、卵黏蛋白、卵糖蛋白、黄素蛋白、卵巨球蛋白、卵球蛋白G2、卵球蛋白G3、抗生物素蛋白以及无花果蛋白酶抑制剂等,但每种蛋白含量非常不均衡,其中卵清蛋白、卵转铁蛋白、卵类黏蛋白、溶菌酶、卵黏蛋白和卵糖蛋白这6种蛋白的含量达到了总蛋白量的86%[7]。碳水化合物在蛋白清中含量较少,主要是结合态和游离态的两种状态,结合态是与蛋白质结合,含量约为0.5%。蛋清中含有极少量的脂质约为0.02%,无机成分主要为钾、钠、镁和钙等。蛋清中还存在很多酶类,有蛋白分解酶、淀粉酶和溶菌酶等[8]。
在腌制的过程中,蛋白清会变稀,即鸭蛋的浓厚蛋白的凝胶状态,逐渐变成一层很薄的液体,并且黏度降低[9]。在储存过程中,蛋清稀化主要与储藏温度和储藏时间有关,在某种程度上也受pH值的影响[10]。卵黏蛋白存在于蛋清中,占蛋清总蛋白的1.5%~3.0%,是一种随机螺旋结构,高度聚合的长线大分子,有可溶性和不溶性两种状态,不溶性卵黏蛋白只存在于浓厚蛋白中,对维持浓厚蛋白凝胶状结构和高度黏性起到主要的作用。在浓厚蛋白凝胶结构中,卵黏蛋白和溶菌酶相互作用是形成其结构的基础。所以浓厚蛋清的稀化,可能与卵黏蛋白和溶菌酶的相互作用有关。有研究显示,在蛋清稀化环节,发生的变化包括3类:卵黏蛋白凝胶结构的恶化、卵黏蛋白巯基组的变化和卵黏蛋白与溶菌酶间相互作用。蛋清中存在大量的巯基成分,蛋清的稀变也与巯基组的变化有关[11]。目前,对于蛋清的稀化,主要关注点为储藏过程中的稀化,而对于咸蛋腌制过程中稀化发生的原因以及稀化过程中蛋白的理化性质变化研究甚少。
本研究对真空减压常温下腌制咸蛋过程中浓厚蛋白与稀薄蛋白的理化性质进行对比,测定蛋清指数的变化、蛋清中水分的相态变化、表面疏水性和巯基含量、蛋白的总量与种类和蛋白的微观形态等。通过测定这些指标,总结得出咸蛋在真空减压常温腌制过程中浓厚蛋白与稀薄蛋白发生的变化。
1 材料与方法
1.1 材料与试剂
鸭蛋:市售。8-苯胺-1-萘磺酸、甘氨酸、2,4-二硝基苯肼、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、彩虹光谱蛋白marker:北京索莱宝科技有限公司;溴化钾、硫酸、甲基红、溴甲酚绿:天津市化学试剂一厂;所有试剂均为分析纯。
1.2 仪器与设备
真空减压智能腌制设备:天津科技大学自制;漩涡混合器(QL-866):上海博迅医疗器械厂;荧光分光光度计(RF-5301PC):日本岛津仪器有限公司;全自动凯氏定氮仪(Kjeltec 8400):丹麦福斯有限公司;傅立叶红外光谱仪(Fourier transform infrared spectrometer,FT-IR)(IS-50):美国尼高利仪器公司。
1.3 方法
1.3.1 咸蛋的真空减压腌制
挑选新鲜、大小、且形态接近的鸭蛋作为原料,剔除破损、裂纹、散黄、钢壳等劣蛋,用凉开水洗净晾干待用。将煮沸的饱和食盐水冷却至室温(25℃)后制备料液,将鸭蛋完全浸入其中,用海棉压住后封上保鲜膜。设置真空减压智能腌制装置的真空度为-0.01 MPa,放入密封好的鸭蛋,进行腌制。
1.3.2 蛋清指数(WI)
在腌制鸭蛋的过程中,隔天取3枚鸭蛋,将其蛋黄与蛋清分离,去除蛋黄,将蛋内容物倒入1 mm×1 mm的40目标准检验筛,静置处理后,过滤出稀薄水样蛋清,即为稀薄蛋白,所剩蛋白清即为浓蛋清厚蛋白[12]。分别称取浓厚蛋白的质量与稀薄蛋白的质量。蛋清指数计算公式如下。

1.3.3 蛋清中水分的相态变化
采用核磁共振分析与成像系统[线圈直径60 mm,磁场强度(0.52±0.05)T]分析新鲜蛋清、真空减压法腌制成熟时的浓厚蛋白与稀薄蛋白的水分的相态变化。
在样品扫描前,首先将标准油样放入磁体箱中,然后将蛋清样品放入磁体箱中,在核磁共振分析应用软件中设置:接受死机时间为20 μs,硬脉冲90度脉宽(P1)为 5.00 μs,硬脉冲 180 度脉宽(P2)为 10.48 μs,重复采样等待时间为4 500 ms,信号采样点数为900 200,回波个数为9 000,重复采样次数为2,接受机带宽为22 MHz,点击确定按钮采集脉冲信号。将所得蛋清样品的扫描数据,使用Origin 9.0软件,制成横向弛豫时间T2图谱。
1.3.4 蛋清表面疏水性的测定
在真空减压常温腌制鸭蛋的过程中,隔天取3枚鸭蛋,分析其浓蛋白与稀蛋白浓厚蛋白与稀薄蛋白在腌制过程中表面疏水性的变化。使用8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)作为荧光探针[13-14],将浓蛋白与稀蛋白浓厚蛋白与稀薄蛋白分别溶于0.1 mol/L磷酸盐缓冲液(pH 6.8),浓度稀释在0~0.50 mg/mL 之间,取 0.1、0.2、0.3、0.4 、0.5 mg/mL 5个浓度梯度,分别加入20 μL的8 mmol/L ANS甲醇溶液,使用涡旋器将其混合均匀,在黑暗处静置15 min,之后离心取上清液。荧光强度使用荧光分光光度计,在380 nm处激发,在470 nm处测量,狭缝宽度为10 nm。然后取荧光强度的平均值对蛋白浓度作曲线,曲线初始阶段斜率即为蛋白分子的表面疏水性指数。
1.3.5 蛋清巯基含量测定
在真空减压常温腌制鸭蛋的过程中,隔天取3枚鸭蛋,分别取3 g浓厚蛋白与3 g稀薄蛋白,然后加入27 mL磷酸盐缓冲液,经均质和离心(10 000 r/min,15 min)除去不溶性蛋白。
蛋清中的自由巯基含量的测定:取0.2 mL上清液加入2.8 mL的Tris-甘氨酸缓冲液[0.1 mol/L Tris,0.1 mol/L甘氨酸,0.4 mmol/L乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA),pH 8],然后再加入0.02 mL 5,5'-二硫代双-(2-硝基苯甲酸)[5,5'-dithiobis-(2-nitrobenzoic acid),DTNB],空白中含有 2.8 mL Tris-甘氨酸和0.02 mL DTNB试剂,混合物在40℃水浴反应15 min,使用紫外分光光度计分别在412 nm测量吸光度[15]。
蛋清中的总巯基含量的测定:取0.2 mL上清液放入离心管中,加入2.8 mL混合试剂(pH 8.0,0.1 mol/L Tris,0.1 mol/L 甘氨酸,0.4 mmol/L EDTA,0.5%SDS,8 mol/L尿素),加入0.02 mL DTNB试剂混匀,室温反应30 min后,使用紫外分光光度计在412 nm处测定吸光度。巯基的含量计算公式如下。
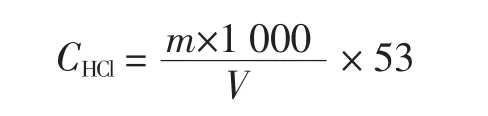
式中:m为无水碳酸钠质量,g;V为滴定时所消耗盐酸的体积,mL;CHCl为盐酸的浓度,mol/L。
在消化管中分别加入3 g咸鸭蛋稀蛋白和咸鸭蛋浓蛋白浓厚蛋白与稀薄蛋白,做3组平行。在消化管内放入2片消化片,加入12 mL浓硫酸,轻轻地摇动,浸湿内部的样品。80 mL蒸馏水稀释冷却的消化液,在接收瓶内加入25 mL~30 mL的硼酸接收液,再加入50 mL的40%NaOH到消化液中。最后用标定好浓度的HCl滴定消化液,当硼酸溶液变为浅粉红色时,停止滴定,记录咸鸭蛋组消耗的盐酸体积。同时按上述操作做空白试验,加入硼酸接收液和40%NaOH后用盐酸滴定,记录空白组消耗的盐酸体积。计算公式如下。
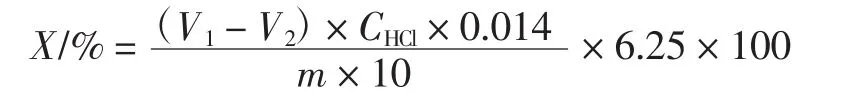

式中:C为样品浓度,mg/mL;D为稀释因子,蛋清为6.04;A412为混合物在412 nm处的吸光度。
1.3.6 蛋清总蛋白含量的测定
利用凯氏定氮法测定样品中的总氮含量,通过转化因子6.25计算样品蛋清的总蛋白质含量。分析天平上准确称取在270℃~300℃干燥至恒重的基准物无水碳酸钠0.15 g,于锥形瓶(250 mL)中加入50 mL水溶解摇匀,再加入甲基红溴甲酚绿混合指示剂10滴,用HCl溶液滴定至溶液由绿色变成红色,之后加热煮沸2 min,冷却后继续滴定至溶液呈红色,即为终点,记下消耗HCl的体积,从而计算标定的HCl的浓度,同时做空白试验平行测定3份,取平均值。计算公式如下。
式中:X为样品中蛋白质的含量,g%;V1为咸鸭蛋组滴定时所消耗盐酸的体积,mL;V2为空白组滴定所消耗盐酸的体积,mL;CHCl为盐酸的浓度,mol/L;m为咸鸭蛋蛋清的质量,g。
1.3.7 蛋清蛋白种类测定
用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)分析新鲜鸭蛋蛋清与不同腌制时期的浓蛋清与稀蛋清浓厚蛋白与稀薄蛋白的蛋白种类[16]。将新鲜的鸭蛋蛋清、咸鸭蛋的稀蛋清、浓蛋清浓厚蛋白与稀薄蛋白配制成的50 mg/mL的溶液;用8 000 Da透析袋透析脱盐24 h,冻干后配制成浓度为20 mg/mL的溶液,吸取50 μL溶液至1.5 mL离心管中,加入200 μL的5x蛋白上样缓冲液,用涡旋混匀器混匀后沸水浴加热5 min,冷却至室温(25℃)。配制12%的分离胶和5%浓缩胶,加入冷却后的样品,启动电泳。当蓝色染料迁移到底部时,停止电泳。取出胶块,用考马斯亮蓝染色2 h,之后脱色直到脱去蓝色背景。
1.3.8 蛋白二级结构的变化
分别准确称取1 mg不同腌制时期未脱盐冻干后的浓蛋清与稀蛋清浓厚蛋白与稀薄蛋白,与150 mg溴化钾进行研磨压片,置于FT-IR光谱仪中进行扫描[17]。所得的红外谱图在酰胺Ⅰ带1 600 cm-1~1 700 cm-1范围内进行两点基线校正,采用Savitsk-Golay函数平滑后,做二阶导数和傅里叶去卷积,手动选定各子峰的峰位和峰宽。采用Gauss函数对谱图进行峰拟合,多次拟合使残差R2大于0.98。根据波数确定各子峰与不同二级结构的对应关系,积分面积计算各二级结构的相对百分含量。
1.3.9 微观结构观察
取少量不同腌制时期未脱盐冻干后的浓厚蛋白与稀薄蛋白,喷金后放置于扫描电镜下观察。
1.4 数据分析
利用SPSS 17.0软件进行数据的统计学处理,所有数据均以平均值±标准差表示。
2 结果与分析
2.1 蛋清指数(WI)
腌制的过程中蛋清指数的变化如图1所示。
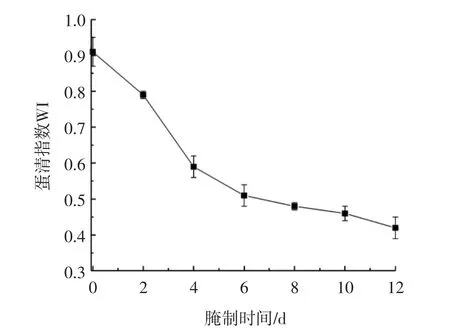
图1 蛋清指数Fig.1 Egg white index
蛋清在腌制的过程中WI呈下降趋势,新鲜鸭蛋的WI为0.91±0.07,腌制成熟时下降至0.43±0.10,下降了0.48。WI下降可能是因为两方面原因,一方面,浓厚蛋白是一种弱凝胶,在饱和盐水腌制的过程中,盐分加快了浓厚蛋白中的水分向蛋清中迁移,导致浓厚蛋白质量减少;另一方面是由于在腌制的过程中蛋清发生了稀薄化,一部分浓厚蛋清转化为稀薄蛋清浓厚蛋白转化为稀薄蛋白。
2.2 蛋清中水分的相态变化
采用核磁共振分析与成像系统分析新鲜蛋清、真空减压法腌制成熟时的浓厚蛋白与稀薄蛋白的水分的相态变化,得到的T2图谱如图2所示,水分相态的百分含量如表1所示。

图2 信号强度与弛豫时间的关系曲线图Fig.2 Relation curve of signal intensity and relaxation time

表1 蛋清中水分相态的百分含量Table 1 Percentage of water phase state in egg white
由图2可知,在1 ms~20 ms水分子活度较小,流动性差,为结合水,在20 ms~100 ms水分子与大分子物质通过氢键结合,在100 ms~1 000 ms水分子活度大,为自由水。峰面积对应不同状态水分的相对含量。由表1可知,咸鸭蛋稀蛋清稀薄蛋白的自由水含量较高,其次是新鲜蛋清,浓厚蛋白所含自由水相对较少。这是由于浓厚蛋白是一种弱凝胶结构,在NaCl的腌制过程中,浓厚蛋白的弱凝胶结构发生变化,自由水从浓厚蛋白迁移到稀薄蛋白中,使得稀薄蛋白自由水含量增加,浓厚蛋白自由水含量减少。在NaCl的腌制过程中,蛋黄中自由水也迁移到蛋清中,但是由于蛋清的保水性导致自由水从蛋壳迁移到蛋壳外较少,所以导致稀薄蛋清白中自由水含量较高[18-19]。
2.3 蛋清表面疏水性的测定
蛋白质的疏水相互作用对于蛋白质分子的聚集具有重要意义。表面疏水性取决于水分子之间的相互作用由非极性基团排斥而引起的非极性基团的聚集蛋白质。咸鸭蛋蛋清中的浓厚蛋白和稀薄蛋白的表面疏水性的测定结果如图3所示。

图3 蛋清表面疏水性Fig.3 Egg white surface hydrophobic
由图3可知,新鲜鸭蛋的蛋清表面疏水性为87.23%,在盐水的腌制过程中,咸鸭蛋的浓厚蛋白表面疏水性逐渐增加。在腌制成熟时增加到了111.13%,增加了27.40%,而稀薄蛋白其表面疏水性也增加到了90.67%,增加了3.94%。表面疏水性增加说明咸鸭蛋蛋清中的浓厚蛋白和稀薄蛋白的构象发生了变化,蛋白结构持续展开,形成了异于新鲜蛋清的状态,使得埋藏在蛋白质空间构象内部的疏水性氨基酸(如色氨酸和苯丙氨酸)残基暴露。说明在盐水腌制咸鸭蛋过程中,NaCl破坏了蛋白内部疏水作用与外表面的亲水作用之间的平衡,蛋白质变性而结构展开,逐渐暴露出内部的疏水性基团[20]。从而提供了测定蛋白质表面疏水性的荧光探针——ANS更多的结合位点,故随着腌制时间的延长,蛋清中NaCl增加使得浓厚蛋白和稀薄蛋白表面疏水性不断增加。
2.4 蛋清巯基含量
为了分析咸鸭蛋蛋清在腌制过程中浓厚蛋白与稀薄蛋白的结构变化,测定其总巯基与自由巯基的含量,结果如图4~图5所示。

图4 腌制过程中蛋清自由巯基含量Fig.4 Free sulfhydryl content of egg white during pickling

图5 腌制过程中蛋清总巯基含量Fig.5 Total sulfhydryl content of egg white during pickling
由图4~图5可知,从新鲜鸭蛋到成熟咸鸭蛋的过程中,浓厚蛋白的总巯基从14.166 μmol/g减少到11.03 μmol/g,下降了 22.14%,自由巯基从 10.13 μmol/g减少到7.21 μmol/g,下降了28.83%;稀薄蛋白的总巯基从 14.166 μmol/g减少到 5.05 μmol/g,下降了22.14%,自由巯基从 9.23 μmol/g减少到 4.16 μmol/g,下降了54.93%,说明蛋清蛋白的结构发生了变化,蛋白中的巯基通过共价交联形成二硫键,也有可能是巯基发生了其他反应,如氧化反应。还有可能是由于在腌制的过程中,水分的迁移使得蛋清中水分增加,导致巯基在蛋清中的含量降低[21]。
2.5 总蛋白含量的测定
全自动凯氏定氮仪测定新鲜鸭蛋的蛋清、减压腌制成熟时咸鸭蛋清中稀薄蛋白与浓厚蛋白总蛋白含量。测定结果如图6所示。

图6 鲜鸭蛋与咸鸭蛋蛋白含量的对比Fig.6 Comparison of protein content in fresh duck egg and salted duck eggs pickling
由图6可知,新鲜鸭蛋的稀薄蛋白比浓厚蛋白的总蛋白含量高1.16%;腌制成熟的咸鸭蛋蛋清中,中的浓厚蛋白比稀薄蛋白的总蛋白含量高5.38%。可能是在腌制过程中,咸鸭蛋稀蛋清中水分含量增加,使得蛋白含量下降。总体来看,稀薄蛋白与浓厚蛋白中蛋白总含量并无明显差异。
2.6 蛋清蛋白种类测定
通过SDS-PAGE研究腌制过程中蛋白种类的变化。稀薄蛋白、浓厚蛋白在腌制时期的电泳条带如图7、图8所示。
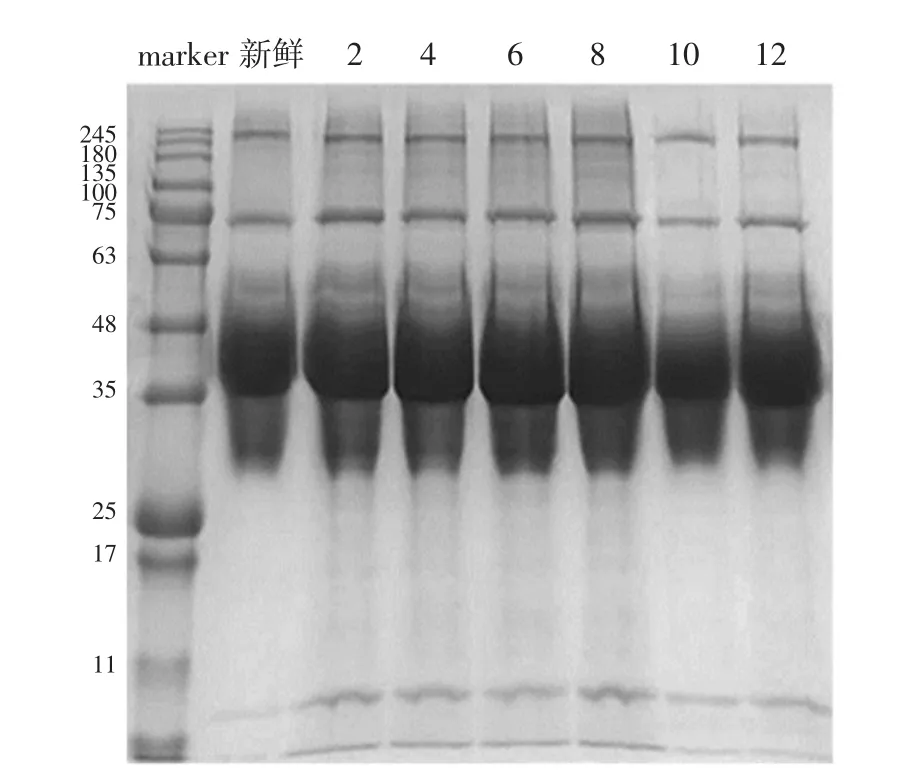
图7 蛋清稀薄蛋白Fig.7 Egg white thin protein

图8 蛋清浓厚蛋白Fig.8 Egg white thick protein
由图7~图8可知,标准蛋白的分子量11 kDa~245 kDa,不同盐腌制时间的浓厚蛋白与稀薄蛋白的蛋白分子量范围为25 kDa~189 kDa。不同腌制时间咸鸭蛋蛋清中浓厚蛋白与稀薄蛋白质电泳图无差异,在NaCl的腌制过程中未观察到蛋白分子种类的变化,表明NaCl并没有影响浓厚蛋白与稀薄蛋白的种类。
2.7 蛋白二级结构的变化
将不同腌制时期未脱盐冻干后的浓厚蛋白与稀薄蛋白,利用傅里叶红外光谱(FT-IR)测其蛋白二级结构(α-螺旋、β-折叠、β-转角、无规则卷曲)的变化,结果如表2、表3所示。

表2 浓厚蛋白红外光谱二级结构含量Table 2 Secondary structure content of thick protein in FT-IR
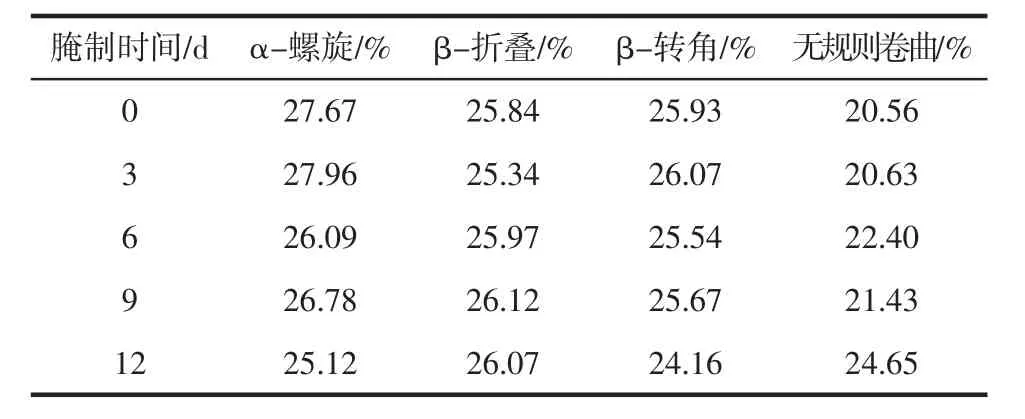
表3 稀薄蛋白红外光谱二级结构含量Table 3 Secondary structure content of rarefied protein in FT-IR
由表2可知,新鲜鸭蛋中的浓厚蛋白含有20.90%的 α-螺旋,36.84%的 β-折叠,20.13%的 β-转角,22.13%无规则卷曲,经过12 d的腌制α-螺旋与β-折叠下降1.78%、8.13%,β-转角与无规则卷曲增加1.43%、8.48%。由表3可知,新鲜鸭蛋中的稀薄蛋白含有27.67%的α-螺旋,25.84%的β-折叠,25.93%的β-转角20.56%无规则卷曲,经过12 d的腌制α-螺旋与β-转角的二级结构含量分别下降了2.55%、1.77%;β-折叠与无规则卷曲的百分含量都增加分别增加了0.23%、4.06%。稀薄蛋白的二级结构变化与邵萍等[22]测定咸鸭蛋蛋清在腌制过程中的二级结构变化的结果一致。浓厚蛋白与稀薄蛋白的α-螺旋结构含量都下降,无规则卷曲百分含量都上升,说明在腌制的过程中浓厚蛋白和稀薄蛋白分子聚集情况减弱[23]。结合蛋白疏水性和巯基的变化结果,说明在腌制的过程中,浓厚蛋白与稀薄蛋白的结构发生了变化,蛋白分子结构展开[24]。
2.8 微观结构观察
扫描电镜观察结果如图9所示。


图9 浓厚蛋白与稀薄蛋白结构对比(×250)Fig.9 The microstructure structure of the thick protein is compared with that of the think protein(×250)
由图9可知,稀薄蛋白呈片状碎屑状,薄片状结构,浓厚蛋白结构排列整齐有序。
3 结论
在咸鸭蛋的真空减压常温腌制过程中,蛋清发生了较明显的稀化现象,即浓厚蛋白变为稀薄蛋白。本文从浓厚蛋白与稀薄蛋白的结构、蛋白含量与种类对比二者的差异。结果表明,浓厚蛋白较稀薄蛋白中自由水含量少,而结合水较多,表面疏水性增加,巯基含量也上升。并且二级结构(α-螺旋、β-折叠、β-转角、无规则卷曲)也有差异。这说明在腌制的过程中,浓厚蛋白与稀薄蛋白的空间结构发生了变化,蛋白分子聚集情况减弱,蛋白分子结构展开。但是在蛋白含量与SDS-PAGE分析中,蛋白总量与种类没有发生变化。利用扫描电镜对浓厚蛋白与稀薄蛋白进行观察,浓厚蛋白结构整齐有序,而稀薄蛋白结构排列无序。总体而言,在真空减压常温下腌制咸蛋的过程中,浓厚蛋白与稀薄蛋白的蛋白结构显著不同,而蛋白含量与种类差异不大。