食管鳞状细胞癌组织Gas6和Axl表达与CEA、SCC、CYFRA21-1的相关性
2022-02-28孔令玉魏晓玉周行健
孔令玉 魏晓玉 周行健 刘 靖 李 晶
1.天津市滨海新区中医医院肿瘤科,天津 300451;
2.河北医科大学中西医结合学院,河北 石家庄 050017;
3.河北医科大学第四医院中医科,河北 石家庄 050011
2018年全球肿瘤生存情况调查表明食管癌(esophageal cancer,EC)的发生率及死亡率分别排在第七位和第六位,恶性肿瘤患者死亡的主要原因是淋巴转移和血液转移[1-2]。食管癌常见两种类型,食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)和食管腺癌(esophageal adenocarcinoma,EAC),其中前者占绝大多数[3]。EC在东亚和非洲大陆南部地区发病率较高,中国EC发病率是全球平均水平的10倍,居于第一位,ESCC是最主要的病理组织分型[4-5]。EC的全球肿瘤生存形势报告2010-14(CONCORD-3)显示我国EC患者的5年生存率低于日本、韩国[6]。因为症状隐匿,EC发现时大多已处中晚期,导致手术治疗后的预后并不乐观[7-9]。
ESCC患者主要致死因素是癌症侵袭和转移,寻找ESCC侵袭和转移相关靶点等显得尤其重要。生长抑制特异性蛋白6(Gas6)和Axl在肝细胞肝癌、肺癌等肿瘤组织和细胞高表达;上皮-间质转化(epithelial mesenchymal transition,EMT)的一些转录因子被Gas6/Axl复合物激活[10-14]。在鳞状细胞来源的肿瘤预后评价中常把细胞角蛋白19片段抗原21-1(CYFRA21-1),以及鳞状细胞癌抗原(SCC-Ag)等作为监测指标。然而,预测预后的最佳标志物仍然未知,鲜有研究着重讨论ESCC肿瘤生物标志物与术后治疗之间的关系[15]。有报道检测了57例ESCC患者的病理组织,结果显示癌胚抗原(CEA)、SCCAg以及其他特异指标对食管癌的进展过程有监测意义[16]。
本研究检测ESCC患者术后组织Gas6和Axl的表达水平,并分析其表达水平与ESCC最密切的三个重要标志物的相关性。以期对ESCC早期诊断、治疗和疾病进展监测提供更多靶点和疗效评价依据。
1 材料和方法
1.1 ESCC患者术后病理组织制备
随机抽选河北医科大学第四医院ESCC患者术后病理标本各20例,患者术前未接受放化疗,留取术后切除的肿瘤组织(ESCC组)和癌旁正常组织(NC组)标本,选取的组织由2名高年资病理医生确认,对ESCC组和NC组标本采取石蜡包埋切片,采用HE组织染色方法鉴定肿瘤组织和癌旁正常组织[17],借助显微镜观察且进行图像收集。
1.2 ESCC肿瘤组织标本和癌旁正常组织标本Gas6免疫组化检测
Gas6的表达检测选用免疫组织化学法(IHC)[17],首先对石蜡切片进行脱水,抗原修复,阻绝内源性过氧化物酶,血清封闭,然后进行一抗anti-GAS6(cell signaling technology,CST;#67202)和二抗(Servicebio,G23301)孵育观察,使用DAPI复染细胞核进行脱水封片,在智能高内涵细胞成像分析系统Invitrogen EVOS FL Auto2(Thermo Fisher Scientific,Waltham,MA,USA)进行拍照观察[17-18],通过显微镜进行拍照和图像收集。将细胞间质的棕褐色及褐色染色作为评估Gas6阳性表达的指征。通过图像分辨软件Imagepro-Pro-Plus6.0(IPP6.0)分析每组图片的光度值(IOD)并做统计处理。
1.3 ESCC肿瘤组织标本和癌旁正常组织标本Axl免疫荧光实验
Axl表达检测采用免疫荧光方法[19],进行病理标本脱蜡和相关处理,进行一抗(Bioss,bs-5180R)和荧光二抗(Servicebio,GB21303)孵育,DAPI复染细胞核,封片,使用Invitrogen EVOS FL Auto2进行拍照观察。采用IPP6.0分析每组图片的IOD并做统计处理[17]。
1.4 ESCC患者肿瘤标志物检查
20例ESCC患者分别采集晨起血液样本,通过离心机处理,应用罗氏检测仪和相应的配套试剂(瑞士罗氏公司)分别对患者的CEA、鳞癌有关抗原(SCC),以及CYFRA21-1进行检测[17]。
1.5 统计学处理
收集的所有数据均使用SPSS 21.0软件进行统计学处理,计量资料采用均数±标准差描述。ESCC组与NC组对比采用独立样本t检验,Gas6、Axl表达水平与肿瘤标志物的相关性采用Pearson相关性分析,检验水准为α=0.05。
2 结 果
2.1 ESCC组和NC组标本病理表现
HE染色病理组织类型确认20例EC患者的术后肿瘤标本全部为鳞状细胞癌,癌旁对照标本经过高年资病理医师排除肿瘤细胞浸润。染色后标本镜下观察食管肿瘤标本显示肿瘤细胞排列呈现集中的趋势,存在多处肿瘤细胞的团簇状聚集区,认定为癌巢组织,其以外的细胞排列不规则,呈斑片条索状,细胞核呈肿大状态,形态表现极不规则。癌旁正常组织界限清晰,细胞排列同向且规律,细胞核大致呈梭形,细胞核清晰且无膨胀。见图1。
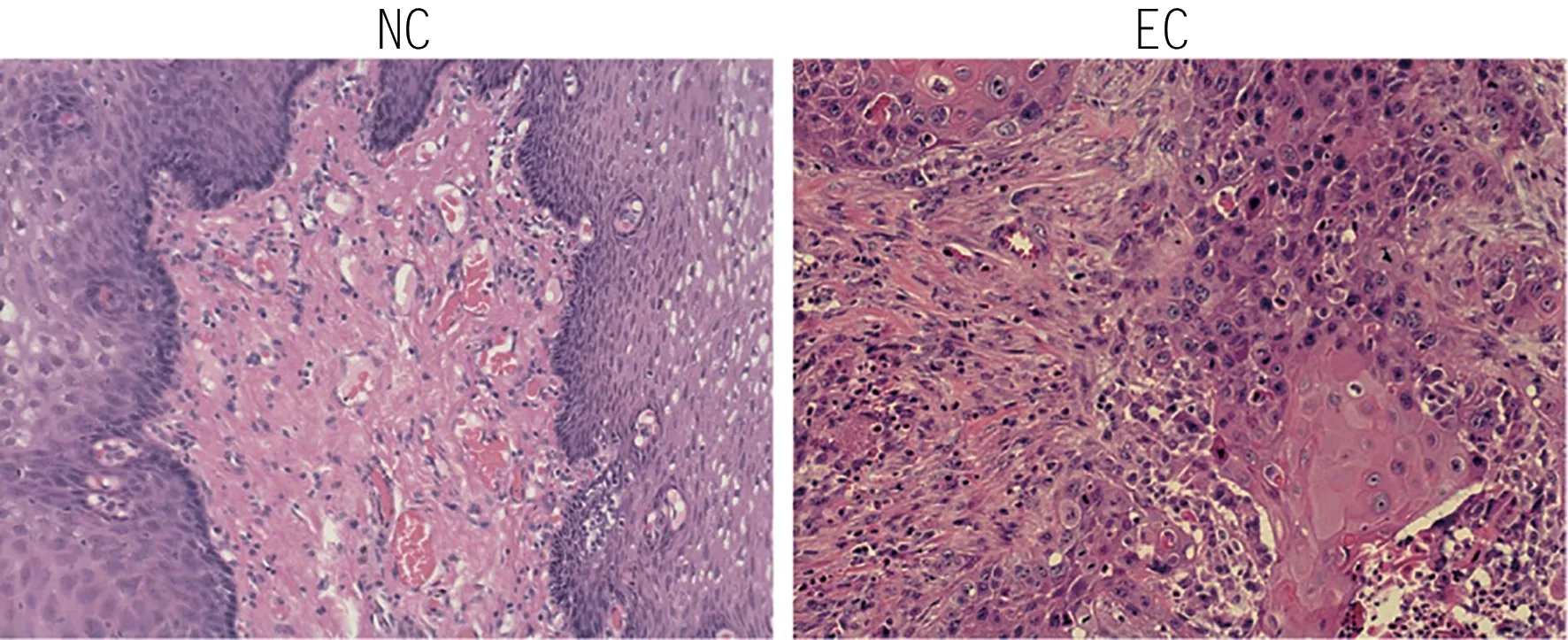
图1 食管癌肿瘤组织和癌旁组织HE染色,200×
2.2 ESCC组和NC组标本Gas6表达
IHC染色后镜下观察显示NC组Gas6的表达量很少,而ESCC组显像很高,IOD统计证实ESCC组Gas6的IOD相比NC组显著增高(图2A和2B,P<0.01);另一组实验对与ESCC诊断及预后相对密切的三个肿瘤标志物(CEA、SCC和CYFRA21-1)和肿瘤病理标本Gas6 IOD水平进行Pearson相关性分析,结果显示ESCC患者的Gas6 IOD值与CEA表达水平(R2=0.6364,P<0.01)、SCC表达水平(R2=0.3552,P<0.05),以及CYFRA21-1表达水平(R2=0.6628,P<0.01)均呈正相关(图2C)。因此实验图像和数据证实Gas6在ESCC肿瘤组织表达水平高,并与肿瘤诊断和预后相关。
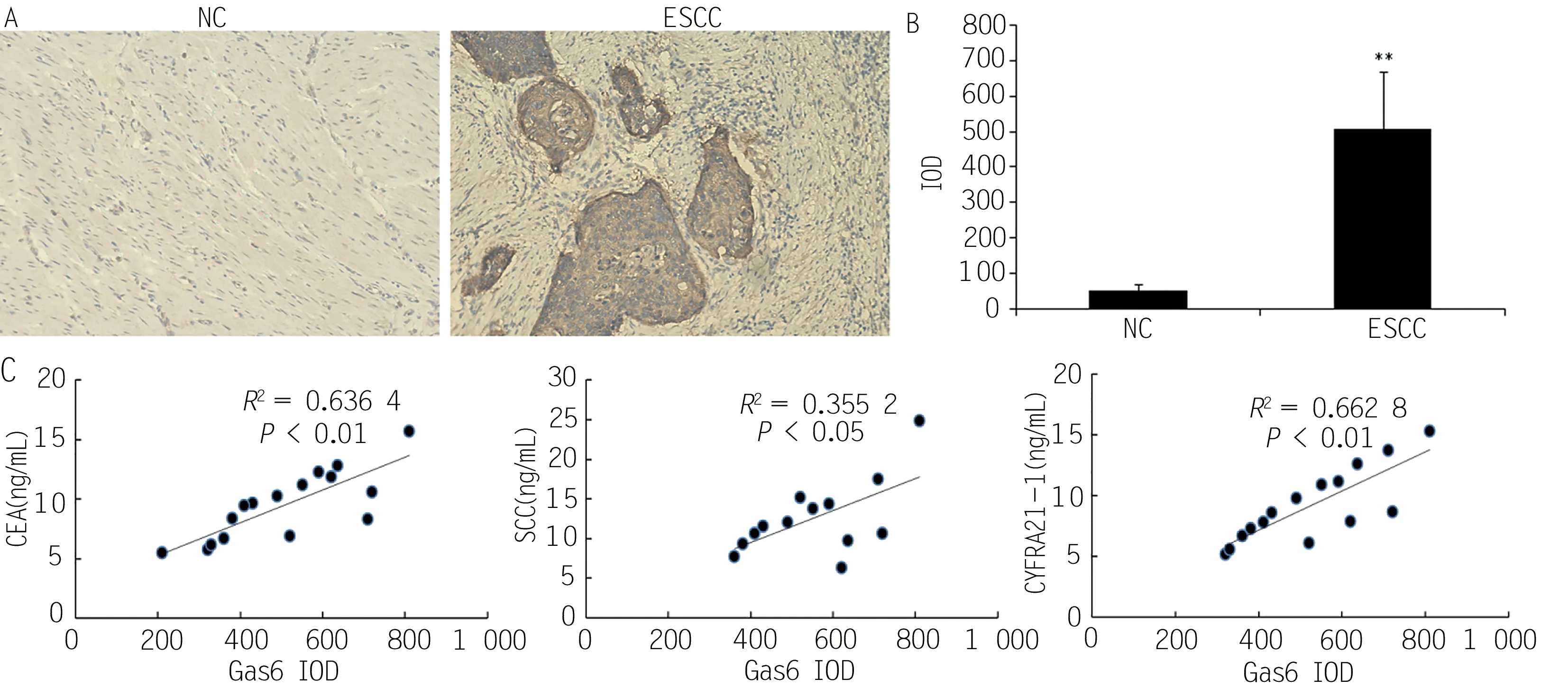
图2 ESCC组和NC组Gas6显像及与肿瘤标志物关系
2.3 ESCC组和NC组标本Axl表达情况
检测结果显示Axl在ESCC组高表达,主要分布在细胞膜和胞浆;而在NC组表达较少。Axl的荧光图像统计分析表明其在ESCC组相比NC组明显升高(图3A和3B,P<0.01);对与ESCC诊断及预后相对密切的三个肿瘤标志物(CEA、SCC和CYFRA21-1)和肿瘤组织标本Axl荧光学表达量进行Pearson相关性评价,结果显示ESCC患者的Axl IOD值与CEA表达情况(R2=0.3487,P<0.05)、SCC表达情况(R2=0.4562,P<0.01)和CYFRA21-1表达情况(R2=0.3631,P<0.01)均呈正相关(图3C)。
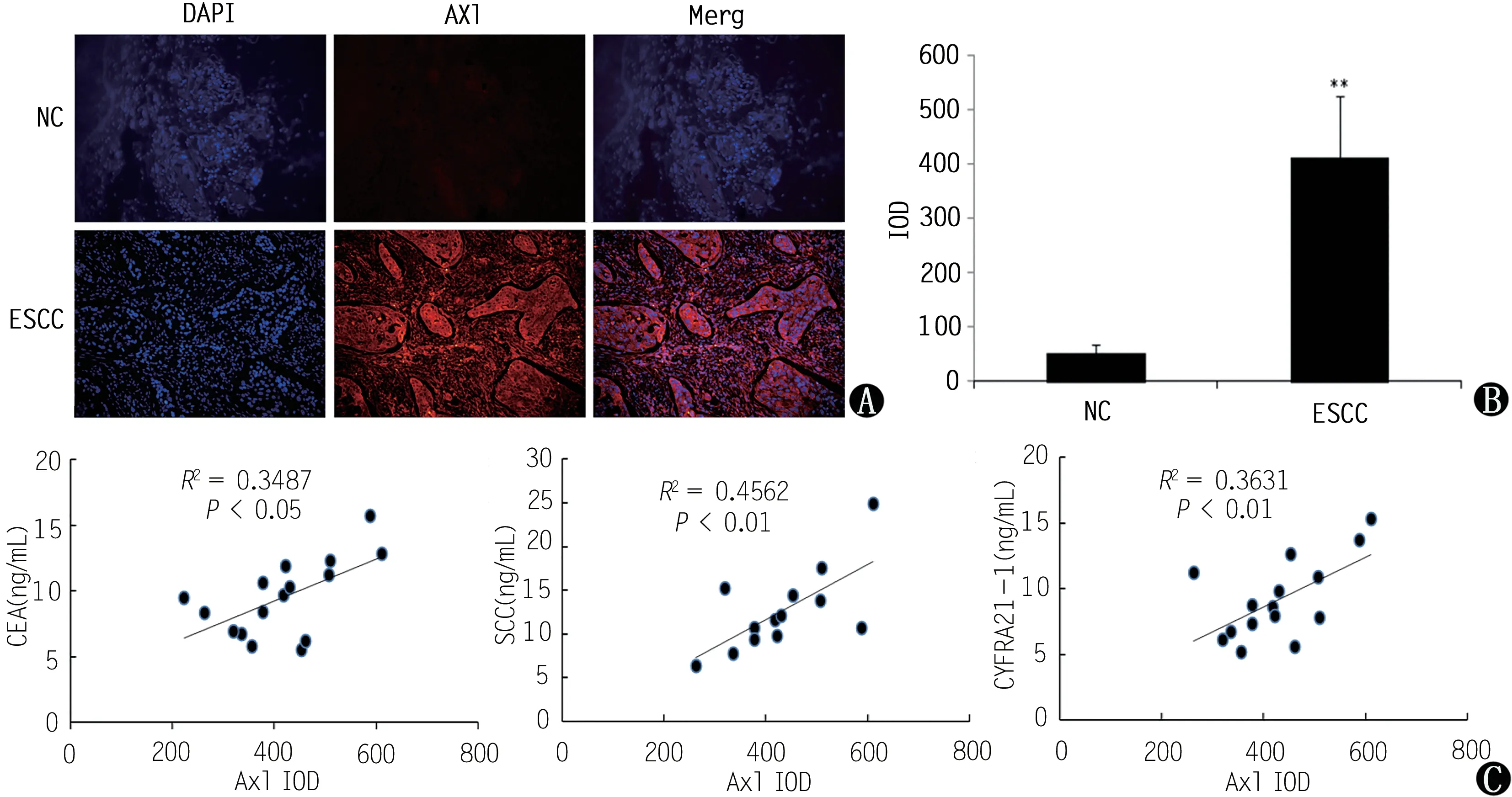
图3 ESCC肿瘤组织和癌旁组织Axl及与肿瘤标志物的相关性
3 讨 论
EC仍然是严重威胁人类健康的消化道恶性肿瘤,EC早期没有明显表现(容易误诊或延误治疗),晚期和转移性EC患者通常会受到癌症相关症状和因素的影响,从而使患者的体能状态和生活质量恶化[20-21]。Axl最初发现在血液肿瘤中升高,后又发现在其他实体恶性肿瘤(如肺癌)标本细胞膜和胞质内染色升高,且是肿瘤预后不良的影响因素[22]。Gas6和Axl能够单独或者联合应用作为原发性和转移性非小细胞肺癌患者手术以及保守治疗的可靠标志物[23-25]。Gas6与Axl(Gas6/Axl复合物)的绑定会调整肿瘤细胞的功能,比如侵袭、迁移能力,但是对于其改变肿瘤细胞功能的方式和机制尚不清楚[15-16]。此外,Axl的活化或基因沉默对肺癌的表皮生长因子受体(epithelial gr owt h f act or r eceptor,EGFR)靶向治疗起到反作用,而对肿瘤的侵袭转移起到一定抑制作用,但是具体的作用机制尚不明确[26]。
本试验对ESCC患者的术后组织进行检测,结果表明ESCC肿瘤组织的Gas6和Axl活性显著高于癌旁正常组织,这与在胃癌等组织的研究结果一致。Gas6和Axl的表达情况与ESCC患者最相关的敏感指标(CEA、SCC和CYFRA21-1)的表达水平呈现正相关。
本研究证明Gas6和Axl在ESCC进展中起促进作用,而且Gas6和Axl在ESCC肿瘤细胞中也是高表达的[17]。本课题组[17,27]曾用清代古方启膈散(QGS)干预ESCC细胞,经过基因蛋白芯片检测,发现QGS对ESCC细胞Gas6有显著抑制作用。本研究结果也为QGS抑制ESCC细胞侵袭和转移提供了有利的证据和参考。
利益冲突所有作者均声明不存在利益冲突
