右美托咪定对高迁移率族蛋白1诱导人脐静脉内皮细胞炎性反应的影响*
2022-02-28张志发朱梦娇杨少兵陶怡芝王学仁
张志发,朱梦娇,杨少兵,陶怡芝,王学仁
华中科技大学同济医学院附属同济医院麻醉科,武汉 430030
右美托咪定(dexmedetomidine,DEX)是一种高选择性的α2肾上腺素能受体激动剂[1],常用于ICU患者的镇静及手术麻醉的诱导或维持[2]。近年研究发现右美托咪定不仅具有抗交感神经兴奋、镇痛及稳定循环等特性,其对正常心肌[3]、肾脏[4]和血管内皮细胞[5]的炎性反应也有显著的抑制作用。高迁移率族蛋白1(high mobility group box protein-1,HMGB1)是一类广泛存在于真核细胞核内的非组蛋白染色质结合蛋白,参与DNA的转录、复制等生理调节过程。细胞在受到外界或内源性炎性介质刺激后,HMGB1可通过中性粒细胞、巨噬细胞等炎症细胞主动分泌或被动释放的方式转移至胞外,以晚期炎症因子的形式参与机体局部或全身炎症反应[6]。Yoo等[7]研究证实HMGB1可诱导人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVECs)释放TNF-α和IL-1β等炎性介质,但对右美托咪定是否可抑制HMGB1诱导的HUVECs炎性反应尚不清楚。本实验旨在研究右美托咪定对LPS刺激HUVECs分泌HMGB1的影响,以及其调控HMGB1诱导HUVECs炎性反应的分子机制。
1 材料和方法
1.1 材料
HUVECs购自中科院上海细胞生物医学研究所。右美托咪定(江苏恒瑞医药股份有限公司),脂多糖(LPS,Sigma公司),重组人HMGB1蛋白(Abcam公司),DMEM培养液、胎牛血清(fetal bovine serum,FBS)和青-链霉素溶液(Hyclone公司),HMGB1酶联免疫试剂盒(Shino-Test公司),IL-1β和TNF-α酶联免疫试剂盒(南京建成生物工程研究所),p38 MAPK抑制剂(SB203580,Sigma公司),ERK1/2抑制剂(PD98059,Selleck公司),p-ERK1/2、ERK1/2、p-p38 MAPK、p38 MAPK、p-JNK、JNK抗体(Cell signaling公司),MTT试剂盒、内参抗体β-actin(武汉博士德有限公司),ELC化学发光试剂盒(上海碧云天生物技术有限公司)。
1.2 细胞培养及分组
HUVECs细胞复苏后用含10% FBS的DMEM培养液,在37℃、5%CO2饱和湿度的培养条件下常规培养。选取对数生长期的细胞接种于6孔板,待融合度达到80%以上时进行分组实验。对照组(Control组):正常培养;LPS组:用含100 ng/L LPS的细胞培养液刺激细胞16 h;LPS+右美托咪定组:100 ng/L LPS刺激细胞16 h后,不同浓度的右美托咪定(0.01、0.1、1、10 nmol/L)继续处理HUVECs 4 h。后期实验分为对照组(Control组):正常培养;右美托咪定组:用1 nmol/L右美托咪定的细胞培养液处理细胞4 h;HMGB1组:用1μg/m L HMGB1的细胞培养液刺激细胞16 h;HMGB1+右美托咪定组:用1μg/m L HMGB1孵育细胞16 h后,1 nmol/L的右美托咪定继续处理4 h。
为了检测MAPK信号通路对HMGB1刺激细胞炎性因子的影响,SB203580(10μmol/L,p38 MAPK通路抑制剂)或PD98059(20μmol/L,ERK通路抑制剂)分别预处理细胞2 h后,维持抑制剂浓度进行后续实验。
1.3 ELISA检测
分别以不同浓度的右美托咪定单独或联合LPS或HMGB1刺 激HUVECs细 胞,收 集HUVECs培养液,1000 r/min离心5 min后,取上清液,按照ELISA试剂盒说明书进行操作,根据标准曲线计算HMGB1、TNF-α和IL-1β的含量。
1.4 细胞免疫荧光检测
取对数生长期的细胞,经胰酶消化后用细胞培养液配制细胞悬液。将无菌的盖玻片平铺于6孔板中,接种细胞悬液后培养24 h,弃去培养液,分别加入LPS(100 ng/L,作用4 h)或右美托咪定(1 nmol/L,作用4 h)培养液处理HUVECs细胞,取出盖玻片进行免疫荧光染色。PBS洗涤、4%多聚甲醛固定60 min、0.5% Triton X-100透膜10 min和封闭后,用HMGB1抗体在4℃孵育过夜,次日复温后滴加二抗室温孵育30 min,共聚焦荧光显微镜下直接检测和观察细胞内HMGB1的转运情况。
1.5 MTT检测
细胞培养至对数生长期后,以5×107/L细胞密度接种于96孔板,每孔100μL,设置5个复孔。加入不同浓度的(0.01、0.1、1、10 nmol/L)右美托咪定处理,继续培养细胞4 h,随后每孔加入90μL新鲜培养液和10μL MTT溶液,继续培养4 h。吸除培养液,加入DMSO溶液150μL并振荡反应10 min,使结晶物充分溶解。用酶标仪检测490 nm处吸光度(A)值,计算细胞的相对活力。细胞相对活力(%)=(实验组A值-空白组A值)/(对照组A值-空白组A值)×100%。
1.6 Western blot实验
HUVECs经右美托咪定及HMGB1处理后,加入适量的RIPA全裂解液裂解,提取细胞总蛋白,利用BCA试剂盒测定蛋白浓度。在细胞总蛋白样品中加入loading buffer,沸水使其充分变性。然后用SDS-PAGE分离蛋白,经蛋白转膜、封闭、一抗(p-ERK1/2、ERK1/2、p-p38 MAPK、p38 MAPK、p-JNK、JNK抗体)及二抗孵育杂交后进行ECL化学发光反应。以β-actin为内参照,对条带进行灰度扫描,比较各蛋白的表达变化。
1.7 统计学处理
实验数据采用SPSS 19.0统计软件分析。计量资料以均数±标准差(±s)表示,多组间均数比较采用单因素方差分析,差异显著者应用SNK-q检验进行各组均数间两两比较。以P<0.05为差异有统计学意义。
2 结果
2.1 右美托咪定对LPS刺激HUVECs分泌HMGB1的影响
100 ng/m L LPS刺激HUVECs 16 h后,予以不同浓度(0.01、0.1、1、10 nmol/L)的右美托咪定处理4 h。结果表明,LPS刺激可导致细胞上清液中HMGB1的浓度增加(P<0.01,图1A);1、10 nmol/L右美托咪定可呈剂量依赖性地抑制HUVECs分泌HMGB1(均P<0.05,图1A)。为了排除右美托咪定对HUVECs的毒性作用,我们检测了右美托咪定对HUVECs活力的影响,结果显示不同浓度的右美托咪定对HUVECs的活力无显著影响(均P>0.05,图1B)。右美托咪定的临床相关浓度为1.0~6.0 nmol/L[8],因此,后续实验在基于右美托咪定抑制LPS刺激HUVECs分泌HMGB1的前提下,选取临床浓度范围内的1 nmol/L作为右美托咪定的实验浓度。细胞免疫荧光结果表明,HMGB1主 要 位 于HUVECs细 胞 核,LPS刺 激HUVECs 4 h后可促进HMGB1转移至胞质,而1 nmol/L右美托咪定可抑制HUVECs中HMGB1移位(图1C)。

图1 右美托咪定抑制LPS刺激下HUVECs分泌HMGB1Fig.1 Dexmedetomidine inhibited LPS-stimulated HMGB1 release in HUVECs
2.2 右美托咪定对HMGB1刺激HUVECs分泌炎症因子的影响
相比于对照组,外源性1μg/m L HMGB1可显著促进HUVECs分泌TNF-α和IL-1β炎症因子(均P<0.01,图2A、2B);而HUVECs予以右美托咪定继续处理4 h后,TNF-α和IL-1β炎症因子的分泌水平受到显著抑制(均P<0.05,图2A、2B)。

图2 右美托咪定抑制HMGB1刺激下HUVECs分泌TNF-α、IL-1βFig.2 Dexmedetomidine inhibited HMGB1-stimulated production of inflammatory factors TNF-αand IL-1βin HUVECs
2.3 右美托咪定对HMGB1刺激HUVECs MAPK信号的影响
与对照组相比,1μg/m L外源性HMGB1作用HUVECs 16 h后,可 显 著 促 进ERK1/2、p38 MAPK和JNK的磷酸化;而右美托咪定可抑制ERK1/2和p38 MAPK的磷酸化水平(均P<0.05,图3),但对JNK的磷酸化水平无显著影响。分别加入ERK1/2抑制剂(PD98059)、p38 MAPK抑制剂(SB203580)预处理HUVECs 2 h后,ELISA结果显示PD98059可抑制TNF-α、IL-1β的表达,右美托咪定与PD98059可协同抑制TNF-α、IL-1β的合成分泌(均P<0.05,图4A、4B);SB203580可抑制IL-1β的表达,但对TNF-α的表达无影响,右美托咪定与SB203580可协同抑制IL-1β的合成分泌(P<0.05,图4A、4B)。

图3 右美托咪定抑制HMGB1刺激下MAPK信号通路的磷酸化Fig.3 Dexmedetomidine inhibited phosphorylation of the MAPK signaling pathway stimulated by HMGB1
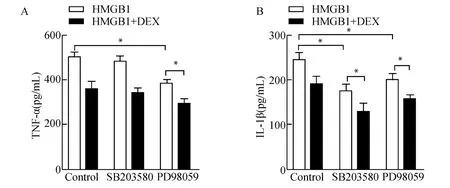
图4 右美托咪定通过p38 MAPK和ERK1/2调节HMGB1诱导的HUVECs炎性反应Fig.4 Dexmedetomidine regulated the HMGB1-induced inflammatory responses in HUVECs via p38 MAPK and ERK1/2
3 讨论
LPS可刺激多种炎症和免疫细胞分泌核蛋白HMGB1,而抑制HMGB1可降低动物因全身炎性反应导致多器官功能障碍的病死率[7],表明HMGB1在炎性反应呈“瀑布样”级联放大效应中发挥着重要作用。本研究首先通过LPS刺激HUVECs构建细胞炎性损伤模型,证实胞核内HMGB1可依次通过胞质移位、胞外分泌的方式增加胞外HMGB1的表达水平,提示HUVECs也是导致HMGB1浓度增加的重要来源之一[8]。LPS促进HUVECs分泌HMGB1的机制复杂,不仅与JAK-STAT1调节的HMGB1胞质移位有关[9],也与胞质内高度乙酰化的HMGB1被细胞以主动或被动形式分泌至胞外有关[10]。目前虽有研究证实右美托咪定可通过JAK-STAT1信号抑制缺血再灌注损伤[4]或糖氧剥夺[11]后机体的炎性反应,但在本实验中右美托咪定是否也通过该信号来抑制HMGB1胞质转位的方式,从而下调胞外HMGB1的浓度,则需进一步的动物和分子生物学实验证实。
在缺血缺氧引起心肌细胞炎性损伤的研究中,Zhang等[12]报道右美托咪定可通过抑制HMGB1刺激炎症因子释放的方式缓解组织细胞的炎性损伤,本研究结果与其一致,证实右美托咪定预处理可抑制外源性HMGB1刺激HUVECs产生炎性因子,说明右美托咪定是影响HMGB1促进组织细胞分泌炎性因子的因素之一。MAPK信号通路是生物进化过程中高度保守的蛋白激酶,不依赖第二信使,可将细胞外的信息直接传到细胞核内。MAPK主要由3个亚族组成:细胞外信号调节蛋白激酶(ERK)、p38 MAPK、c-Jun氨 基末端激酶(JNK)。ERK涉及细胞炎症、细胞周期、细胞粘附和应激等生理过程中信号的传递[13],而p38 MAPK和JNK则多与细胞凋亡调控相关[14]。本研究结果表明,HUVECs在HMGB1的刺激下,ERK1/2、p38 MAPK和JNK 3种蛋白激酶均发生磷酸化,而右美托咪定则可逆转前两种蛋白激酶的磷酸化;结合右美托咪定可通过抑制巨噬细胞ERK1/2和p38 MAPK磷酸化的方式抑制炎性因子释放的研究[15],我们初步推测右美托咪定对HMGB1刺激HUVECs分泌TNF-α、IL-1β等细胞因子的抑制作用与ERK1/2、p38 MAPK的活化有关。早期研究证实多种不同来源的组织细胞在不同致炎因子刺激下所分泌的炎性因子类型、表达水平受MAPK信号通路调控[16-17],但却并非所有活化的MAPK亚族均参与了炎性因子的调控[18-19]。因此,为了进一步研究右美托咪定抑制HMGB1刺激HUVECs发生炎性反应的关键节点,我们检测了ERK1/2、p38 MAPK抑制剂联合右美托咪定对HUVECs炎性反应的影响,结果发现右美托咪定联合p38 MAPK抑制剂对TNF-α的抑制作用并未出现与IL-1β类似的协同性抑制效果,其主要原因是该抑制剂对TNF-α的抑制效应较弱,推测可能与p38 MAPK 4个同源性较高的异构体(p38α、p38β、p38γ和p38δ)的分布有关[20-21],如果HUVECs中p38 MAPK的组成p38γ和p38δ占优,则可能出现本研究中特异性抑制p38α、p38β亚基的SB203580抑制剂[22]对TNF-α浓度无影响的结果;另外,由于MAPK亚族激酶之间相互作用,抑制剂对细胞内其它的信号通路影响可能也是导致下游炎性因子出现表达差异的重要因素之一[23]。以上结果表明ERK1/2、p38 MAPK亚族激酶是右美托咪定抑制HMGB1刺激HUVECs分泌炎性因子TNF-α或IL-1β的重要靶点。
总之,右美托咪定不仅可以抑制LPS引起的HMGB1分泌,也可通过抑制HMGB1下游MAPK信号途径的方式抑制炎症因子的释放,从而发挥其抗炎作用,表明HMGB1是右美托咪定发挥抗炎作用的重要分子,为下一步通过动物模型验证右美托咪定的抗炎功能提供实验依据。
