利用CRISPR/Cas9技术构建人MCT1基因敲除结肠癌RKO稳定细胞系及其生物学功能检测*
2022-02-28佘晓伟胡俊波
佘晓伟,孙 黎,胡俊波,徐 丰
华中科技大学同济医学院附属同济医院胃肠外科,武汉 430030
单羧酸转运体(monocarboxylate transporters,MCTs)是由溶质载体蛋白家族16(solute carrier 16 family)编码的一组跨膜蛋白,在哺乳动物中广泛表达,主要负责乳酸、丙酮酸、酮体等单羧酸的转运[1]。单羧酸转运蛋白1(monocarboxylate transporter 1,MCT1)是单羧酸转运体中尤为重要的一员,包含N-端、C-端和12次跨膜结构域。它通过将乳酸运输到氧化能力强的组织中氧化利用从而维持机体内在平衡[2]。研究证实,MCT1在多种恶性肿瘤如乳腺癌、肺癌、宫颈癌、骨肉瘤中明显高表达,并且与肿瘤的临床分期、分级以及患者预后密切相关[3-6]。有研究发现,在骨肉瘤细胞中沉默MCT1会抑制NFκB通路,进而影响肿瘤细胞的迁移,并增加其对化疗药物的敏感性。MCT1能够调节肿瘤内多种信号通路,参与能量代谢、侵袭转移、血管生成、免疫耐受等多种肿瘤生物学过程[7-10]。“逆Warburg效应”是近年来解释肿瘤能量代谢共生的一种理论,即乏氧区癌细胞利用糖酵解供能并释放乳酸,常氧区癌细胞利用乳酸通过三羧酸循环供能。而MCT1在这一过程中扮演重要角色[11-13]。有研究发现,肿瘤内常氧区癌细胞依靠MCT1摄入乳酸以维持肿瘤旺盛的代谢需要[14]。然而,MCT1作为乳酸转运的关键蛋白,其对结肠癌发生发展的影响目前尚不清楚。
CRISPR/Cas9技术是一种区别于锌指核酸酶(ZFN)和类转录激活因子核酸酶(TALEN)的新兴基因编辑技术,最早于研究细菌和古细菌抵御外来病毒和质粒入侵时的获得性免疫防御机制研究中被发现[15]。目前该技术已经广泛应用于基因筛选、分子记录、细胞成像、基因治疗等领域[16]。本研究利用CRISPR/Cas9技术构建稳定敲除MCT1基因结肠癌RKO细胞系,通过靶向干预MCT1基因的表达,为进一步探索MCT1在结肠癌发生发展过程中的功能和分子机制奠定基础。
1 材料与方法
1.1 实验材料
结肠癌RKO细胞系由本实验室前期保存;CRISPR-v2载体来自美国维克森林大学Hui-Kuan Lin实验室;大肠埃希菌DH5α感受态、PCR试剂盒、DNA凝胶回收试剂盒、基因组DNA提取试剂盒、质粒小提试剂盒均购自诺维赞公司;DMEM高糖培养液、Opti-MEM无血清培养液、胎牛血清均购自Gibco公司;嘌呤霉素、乳酸购自Sigma公司;TurboFect转染试剂购自Thermo Fisher Scientific公司;乳酸检测试剂盒购自南京建成生物科技有限公司;CCK-8(cell counting kit-8)试剂购自MCE公司;MCT1抗体购自Santa Cruz公司;GAPDH抗体购自ABclonal公司;BbsⅠ限制性核酸内切酶、T4 DNA连接酶购自Takara公司;4%多聚甲醛购自武汉谷歌生物有限公司;山羊抗鼠Ig G红色Dylight488荧光标记二抗、DAPI、青霉素以及链霉素均购自武汉启动子生物有限公司;sg RNA序列合成、PCR引物合成以及基因测序均由奥科鼎盛(武汉)生物科技有限公司完成。
1.2 sgRNA设计及构建CRISPR/Cas9重组质粒
从NCBI中检索人MCT1基因组序列(NCBI Entrez Gene:6566),根据靶点设计原则,并针对其第二号外显子碱基序列于在线设计网站(http://www.e-crisp.org)设计一对single guide RNA(sgRNA),经过脱靶效应评价以及同源序列比对排除后,送至奥科鼎盛(武汉)生物科技有限公司合成单链DNA,序列如表1所示。合成后的单链DNA经过磷酸化和程序性退火之后形成双链DNA。
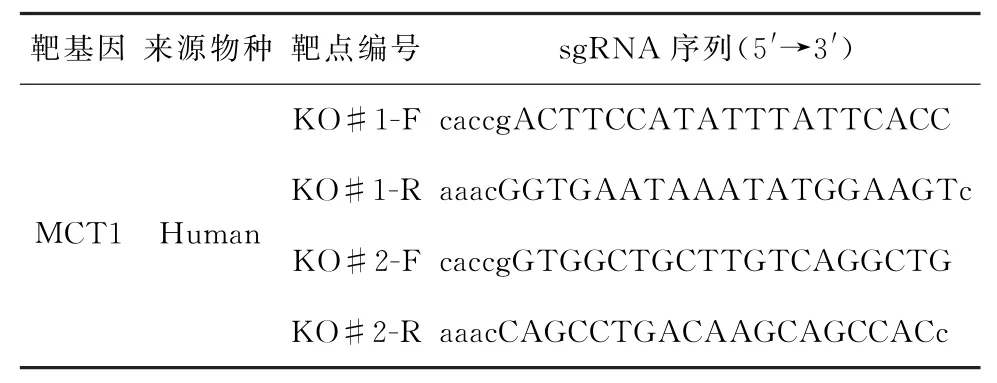
表1 靶向MCT1基因的sg RNA序列Table 1 The sequences of sgRNA targeting MCT1 gene
将酶切后的CRISPR-v2载体与磷酸化和退火后的双链DNA室温连接2 h,然后将连接产物转化至大肠埃希菌DH5α感受态细胞,经过含氨苄青霉素的LB平板筛选后,挑取5个单克隆菌落送至奥科鼎盛(武汉)生物科技有限公司测序。序列无误的菌液摇菌后提取质粒,获得纯化的重组质粒CRISPRv2-MCT1-KO#1、CRISPRv2-MCT1-KO#2。
1.3 利用嘌呤霉素筛选MCT1基因稳定敲除的RKO细胞系
1.3.1 测定嘌呤霉素在RKO细胞中的最小致死浓度 将RKO细胞用胰酶消化后接种于6孔板中,24 h后加入不同浓度梯度的嘌呤霉素,浓度依次为:0.5、1、2、4、8μg/m L。2 d观察细胞全部死亡最小浓度为1μg/m L,即为嘌呤霉素在RKO细胞中的最小致死浓度。
1.3.2 嘌呤霉素筛选单克隆细胞株 将正常RKO细胞系铺于6孔板内,待细胞生长密度达70%后,将2μg的CRISPRv2-MCT1-KO #1和2μg的CRISPRv2-MCT1-KO#2质粒加至250μL Opti-MEM无血清培养液中,同时将5μL TurboFect加至250μL Opti-MEM无血清培养液中充分混匀,静置5 min后将上述液体轻柔混匀,室温静置15 min。将混合液加入对应6孔板中,转染6 h后更换新鲜培养液。转染48 h后加入含1μg/m L嘌呤霉素的培养液进行筛选,直至未转染质粒的细胞完全死亡。
用无菌PBS清洗6次6孔板内细胞,显微镜下观察未发现明显悬浮、死亡细胞后,进行消化及细胞计数。先计数约1×104cells/m L,再按照1∶10的比例进行倍比稀释,最后至终浓度为100 cells/10 m L。将10 m L细胞悬液按照每孔100μL加入至96孔板中,置于细胞培养箱中培养2周并定期更换培养液。2周后,逐一观察每个孔细胞生长情况,标记单克隆生长细胞孔,并消化后转移至6孔板中进一步生长。等待细胞生长至适当密度后,取一部分细胞进行Western blot检测及基因组检测,一部分细胞传代后继续培养。
1.4 MCT1基因敲除RKO细胞系中MCT1基因测序和蛋白表达检测
将挑取的单克隆细胞根据基因组DNA提取试剂盒操作步骤提取基因组DNA,并设计相应范围的PCR引物,引物序列为:上游引物,5′-TGTCTTTTAGGTCCT-3′;下游引物,5′-CTCCAATGACTCCAA-3′。以基因组DNA为模板经PCR扩增后送至奥科鼎盛(武汉)生物科技有限公司测序鉴定,确定MCT1基因序列变化。
收取对照组与MCT1基因敲除的细胞提取总蛋白,经BCA法测定细胞蛋白浓度后,选择120 V恒压进行SDS-PAGE凝胶电泳,转膜后用5%脱脂牛奶室温封闭1 h,TBST清洗3次;一抗4℃孵育过夜(MCT1,1∶1000;GAPDH,1∶1000),次日TBST清洗3次后室温孵育二抗1 h;TBST清洗3次,ECL化学显色,检测MCT1蛋白表达情况。
1.5 免疫荧光技术检测MCT1蛋白表达分布
将对照组与MCT1基因敲除组的细胞分别接种于24孔板内爬片上,置于37℃细胞培养箱内培养24 h后,4%多聚甲醛室温固定30 min;用1%BSA室温封闭1 h;加入鼠抗人MCT1抗体,置于4℃冰箱孵育过夜;次日用1%BSA洗涤3次,加入山羊抗鼠IgG红色Dylight荧光二抗室温染色1 h;1%BSA洗涤3次后DPAI染核5 min,再清洗3次,最后用抗荧光淬灭剂封片。使用荧光显微镜观察并拍照。
1.6 乳酸含量检测
将对照组及MCT1基因敲除组细胞分别接种于6孔板中,待细胞完全贴壁后用无糖培养液培养24 h,加入含有乳酸培养液继续培养4 h后,将6孔板中的细胞用胰酶消化;消化后的细胞按照乳酸测定试剂盒操作步骤检测细胞内乳酸含量,测得的乳酸含量以相应细胞蛋白浓度进行校准。
1.7 细胞克隆形成实验以及CCK-8检测
取对数生长期对照组和MCT1基因敲除组细胞消化后细胞计数,经过稀释后每组取500个细胞接种于6孔板中,待细胞贴壁后更换培养液,以后每2天更换1次新鲜培养液,2~3周后待培养皿中出现肉眼可见单克隆细胞,终止培养;弃去培养液后用PBS清洗3次,4%多聚甲醛室温固定15 min;弃去固定液后用1%结晶紫室温染色30 min,然后缓慢冲洗染色液,空气干燥后记录克隆数并拍照。
同样取上述细胞计数后接种于96孔板中(5000个/孔),每组分别设置5个复孔;等待细胞完全贴壁后吸去96孔板中培养液,第一排加入按1∶9配置的CCK-8工作液,其余孔更换新鲜培养液;并设置未接种细胞的对照孔,加入同样条件配置的CCK-8工作液;避光放置于37℃培养箱中2 h后,450 nm波长下测定加入CCK-8试剂孔内的吸光度值;按照上述操作测定培养24、48、72、96 h后细胞的吸光度值,减去对照组无细胞孔吸光度值后,根据所得值绘制细胞生长曲线。
1.8 GSEA分析
使用GSEA软件(Version 4.0.3)、Molecular Signature Database(MsigDB)数据库中的Hallmark gene sets(Version 7.1)数据集以及GEO数据库中结直肠癌数据集(GSE39582)对MCT1进行GSEA分析[17]。随机组合次数设为1000次,其他设置参数均按照软件默认。
1.9 统计学方法
使用GraphPad Prism 8.0软件进行绘图及数据处理。两组间均数的比较采用t检验,以P<0.05为差异具有统计学意义。所有实验均重复3次。
2 结果
2.1 CRISPRv2-MCT1-KO质粒测序鉴定
构建的CRISPRv2-MCT1-KO#1、CRISPRv2-MCT1-KO #2重组质粒测序结果显示,插入sgRNA的序列、位置、方向均符合预期(图1),表明获得正确表达的重组质粒。
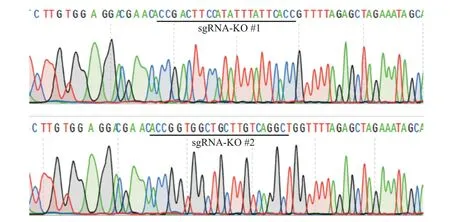
图1 CRISPRv2-MCT1-KO重组质粒测序结果Fig.1 Sequencing results of CRISPRv2-MCT1-KO recombinant plasmids
2.2 MCT1基因敲除RKO细胞系中DNA测序鉴定以及MCT1蛋白表达水平检测
收取对照组与MCT1基因敲除组细胞提取基因组DNA,经PCR扩增后测序,测序结果显示MCT1敲除的细胞碱基序列在两个sg RNA的PAM区之间与野生型相比出现缺失(图2A)。提取细胞总蛋白,Western blot检测显示,MCT1基因敲除细胞未能检测到MCT1蛋白表达(图2B)。
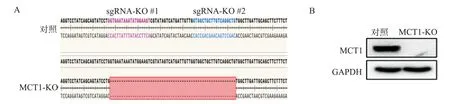
图2 MCT1基因敲除RKO细胞系中MCT1基因测序鉴定以及Western blot检测Fig.2 Sequencing identification and Western blotting detection of MCT1 gene in MCT1-gene-knockout RKO cell lines
2.3 免疫荧光检测MCT1基因敲除RKO细胞系中MCT1蛋白表达分布变化
通过免疫荧光观察,相比对照组细胞,MCT1基因敲除细胞中细胞膜上未能检测到MCT1蛋白表达分布(图3),证明MCT1基因敲除成功。
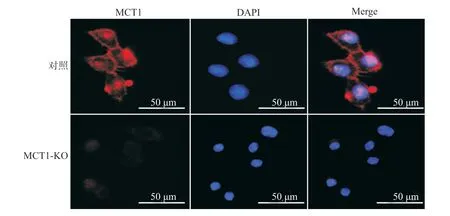
图3 免疫荧光检测MCT1基因敲除RKO细胞系中MCT1蛋白表达分布Fig.3 Immunofluorescence detection of MCT1 protein in MCT1-knockout RKO cell line
2.4 MCT1基因敲除RKO细胞系乳酸摄入能力变化
加入外源性乳酸刺激后,通过比较对照组与MCT1基因敲除组细胞内乳酸含量,发现MCT1基因敲除组细胞内乳酸含量相比对照组细胞减少(图4),表明在RKO细胞中敲除MCT1基因后影响细胞乳酸摄入。

图4 敲除MCT1后RKO细胞系摄入乳酸能力检测Fig.4 Determination of lactic acid uptake capacity of RKO cell lines after MCT1 knockout
2.5 MCT1基因敲除RKO细胞系增殖能力变化
细胞克隆形成实验以及CCK-8检测表明,MCT1基因敲除组细胞增殖能力减弱(图5),提示MCT1基因的表达与结肠癌RKO细胞增殖能力相关。

图5 敲除MCT1后RKO细胞系增殖能力检测Fig.5 Evaluation of proliferation capacity of RKO cell lines after MCT1 knockout
2.6 GSEA分析结果
GSEA分析结果显示,结直肠癌MCT1基因高表达样本中氧化磷酸化通路和MYC信号通路被激活(图6),这说明MCT1可能通过以上两个通路促进结肠癌的发生发展。
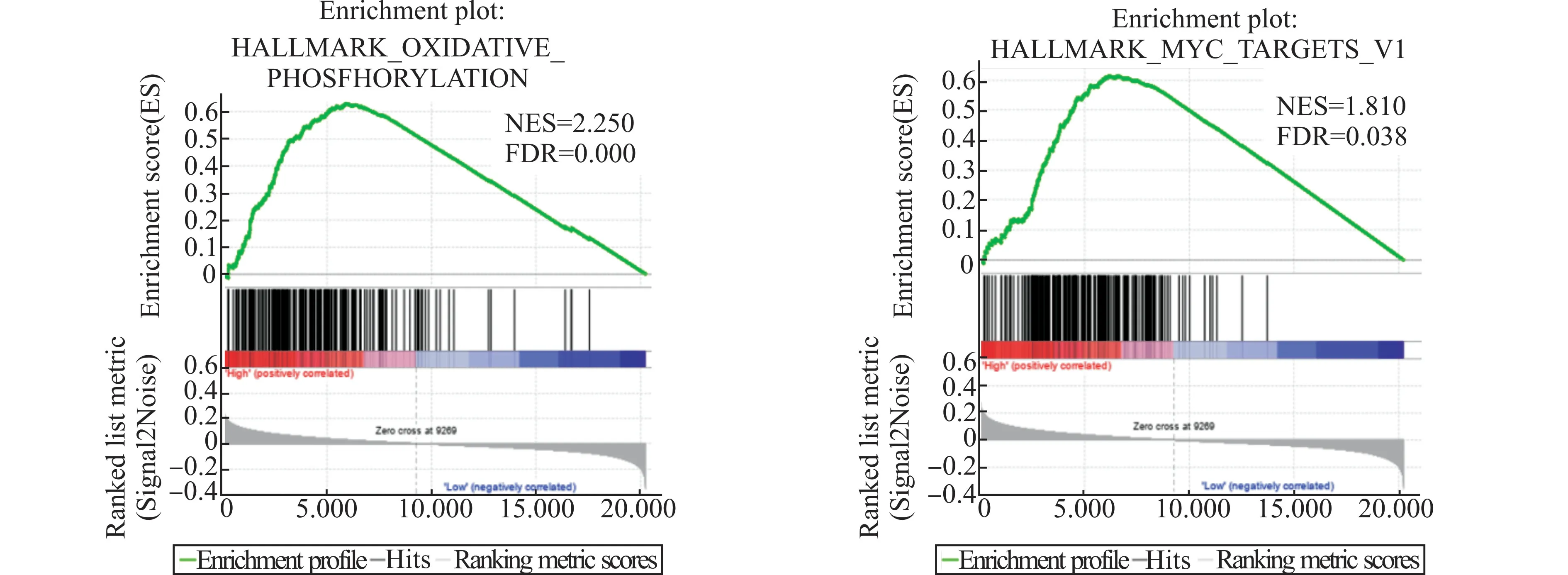
图6 GSEA分析结直肠癌中MCT1功能富集基因集Fig.6 GSEA analysis of MCT1 functional enrichment gene sets in colorectal cancer
3 讨论
MCT1是由SLC16A1基因编码的12次跨膜蛋白,主要参与细胞内外乳酸、丙酮酸、酮体等单羧酸的转运。随着对MCT1在肿瘤中研究的深入,MCT1在肿瘤中的作用越来越被重视。乳酸一直被当作是一种代谢废物,而近年来有研究证实乳酸能够作为肿瘤组织三羧酸循环的代谢底物,在肿瘤的生长过程中发挥重要作用[18],MCT1在肿瘤利用乳酸进行三羧酸循环的过程中起着决定性作用,Faubert等[7]在肺癌中证实癌细胞对乳酸的利用依赖于MCT1。多项研究表明,肿瘤微环境中经MCT1摄入的乳酸通过乳酸脱氢酶氧化为丙酮酸后,可竞争性抑制脯氨酰羟化酶(prolyl hydroxylases,PHDs)与HIF-1α的结合,从而使HIF-1α不能被羟基化诱导降解,进而促进一些血管生长因子的表达,如血管内皮生长因子-A(vascular endothelial growth factor-A,VEGF-A)、血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2)和碱性成纤维细胞生长因子(basic fibroblast growth factor,b FGF),促进肿瘤血管生成[19-21]。在肿瘤微环境中,免疫细胞内MCT1介导的乳酸摄入改变伴随着M2型巨噬细胞的极化增加及Treg细胞抑制功能增强,进而促进肿瘤的免疫逃逸[22-23]。同样有研究证实,高表达MCT1的黑色素瘤细胞通过摄入循环系统中的乳酸拮抗氧化应激,促进循环黑色素瘤细胞的生存,从而增加肿瘤的转移的概率[24]。已有研究表明,氧化磷酸化能促进肿瘤细胞的增殖,MYC也参与了正常细胞的增殖调控[25-26]。我们的GSEA富集分析结果表明,MCT1可能通过调控肿瘤细胞的氧化磷酸化和MYC信号通路,进而促进肿瘤细胞增殖。简而言之,MCT1在肿瘤多种生物学功能中发挥极其重要的作用。
随着基因编辑技术的蓬勃发展,基因编辑领域产生了由RNA引导的核酸酶基因编辑技术——CRISPR/Cas9技术,相比于ZFN和TALEN技术,它具有组成简单、精确性高、操作方便等特点[15]。CRISPR/Cas9系统通过Cas9蛋白结合靶基因并进行切割,利用非同源末端连接使靶基因出现碱基缺失或者插入,从而实现对靶基因的定点敲除或者大片段的删除。在使用CRISPR/Cas9技术构建基因敲除细胞系时,常用的方法有慢病毒法、质粒转染法、核糖核蛋白法(ribonucleoprotein,RNP)等[27]。慢病毒法在感染细胞过程中可能会影响其他基因的表达,并且持续表达Cas9蛋白会对基因编辑过程中的脱靶效应有累积作用;质粒转染法对其他基因影响较小且更容易实施,但其转染效率受到的影响因素较多,并且可能存在一定的免疫原性;RNP法通过电刺激等方法将复合物转染至细胞,Cas9蛋白瞬时表达,脱靶效率低,但可能会导致切割效率降低[28]。
本研究利用CRISPR/Cas9技术构建了稳定敲除人MCT1基因的结直肠癌RKO细胞系,并检测到MCT1基因敲除后RKO细胞对乳酸摄取能力减弱。为进一步研究MCT1对RKO细胞的增殖能力是否存在影响,我们通过克隆形成以及CCK-8实验发现敲除MCT1后RKO细胞增殖能力减弱。综上所述,我们的研究为今后深入研究MCT1在结直肠癌发生发展过程中的功能及其机制提供了良好的实验基础。
