miR-33a-3p通过调控EphA2影响结直肠癌化疗耐药*
2022-02-28黄启友黄晓颖吴清明
姚 菲,黄启友,黄晓颖,张 玲,江 珏,王 强,吴清明,2△
1武汉科技大学医学院感染免疫与肿瘤微环境研究所,武汉 430081
2武汉科技大学职业危害识别与控制湖北省重点实验室,武汉 430081
结直肠癌(colorectal cancer,CRC)是常见的消化道恶性肿瘤,最新的全球癌症数据显示结直肠癌发病率位居世界第3位,病死率居第2位[1]。2020年中国癌症统计报告显示结直肠癌的发病率及死亡率不仅呈现逐年上升的趋势,还呈现出年轻化趋势[2]。化学治疗是中晚期结直肠癌患者辅助治疗的重要方式,目前常用的化疗药物包括氟尿嘧啶类药物与铂类药物,临床上通常将两者联合使用,可有效降低结直肠癌患者复发及转移的风险,从而提高生存率[3]。但患者经过一段时间治疗后容易对这两种结构和作用机制均不同的化疗药物产生交叉耐药,导致化疗效果不理想。因此深入分析结直肠癌患者化疗耐药性形成的原因并探索其作用机制成为目前研究的重难点,对提高肿瘤化疗敏感性具有重要意义。
微小RNA(microRNA,miRNA)是目前研究最成熟的一类非编码RNA,长度约有19~22个核苷酸,可作为癌基因或抑癌基因影响肿瘤的发生发展[4]。miRNA与下游靶基因的3′非编码区特异性结合抑制其表达,从而参与对细胞增殖、迁移、侵袭等生物学过程的调控[5]。化疗耐药形成是一个多步骤、多因素参与的复杂过程,目前涉及多种机制,例如膜转运蛋白异常表达、细胞凋亡异常、DNA损伤修复增强、肿瘤微环境改变等[6]。前期已有研究显示,miRNA可影响肿瘤的化疗耐药性[7-8]。然而,目前有关miRNA是否与结直肠癌氟尿嘧啶类及铂类药物的化疗耐药有关,仍需进一步研究。本课题以结直肠癌细胞HCT8及其5-氟尿嘧啶耐药细胞(HCT8/5-Fu)和顺铂耐药细胞株(HCT8/DDP)为研究对象。前期我们已验证了结直肠癌耐药细胞株HCT8/5-Fu及HCT8/DDP具有明显的化疗耐药性[9]。通过RNA-seq测序发现,miR-33a-3p在耐药细胞株HCT8/5-Fu及HCT8/DDP中低表达,因此我们推测miR-33a-3p可能与结直肠癌的化疗耐药性有关,但目前有关miR-33a-3p的功能尚不明确。因此,本研究构建miR-33a-3p模拟物(miR-33a-3p mimics)并转染至结直肠癌耐药细胞中,探讨miR-33a-3p过表达对耐药细胞的影响及可能的作用机制,为逆转结直肠癌化疗耐药提供理论依据。
1 材料和方法
1.1 实验材料
人结直肠癌细胞系HCT8购自中国典型培养物保藏中心(中国武汉),5-氟尿嘧啶耐药细胞系(HCT8/5-Fu)及顺铂耐药细胞系(HCT8/DDP)购自湖南丰晖生物科技有限公司(中国长沙)。5-氟尿嘧啶(5-Fu)和顺铂(DDP)购自Sigma公司,胎牛血清、0.25%胰酶和RPMI-1640培养液购自Gibco公司,MTT购自上海阿拉丁生化科技股份有限公司。总RNA提取试剂TRIzol、转染试剂脂质体2000购自Invitrogen公司,Real-time PCR逆转录-聚合酶链式反应试剂盒购自TOYOBO公司,SYBR Green Supermix购自Bio-Rad公司。BCA蛋白浓度检测试剂盒购自Biosharp公司,AnnexinⅤ凋亡检测试剂盒购于上海贝博生物公司,Eph A2抗体购自美国Cell Signaling Technology公 司,β-actin抗 体 购 自ABclonal公司。
1.2 实验方法
1.2.1 细胞培养 HCT8、HCT8/5-Fu和HCT8/DDP细胞用含有10%胎牛血清、100 U/m L青霉素和100μg/m L链霉素的RPMI-1640培养液培养,放置于37℃含5% CO2的培养箱中。HCT8/5-Fu和HCT8/DDP细胞在培养的过程中分别加入5 μg/m L 5-氟尿嘧啶和1μg/m L顺铂于培养液中以维持细胞耐药性。
1.2.2 细胞转染 转染前一天将两种结直肠癌细胞分别接种于6孔板中,当细胞汇合度达到50%~60%时,更换培养液。每种耐药细胞分为2组:NC mimics转染组和miR-33a-3p mimics转染组。NC mimics正义链序列为5′-CTCGCTTCGGCAGCACA-3′,反义链序列为5′-CTCGCTTCGGCAGCACA-3′;miR-33a-3p mimics正义链序列为5′-CAAUGUUUCCACAGUGCAUCAC-3′,反义链序列为5′-GAUGCACUGUGGAAACAUUGUU-3′。按照Lipofection 2000说明书进行细胞转染,即各组细胞转染时,分别将10μL Lipofection 2000和5μL mimics(浓度为10μmol/L)加入至100μL Opti-MEM培养液中,并将两者混合后离心于室温放置5 min,随后将上述混合液滴加至6孔板中,于37℃培养箱中培养6~8 h后更换正常培养液,继续培养48~72 h后可用于后续实验研究。
1.2.3 实时荧光定量PCR(q RT-PCR)检测RNA的表达 采用Trizol法提取各组细胞的总RNA,并使用分光光度计检测A260/A280比值,若值在1.8~2.2范围内,则认为RNA纯度较高。根据逆转录试剂盒使用说明将总RNA反转录成cDNA,随后进行q RT-PCR反应。所有引物由上海生工生物工程股份有限公司设计合成,序列见表1。反应条件设置为95℃反应2 min,95℃反应10 s,60℃持续30 s,40个循环。反应结束后,miRNA以U6为内参,m RNA以GAPDH为内参基因,采用2-ΔΔCt法计算RNA相对表达量。

表1 qRT-PCR使用引物序列Table 1 Sequences of the primers in qRT-PCR
1.2.4 MTT检测细胞的化疗敏感性及增殖能力将转染了miR-33a-3p模拟物和其阴性对照的HCT8/5-Fu或HCT8/DDP细 胞 接种于96孔板内,每孔5000个细胞,待细胞密度达70%时加入不同浓度梯度的5-氟尿嘧啶或顺铂处理,继续培养72 h,加入100μL MTT试剂(5 mg/m L)后继续培养4 h,吸弃上清液,每孔加入150μL DMSO,在摇床上摇晃10 min后,用酶标仪在490 nm波长处检测吸光度,并计算细胞存活率。在检测细胞增殖能力过程中,当转染细胞接种于96孔板后,分别于第24、48、72 h加入100μL MTT溶液(5 mg/m L)后继续培养4 h,吸弃上清液,每孔加入150μL DMSO,在摇床上摇晃10 min后,用酶标仪在490 nm波长处检测吸光度,以A值为y轴,时间为x轴绘制细胞生长曲线,评估细胞增殖能力。
1.2.5 流式细胞术检测细胞凋亡及周期 将转染了miR-33a-3p模拟物和阴性对照的两种耐药细胞,胰酶消化后用培养液重悬于离心管中,以1500 r/min速度离心5 min,随后用预冷的PBS重悬细胞后计数,取含有(1~5)×105个细胞的悬液离心弃上清,加入500μL 1×Binding buffer重悬细胞,并加入5μL AnnexinⅤ-FITC及10μL碘化丙啶(PI),室温避光15 min后用流式细胞仪检测细胞凋亡率。检测细胞周期时,向收集于离心管中的细胞加入1 m L预冷的70%乙醇溶液,混合均匀后4℃固定过夜,吸弃固定液后用PBS洗2遍,4℃,1200 r/min,离心5 min,弃上清。每个样品加入500μL配制好的PI染色工作液[包含10μL RNase A Solution(50×)和25μL PI染液],轻轻重悬细胞沉淀,置于37℃避光水浴30 min,4℃避光放置30 min后利用流式细胞仪检测周期变化。
1.2.6 Western blot检测Caspase-3和Eph A2蛋白的表达 收集转染后细胞于1.5 m L EP管中,PBS洗涤2遍后加入RIPA裂解液,使用超声破碎仪破碎细胞,离心后取上清,运用BCA方法检测蛋白浓度。蛋白上样量一般定为20μg,随后加入5×SDS蛋白上样缓冲液,并置于95℃变性5 min。经SDS-PAGE电泳后,将获得的蛋白转移到PVDF膜上,5%脱脂牛奶封闭1 h后,孵育抗体cleaved Caspase-3、Eph A2及β-actin(体积稀释比例均为1∶1000)于4℃过夜。次日收集一抗并用TBST洗膜3次,分别加入辣根过氧化物酶标记的二抗(1∶5000),室温孵育1 h,再用TBST洗膜3次,随后用ECL试剂显影。以β-actin为内参,使用Image J软件分析Eph A2蛋白的相对表达量。
1.3 统计学处理
采用SPSS 25.0软件和Graph Pad Prism 5统计软件进行实验数据统计分析和做图,计量资料均以均数±标准差(±s)表示。两组间均数比较采用独立样本t检验,计数资料组间比较采用χ2检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 miR-33a-3p在结直肠癌耐药细胞中低表达
前期工作我们已证实结直肠癌耐药细胞株HCT8/5-Fu和HCT8/DDP具有化疗耐药性,可以用于后续实验。通过RNA-seq测序我们发现与结直肠癌亲本株相比,miR-33a-3p在两种耐药细胞中均出现显著低表达,随后我们进一步采用实时荧光定量PCR技术检测结直肠癌亲本株及两种耐药细胞株中miR-33a-3p的相对表达水平。检测结果与测序结果一致,即miR-33a-3p在两种耐药细胞中表达水平明显低于亲本株(均P<0.01,图1)。
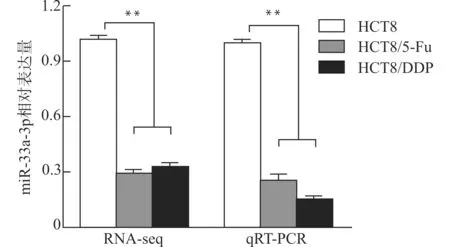
图1 miR-33a-3p在结直肠癌亲本株及耐药株中的表达水平Fig.1 The expression level of miR-33a-3p in colorectal cancer parental and chemoresistant cell lines
2.2 过表达miR-33a-3p可明显抑制结直肠癌耐药细胞增殖
在结直肠癌耐药细胞HCT8/5-Fu和HCT8/DDP中分别转染miR-33a-3p mimics及NC mimics,转染72 h后使用实时荧光定量PCR法检测耐药细胞中miR-33a-3p的表达水平,结果显示,与NC mimics组相比,转染了miR-33a-3p mimics组的miR-33a-3p表达水平显著增高,提示转染成功(图2A)。随后,对成功转染mimics的耐药细胞分别在24、48、72 h进行增殖能力检测,可观察到转染了miR-33a-3p mimics耐药细胞的增殖能力明显被抑制(图2B、2C)。

图2 转染miR-33a-3p模拟物及阴性对照对结直肠癌耐药株增殖能力的影响Fig.2 Effects of transfection of miR-33a-3p mimics and negative control(NC)mimics on the proliferation of colorectal cancer chemoresistant cell lines
2.3 过表达miR-33a-3p可明显促进结直肠癌耐药细胞凋亡
使用流式细胞术检测转染miR-33a-3p mimics及NC mimics后各组细胞凋亡率,在HCT8/5-Fu细胞中转染NC mimics后细胞凋亡率为(13.28±1.25)%,而转染miR-33a-3p mimics的细胞凋亡率为(22.51±2.18)%,差异具有统计学意义(P<0.05)(图3A)。在HCT8/DDP细胞中转染miR-33a-3p mimics时细胞凋亡率为(19.5±0.82)%,较NC组(10.1±0.35)%凋亡率显著增加(P<0.05)(图3B)。同时,我们发现转染了miR-33a-3p mimics的两种细胞的凋亡蛋白cleaved Casapase-3水平明显升高(图3C),提示miR-33a-3p可明显增加耐药细胞的凋亡。
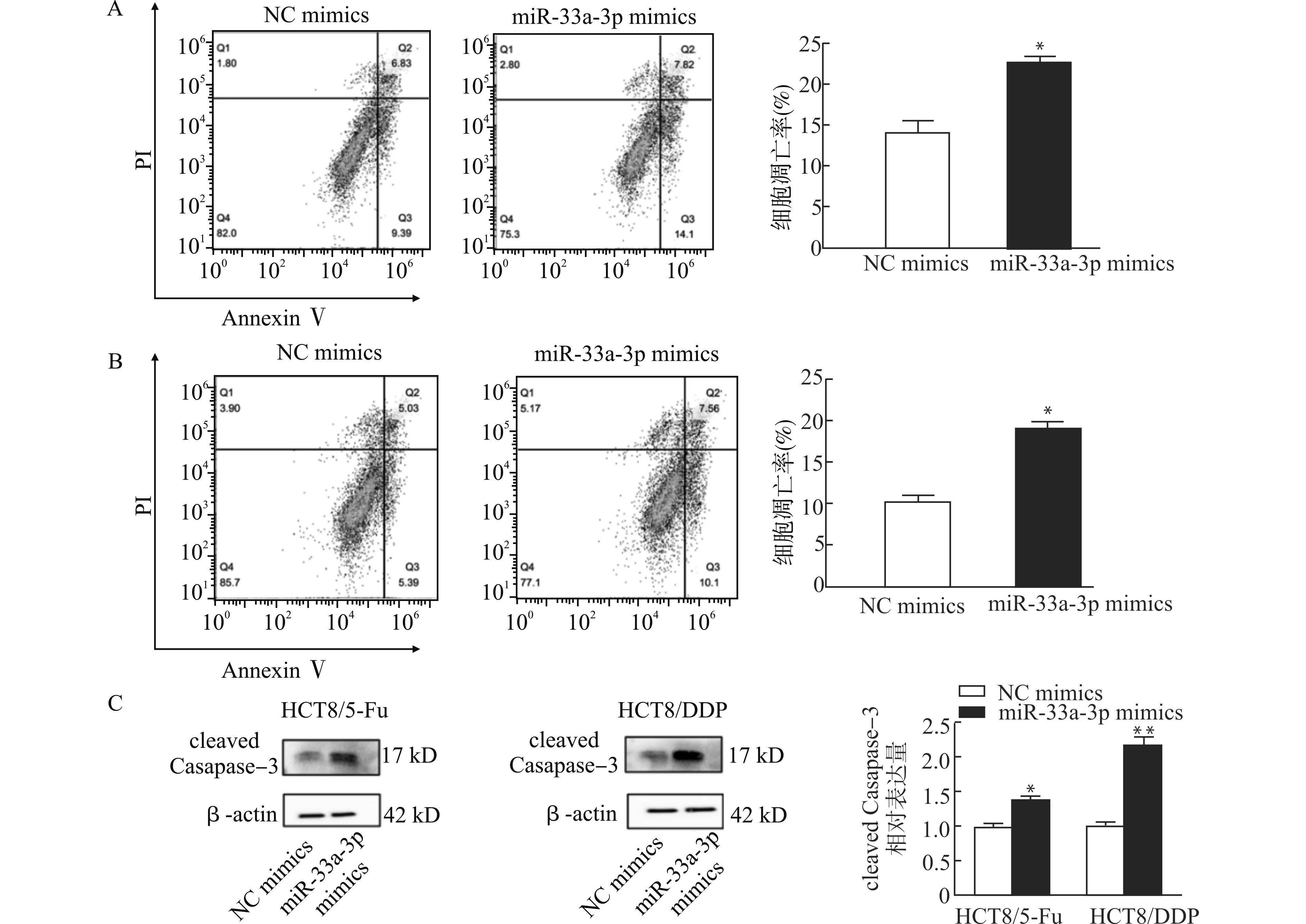
图3 转染miR-33a-3p模拟物及阴性对照对结直肠癌耐药株凋亡的影响Fig.3 Effects of transfection of miR-33a-3p mimics and negative control(NC)mimics on the apoptosis of colorectal cancer chemoresistant cell lines
2.4 过表达miR-33a-3p对结直肠癌耐药细胞周期的影响
在耐药细胞中检测转染miR-33a-3p mimics及NC mimics后分析各组细胞周期分布情况。如图4所示,与对照组相比,转染了miR-33a-3p mimics的两种耐药株细胞处于G1期的百分比与NC mimics转染组相比无明显变化(均P>0.05),但处于S期细胞数显著降低,且G2/M期的细胞数明显增加(均P<0.05),说明miR-33a-3p可使结直肠癌耐药细胞阻滞于G2/M期,从而抑制细胞增殖。

图4 转染miR-33a-3p模拟物及阴性对照对结直肠癌耐药株细胞周期的影响Fig.4 Effects of transfection of miR-33a-3p mimics and negative control(NC)mimics on the cell cycle of colorectal cancer chemoresistant cell lines
2.5 过表达miR-33a-3p增加结直肠癌耐药细胞对化疗药物的敏感性
使用miRanda及TargetScan网站预测miR-33a-3p下游靶基因,预测结果显示,Eph A2可能是miR-33a-3p的下游重要靶基因。因此,我们使用实时荧光定量PCR和蛋白质印迹法检测转染mimics的HCT8/5-Fu和HCT8/DDP细胞中Eph A2的表达水平。结果显示,与NC mimics转染组相比,上调miR-33a-3p表达后,两种耐药细胞内Eph A2的m RNA及蛋白表达水平均明显降低(均P<0.05)(图5)。故我们推测miR-33a-3p可抑制Eph A2表达,对其产生负调控作用。文献报道显示Eph A2高表达与多种肿瘤化疗耐药密切相关[10-11],因此,我们使用MTT实验检测细胞化学敏感性变化,结果显示,对照组与过表达组耐药细胞株的细胞活力均随着给药浓度的增加而降低,当给药浓度相同时,过表达组存活率明显低于对照组(图6A、6C)。IC50计算结果显示,当使用5-氟尿嘧啶干预HCT8/5-Fu细胞时,转染NC-mimics组细胞的IC50值为(158.2±1.37)μg/m L,转 染miR-33a-3p mimics组 细 胞 的IC50值为(77.02±0.23)μg/m L,较对照组显著降低,差异有统计学意义(图6B)。HCT8/DDP耐药细胞转染NC-mimics及miR-33a-3p mimics组的IC50值分别为(9.80±0.97)μg/m L和(4.60±0.18)μg/m L(图6D)。这些结果均提示过表达miR-33a-3p可能通过抑制Eph A2表达增加结直肠癌耐药细胞对化疗药物的敏感性。

图5 结直肠癌耐药细胞株中转染miR-33a-3p模拟物及阴性对照后Eph A2表达水平Fig.5 The expression level of Eph A2 in colorectal chemoresistant cell lines transfected with miR-33a-3p mimics and negative control(NC)mimics

图6 结直肠癌耐药细胞株中转染miR-33a-3p模拟物及阴性对照后化疗敏感性变化情况Fig.6 The sensitivity to 5-Fu or DDP of colorectal cancer chemoresistant cell lines transfected with miR-33a-3p mimics and negative control(NC)mimics
3 讨论
化疗是结直肠癌患者治疗的重要手段,可有效延长患者生存时间,但肿瘤细胞产生耐药性是化疗失败的重要原因。目前,结直肠癌化疗耐药的具体机制尚未完全清楚,主要涉及DNA损伤修复增强、转运蛋白家族表达和功能异常、肿瘤干细胞特性、拓扑异构酶活性改变、细胞凋亡或周期再分布、信号转导通路异常激活等[12-13]。现阶段有文献报道miRNA异常表达与肿瘤耐药产生密切相关。因此,本课题从miRNAs入手研究结直肠癌化疗耐药,为探索耐药机制开辟新的道路。
miRNA是一类长度在19~22个核苷酸的非编码RNA,可以作为癌基因或抑癌基因影响肿瘤的发生与发展。miR-33a位于第22号染色体,成熟的miR-33a长度为22 bp,人体内含有两种同源miR-33a,即hsa-miR-33a-5p和hsa-miR-33a-3p。前 期miR-33a已被报道作为脂质代谢重要的调节分子,近期研究显示miR-33a参与肿瘤生物学过程[14]。如miR-33a在乳腺癌中低表达,当在乳腺癌细胞中过表达miR-33a时可明显抑制细胞生长和迁移,并诱导细胞阻滞在G1期,提示miR-33a作为抑癌基因发挥功能[15]。此外,有文献报道miR-33a-5p在结直肠癌细胞与组织中均低表达,体外实验过表达miR-33a-5p后,结直肠癌细胞的增殖、克隆形成及迁移能力被显著抑制,提示miR-33a-5p与结直肠癌的发生发展过程有关[16]。然而,目前有关miRNA-33a-3p是否与肿瘤化疗耐药有关联还有待证实。
本课题组前期通过RNA-seq测序发现与亲本株相比,miRNA-33a-3p在5-氟尿嘧啶及顺铂结直肠癌耐药细胞中均低表达,并进一步使用荧光定量PCR验证测序结果。为了进一步研究miRNA-33a-3p在结直肠癌化疗耐药中的作用,本课题将合成的miR-33a-3p mimics转染至结直肠癌耐药细胞HCT8/5-Fu和HCT8/DDP,实现在耐药细胞中过表达miR-33a-3p。分别采用MTT方法与流式细胞术 检 测miR-33a-3p模 拟 物 对HCT8/5-Fu和HCT8/DDP细胞增殖、凋亡和周期分布及化疗敏感性变化情况,我们发现与NC mimics转染组相比,过表达miR-33a-3p能够显著抑制HCT8/5-Fu和HCT8/DDP细胞增殖能力,同时可增加细胞凋亡,使周期明显阻滞于G2/M期,我们也发现外源增加miR-33a-3p表达明显提高了HCT8/5-Fu细胞对5-氟尿嘧啶的敏感性,也可增加HCT8/DDP细胞对顺铂的敏感性。为了探索miR-33a-3p增加结直肠癌化疗敏感性的机制,本研究进一步通过生物信息学预测发现Eph A2可能是miR-33a-3p下游分子靶标。Eph A2是酪氨酸激酶受体家族中重要成员,已被报道在许多肿瘤中高表达,广泛参与肿瘤发生发展、侵袭转移及血管生成过程[17-18],Eph A2高表达与患者不良预后密切相关[19]。此外,最新研究报道Eph A2抗体DS-8895a及ALW-Ⅱ-41-27均可有效逆转结直肠癌西妥昔单抗继发耐药,另有文献表明沉默Eph A2可有效恢复结肠癌耐药细胞株细胞Lo Vo/5-FU对化疗药物的敏感性,这表明Eph A2可参与结直肠癌化疗耐药过程[20-22]。随后本研究发现上调miR-33a-3p可明显抑制Eph A2的表达,于是我们推测miR-33a-3p可能通过调控Eph A2逆转结直肠癌化疗耐药,但具体的调控机制还有待更进一步的研究。
综上所述,miR-33a-3p在结直肠癌耐药细胞株中低表达,过表达miR-33a-3p可显著提高耐药细胞对化疗药物的敏感性,可能与降低Eph A2的表达有关,这将为逆转结直肠癌化疗耐药提供新的理论依据。
