姜黄素通过长链非编码RNA NNT-AS1降低LPS诱导的支气管上皮细胞炎症因子表达*
2022-02-28杨丽敏陈志海
杨丽敏,魏 巍,刘 璐,陈志海,张 钰△
1苏州大学附属第一医院呼吸与危重症医学科,苏州 215006
2苏州大学附属无锡九院呼吸与危重症医学科,无锡 214062
近年来,慢性阻塞性肺疾病(chronic obstruc-tive pulmonary disease,COPD)发病率持续增加,已成为全球人类第三大死因,极高的COPD发病率和病死率给社会带来巨大的经济负担[1]。COPD是一种进展性炎症性肺病,气道炎症是其主要特征之一[2]。据报道,各种颗粒或气体吸入可能导致COPD,特别是香烟烟雾的吸入被认为是其发展最重要的危险因素[3]。烟雾能够引起中性粒细胞和淋巴细胞的浸润,并且诱导促炎因子包括白细胞介素-6(interleukin-6,IL-6)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等的变化[4]。有研究发现脂多糖(lipopolysaccharide,LPS)能触发转录因子NF-κB的激活,进而转录产生多种炎症介质,在COPD气道炎症中起着举足轻重的作用[5]。
尽管在COPD的治疗方面已经取得了一些成效,但是传统药物,尤其是皮质类固醇等药效非常有限。因此,开发COPD的预防性药物具有重要意义。姜黄素(curcumin),俗称姜黄,是一种从姜黄根中提取的酚类色素,常用作香料。越来越多的证据表明姜黄素具有多种潜在药理特性,如抗肿瘤、抗氧化、抗炎等[6]。研究显示,NF-κB与COPD气道炎症相关,NF-κB抑制剂可能成为气道炎症性疾病一种新的治疗方法[7]。此前,有文献证明姜黄素可能抑制哮喘模型中NF-κB通路活性[8-9]。然而,人们对姜黄素在LPS诱导的COPD模型中的作用知之甚少。有学者研究发现lncRNA NNT-AS1在COPD肺组织和支气管上皮细胞炎性损伤中发挥重要作用[10]。
本实验研究了姜黄素对LPS诱导BEAS-2B细胞炎症性损伤的影响,分子机制可能与其通过lncRNA NNT-AS1抑制NF-κB通路有关。本研究结果为深入探究姜黄素对COPD治疗作用的潜在机制提供新的线索。
1 材料与方法
1.1 研究对象
以2021年3月至2021年7月在苏州大学附属无锡市第九人民医院呼吸科就诊的30例急性加重期COPD患者作为试验组,以及同一时期30例健康体检者作为对照组。收集所有入组对象一般临床资料,并于入组当天采集外周血标本。排除标准:①合并恶性肿瘤或其他严重的肺部疾病;②充血性心力衰竭,入组前3个月内心肌梗死或入组前1个月内不稳定型心绞痛;③入组前12个月内癫痫发作,既往有脑卒中病史或神经系统疾病影响下肢活动者。
本研究获得苏州大学附属无锡市第九人民医院医学伦理委员会审核批准,取得受试者或其授权家属知情同意并签署知情同意书。
1.2 试剂
支气管上皮细胞BEAS-2B购自中国科学院上海生物化学与细胞生物学研究所。RPMI 1640培养液、胎牛血清(FBS)、胰蛋白酶、青霉素-链霉素(双抗)混合溶液购自美国Hyclone公司;荧光定量试剂盒SYBR Premix Ex Taq TM(Tli RNase HPlus)和反转录试剂盒One Step PrimeScript cDNA Synthesis Kit购自大连宝生物有限公司;兔源一抗GAPDH、NF-κB p65、IκBα以及HRP标记的二抗均购自武汉三鹰生物技术有限公司;CCK-8检测试剂盒和Ed U购自南京曼夫特生物科技有限公司;姜黄素(≥98.0%)购自美国Sigma公司。
1.3 细胞培养及处理
取出冻存的BEAS-2B细胞,水浴锅中复苏后加入8 m L预热的含有10%胎牛血清及1%青霉素-链霉素的培养液,离心后用新鲜培养液重悬细胞,将细胞转移到细胞培养瓶,置于37℃,5%CO2恒温培养箱中培养,待细胞密度达约95%后用0.25%胰蛋白酶进行消化传代。姜黄素和LPS分别用DMSO与PBS稀释,按照1×105/孔的密度将细胞接种于6孔板内,待细胞贴壁后更换成无血清的培养液。次日将细胞分成3组:对照组、LPS处理组、LPS+Curcumin组。LPS组:用终浓度10μg/m L的LPS处理;LPS+Curcumin组:终浓度10μg/m L LPS处理30 min后用5μmol/L的姜黄素处理细胞。
1.4 CCK-8实验
将细胞按照每孔1×104/孔的密度接种到96孔板中,当孔内细胞密度达到50%左右进行处理(如1.3)。分别在处理后0、24、48、72 h,每孔加入5μL的CCK-8溶液,继续培养2 h后加入DMSO终止反应,使用酶标仪在450 nm的波长下测定各孔内吸光度值,以空白为对照,根据各组细胞的平均吸光度值判断各组细胞的增殖情况。
1.5 EdU染色实验
细胞爬片放在12孔板中,随后将细胞按照1×105/孔的密度接种到培养孔中,常规培养待细胞贴壁后进行处理。待细胞处理后24 h,用预热的PBS洗2次后用4%多聚甲醛固定2 h,加入Ed U染色液室温孵育2 h,最后用DAPI进行核染色后在荧光显微镜下进行观察并拍照。
1.6 ELISA检测
外周血样本离心后取上清,转移到干净的离心管中,-20℃长期保存或者直接用于后续实验。细胞处理24 h后收集细胞上清液,用白细胞介素-1β(interleukin-1β,IL-1β)、IL-6、TNF-α和转化生长因子-β(transforming growth factor-β,TGF-β)ELISA检测试剂盒检测各组细胞上清中炎症细胞因子IL-1β、IL-6、TNF-α和TGF-β的含量。使用酶标仪在450 nm的波长下测定各孔内吸光度值,以空白为对照,根据说明书计算并判断各组细胞的增殖情况。
1.7 实时荧光定量PCR(q RT-PCR)实验
细胞处理24 h后,向每孔细胞中加入800μL Trizol试剂提取细胞总RNA,选取1μg质量较好的RNA,使用反转录试剂盒合成cDNA,按照说明书步骤进行。然后以此cDNA为模板进行定量PCR检测,目标基因的表达使用GAPDH作为内参,定量结果采用2-ΔΔCt表示。
引物序列为:lnc RNA NNT-AS1上游引物,5′-ACGTGCAGACAACATCTACCT-3′;下 游 引 物,5′-TACAACACCTTCCCGCAT-′3。GAPDH上游引物,5′-GTGAGGTGACCGCATCTTCT-3′;下游引物,5′-CTTGCCGTGGGTAGAGTCA-3′。
1.8 Western blot检测
细胞处理24 h后,去除旧的培养液,用PBS洗2遍。向每孔细胞中加入150μL蛋白裂解液冰上孵育30 min后离心提取总蛋白。将样本与SDS上样缓冲液按照体积比4∶1混匀,沸水煮10 min使蛋白质变性。样品通过SDS-PAGE电泳凝胶恒压电泳,采用湿转法将凝胶上的蛋白转移至PVDF膜,然后将膜置于5%BSA中封闭2 h。TBST洗3次后4℃一抗(1∶1000)孵育过夜。TBST洗涤PVDF膜3次,每次5 min;第二天室温孵育二抗(1∶4000)1 h。TBST洗涤PVDF膜3次,每次5 min;避光环境中ECL显影,在化学发光仪中曝光并拍照。最终结果表示为目标条带吸光度与内参GAPDH吸光度的比值。
1.9 统计学方法
本研究中所有数据均采用SPSS 20.0软件进行分析,作图用GraphPad Prism 8软件进行。计量资料采用(±s)表示,组间均数比较采用t检验,以P<0.05表示差异具有统计学意义。
2 结果
2.1 COPD患者血清中炎症因子IL-1β、IL-6、TNF-α和TGF-β含量显著升高
通过ELISA检测COPD和对照组血清中IL-1β、IL-6、TNF-α和TGF-β的含量变化情况。结果显示,COPD患者血清中IL-1β、IL-6、TNF-α和TGF-β含量显著升高(均P<0.01)。见图1。

图1 COPD患者血清炎症因子含量Fig.1 The levels of inflammatory factors in serums of COPD patients
2.2 LPS诱导BEAS-2B细胞中lncRNA NNT-AS1表达显著增加
通过定量PCR检测发现,LPS处理支气管上皮细胞BEAS-2B后,细胞lncRNA NNT-AS1相对表达量显著升高(P<0.01)。见图2。

图2 LPS处理对BEAS-2B细胞lncRNA NNT-AS1表达的影响Fig.2 Effect of LPSon lncRNA NNT-AS1 expression in BEAS-2B cells
2.3 LPS诱导BEAS-2B细胞增殖活力增强
为进一步研究LPS处理后BEAS-2B细胞的增殖活力变化情况,我们在LPS处理后通过CCK-8和Ed U实验检测各组细胞的增殖情况。
结果显示,与对照组相比,LPS处理组细胞增殖活力显著增强(P<0.01,图3A),24 h后细胞中Ed U染色阳性率显著增加(图3B)。

图3 LPS处理对BEAS-2B细胞增殖的影响Fig.3 Effect of LPS on proliferation of BEAS-2B cells
2.4 LPS诱导对BEAS-2B细胞中炎症因子的影响
经过LPS处理后,我们通过ELISA检测各组细胞上清中IL-1β、IL-6、TNF-α和TGF-β的含量变化情况。
结果显示,LPS处理后细胞上清中IL-1β、IL-6、TNF-α和TGF-β的含量升高(均P<0.01,图4A~4D)。同时,Western blot检测显示,LPS处理后细胞中NF-κB p65表达显著升高、IκBα表达显著降低(图4E)。

图4 LPS处理对BEAS-2B细胞炎症因子表达的影响Fig.4 Effect of LPS on inflammatory cytokines in BEAS-2B cells
2.5 姜黄素对LPS诱导BEAS-2B细胞中lncRNA NNT-AS1表达和细胞增殖能力的影响
为进一步探索姜黄素对LPS诱导的炎症损伤的保护作用,我们在LPS处理后,加入姜黄素。随后通过定量PCR检测发现姜黄素处理降低了LPS诱导支气管上皮细胞BEAS-2B中lncRNA NNTAS1相对表达量的升高(P<0.01,图5A)。另外,我们发现姜黄素处理减缓了LPS处理引起的细胞增殖能力升高(P<0.01,图5B),24 h后细胞中Ed U染色的阳性率较LPS组减少(图5C)。
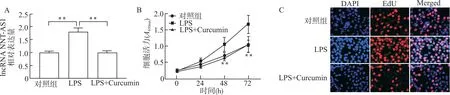
图5 姜黄素处理对LPS诱导BEAS-2B细胞增殖的影响Fig.5 Effect of curcumin on LPS-induced proliferation of BEAS-2B cells
2.6 姜黄素对LPS诱导BEAS-2B细胞中炎症因子变化的影响
为揭示姜黄素对LPS诱导的炎症损伤的保护作用机制,我们在LPS处理后,加入姜黄素。通过ELISA检测各组细胞上清中IL-1β、IL-6、TNF-α和TGF-β的含量变化情况。结果显示,姜黄素处理后减弱了因为LPS处理引起的细胞中IL-1β、IL-6、TNF-α和TGF-β的含量变化(均P<0.01,图6A~6D)。同时,Western blot检测显示,姜黄素处理后减缓了LPS处理引起的细胞中NF-κB p65表达的升高、IκBα表达的降低(图6E)。

图6 姜黄素处理对LPS诱导BEAS-2B细胞炎症因子的影响Fig.6 Effect of curcumin on LPS-induced inflammatory cytokines in BEAS-2B cells
3 讨论
本研究通过ELISA检测30例COPD患者和30例健康对照人群血清中细胞炎症因子含量的变化情况,发现COPD患者血清中IL-1β、IL-6、TNF-α和TGF-β含量均显著升高。COPD患者体内的内毒素和免疫复合物能够刺激巨噬细胞系统和内皮细胞不断地产生IL-1β、IL-6和TNF-α因子,进而直接启动炎症反应损伤内皮细胞,或者通过刺激其他炎症因子,引起机体炎症级联反应[11-13]。因此COPD患者不仅表现出气道炎症,同时也表现出轻度全身炎症[14]。支气管上皮细胞主要参与COPD气道病理进程的免疫和炎症反应[15]。为研究COPD气道炎症的病理机制,本研究利用LPS刺激支气管上皮细胞构建气道炎症模型。结果显示LPS增加了IL-1β、IL-6、TNF-α和TGF-β的水平,同时NF-κB p65表达升高,而IκBα表达降低。Jang等[16]证实LPS刺激支气管上皮细胞会释放包括IL-1β、IL-6、TNFα等炎症介质。NF-κB已被报道在多种炎症性疾病中发挥重要作用,NF-κB p65和IκBα是其中关键因子[17-19]。我们的结果提示LPS能够激活NF-κB信号,诱导细胞炎性因子表达。越来越多的证据支持NF-κB在COPD的发病机制中起重要作用,且IL-1β、IL-6、TNF-α等炎症因子的升高,能够进一步活化NF-κB信号,促进炎症反应[20]。
很多研究已经证明传统中草药姜黄素可调节多种转录因子、炎症调节因子、细胞粘附因子活性,具有抗炎作用[21]。在本研究中,我们发现姜黄素显著抑制LPS诱导的BEAS-2B细胞的增殖,有效地减轻由支气管上皮细胞释放的炎症介质IL-1β、IL-6、TNF-α和TGF-β的增加。气道壁厚由上皮细胞增生引起,与COPD的严重程度密切相关[22]。研究显示,姜黄素能够缓解小鼠气道炎症反应、阻止气道重建,延缓COPD进展[23]。提示姜黄素对COPD的保护作用可能与抑制支气管上皮细胞的增殖有关。我们还发现姜黄素明显抑制LPS刺激的BEAS-2B细胞中NF-κB的表达升高和IκBα的表达降低,说明姜黄素能够抑制NF-κB信号、调控支气管上皮细胞炎症损伤。研究显示LPS能够通过IκB激酶依赖性磷酸化降解IκBα,激活NF-κB信号,引起炎症损伤[24-25]。IL-6与TGF-β共同作用诱导气道炎症和气道改造,而姜黄素能够抑制中性粒细胞的募集和TGF-β的表达,缓解LPS诱导的气道炎症[26-27],与本研究结论一致。
lncRNAs的异常表达已被证实是多种肺部疾病的分子特征。已有lncRNA被报道在肺炎中能介导LPS诱导的细胞凋亡和炎症损伤[28]。本研究结果显示,LPS能够促进支气管上皮细胞BEAS-2B中lnc RNA NNT-AS1的表达,而姜黄素抑制了LPS诱导的BEAS-2B细胞中lncRNA NNT-AS1的表达。之前的研究显示lnc RNA NNT-AS1在COPD组织和支气管上皮细胞炎性损伤中异常上调,下调lncRNA NNT-AS1可减弱支气管上皮细胞异常增殖,抑制气道炎症反应[10]。以上研究提示姜黄素可能通过下调lncRNA NNT-AS1减轻支气管上皮细胞炎性损伤。
综上所述,本研究发现COPD患者血清中IL-1β、IL-6、TNF-α和TGF-β含量升高,可能引起级联反应导致患者支气管上皮细胞炎性损伤。姜黄素则能够通过下调lncRNA NNT-AS1表达,抑制NFκB信号活性,缓解LPS诱导的炎症因子释放,保护支气管上皮细胞。本研究结果可以为姜黄素治疗COPD患者气道炎症的研究提供理论基础。
