急性肺栓塞大鼠肺组织中H-FABP表达的变化及意义*
2022-02-28张黎,周英,全晶,何旭,陈军
张 黎,周 英,全 晶,何 旭,陈 军
昆明理工大学附属医院,云南省第一人民医院老年医学科,昆明 650032
急性肺栓塞(acute pulmonary embolism,APE)是临床常见的急危重症,具体指来自体循环的各种栓子堵塞肺动脉及其分支并引起呼吸循环衰竭的临床病理生理综合征,救治难度大、病死率高[1]。在APE的发病过程中,血栓阻塞肺动脉是直接的病理生理改变,与这一改变相关的因素包括血小板的活化和聚集、炎症反应的激活等,但具体的分子机制尚不十分清楚,临床上也缺乏靶向治疗的手段。心型脂肪酸结合蛋白(heart-type fatty acid binding protein,H-FABP)是最早在心肌中发现的脂肪酸结合蛋白,可作为评价心肌损伤的标志物。近些年肾脏相关的研究发现H-FABP的高表达与急性肾损伤的发生有关,抑制H-FABP的表达能够减轻肾脏足细胞的损伤[2-3];APE相关的研究发现,血清HFABP对APE的发病具有预测价值[4]。但APE发病过程中H-FABP表达的变化及意义尚不清楚。因此,本研究将通过动物实验系统探究APE大鼠肺组织中H-FABP的表达及其与血小板活化、炎症反应激活的关系。
1 材料与方法
1.1 实验动物
清洁级SD雄性大鼠、体质量180~200 g、8~10周龄,购自上海斯莱克公司,许可证:SCXK(沪)2017-0005。
1.2 试剂与仪器
阴性对照(negative control,NC)-shRNA腺病毒、H-FABP-shRNA腺病毒购自上海吉玛公司,苏木精-伊红(HE)染色试剂盒购自上海碧云天公司,血小板活化指标及细胞因子的酶联免疫吸附法试剂盒购自上海西唐生物公司,H-FABP、核转录因子-κB(nuclear factor-κB,NF-κB)的一抗购自美国Abcam公司。
1.3 方法
1.3.1 动物分组、造模、干预及取材 实验动物随机分为对照组、APE组、NC-sh RNA组、NC-sh RNA+APE组、H-FABP-sh RNA+APE组,每 组各10只。采用自体血栓法建立APE模型:经大鼠自身眶静脉取血0.5 m L,凝血后制成直径0.5 mm的颗粒状血栓混悬液;而后钝性分离右侧颈总静脉,迅速注入0.5 m L血栓混悬液,当大鼠出现明显发绀和呼吸加快、加深时,则视为造模成功。为敲低HFABP的表达,本研究设计了H-FABP sh RNA的腺病毒、通过尾静脉注射的方式进行H-FABP的敲低,同时以注射NC-shRNA腺病毒的动物作为对照。NC-shRNA组、NC-shRNA+APE组、H-FABP-shRNA+APE组在造模前3 d给予腺病毒,剂量为109pfu/只尾静脉注射。造模后6 h,麻醉大鼠并取肺组织、血液样本;肺组织分为两份,一份用4%多聚甲醛固定后石蜡包埋保存,一份用液氮冷冻后放置在-80℃保存;血液样本离心分离血清,放置在-80℃保存。
1.3.2 血清指标检测 取血清标本,采用酶联免疫吸附法试剂盒检测血栓素A2(TXA2)、P-选择素(CD62P)、血清溶酶体颗粒糖蛋白63(CD63)的含量,按照试剂盒说明书进行操作。
1.3.3 肺组织病理改变的检测 取肺组织蜡块标本,制作病理切片后采用HE染色试剂盒进行染色,按照试剂盒说明书进行操作,染色后在显微镜下观察肺组织病理改变。
1.3.4 肺组织中蛋白表达的检测 取液氮冷冻的肺组织标本,加入裂解液提取蛋白,蛋白样本加入聚丙烯酰胺凝胶进行Western blot检测,电泳、电转移至PVDF膜,5%脱脂牛奶室温封闭PVDF膜1 h,1∶2000稀释的H-FABP、NF-κB一抗或1∶5000稀释的β-actin一抗4℃孵育PVDF膜过夜;1∶2000稀释的二抗室温孵育PVDF膜1 h,在凝胶成像系统中显影得到蛋白条带,根据条带的灰度值以β-actin为内参计算目标蛋白H-FABP、NF-κB的表达水平。
1.3.5 肺组织中细胞因子含量的检测 取液氮冷冻的肺组织标本,加入裂解液后匀浆,采用酶联免疫吸附法试剂盒检测单核细胞趋化蛋白(MCP-1)、肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)的含量,按照试剂盒说明书进行操作。
1.4 统计学方法
采用SPSS 21.0软件进行统计学分析,实验数据均为计量资料,两组间均数比较采用t检验,多组间均数比较采用方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 APE组大鼠肺组织中H-FABP表达的变化
APE组大鼠肺组织中H-FABP的表达水平显著高于对照组,差异有统计学意义(P<0.05)。见图1。
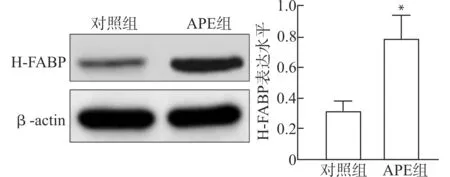
图1 APE组大鼠与对照组大鼠肺组织中H-FABP表达水平的比较Fig.1 Comparison of H-FABP in lung tissue of rats between APE group and control group
2.2 尾静脉注射H-FABP shRNA腺病毒敲低APE大鼠肺组织中H-FABP表达的效果
NC-sh RNA+APE组大鼠肺组织中H-FABP的表达水平显著高于NC-sh RNA组(P<0.05);HFABP-sh RNA+APE组大鼠肺组织中H-FABP的表达水平显著低于NC-sh RNA+APE组(P<0.05)。见图2。
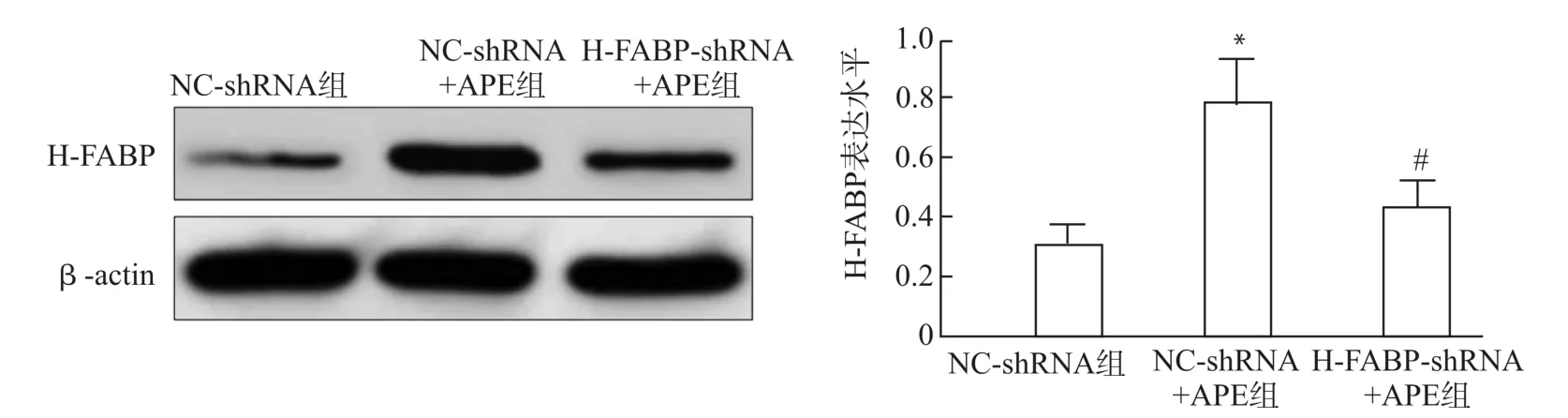
图2 NC-shRNA组、NC-sh RNA+APE组、H-FABP-sh RNA+APE组大鼠肺组织中H-FABP表达水平的比较Fig.2 Comparison of H-FABP in lung tissue of rats among NC-sh RNA group,NC-sh RNA+APE group,and H-FABP-shRNA+APE group
2.3 敲低H-FABP对APE大鼠血清中血小板活化指标的影响
NC-sh RNA+APE组大鼠的血清CD62P、CD63、TXA2含量显著高于NC-sh RNA组(均P<0.05);H-FABP-sh RNA+APE组大鼠的血清CD62P、CD63、TXA2含量显著低于NC-sh RNA+APE组(均P<0.05)。见表1。

表1 NC-shRNA组、NC-shRNA+APE组、H-FABP-sh RNA+APE组大鼠血小板活化指标的比较Table 1 Comparison of platelet activation indicators of rats among NC-shRNA group,NC-shRNA+APE group,and H-FABP-shRNA+APE group
2.4 敲低H-FABP对APE大鼠肺组织病理改变的影响
NC-shRNA组肺组织的结构形态正常,未出现病理改变;NC-sh RNA+APE组大鼠肺组织出现肺动脉内血栓形成、肺泡内渗出物增多、肺泡间隔内炎症细胞浸润等APE典型病理改变;H-FABP-sh RNA+APE组大鼠肺组织的病理改变较NC-sh RNA+APE组改善。见图3。
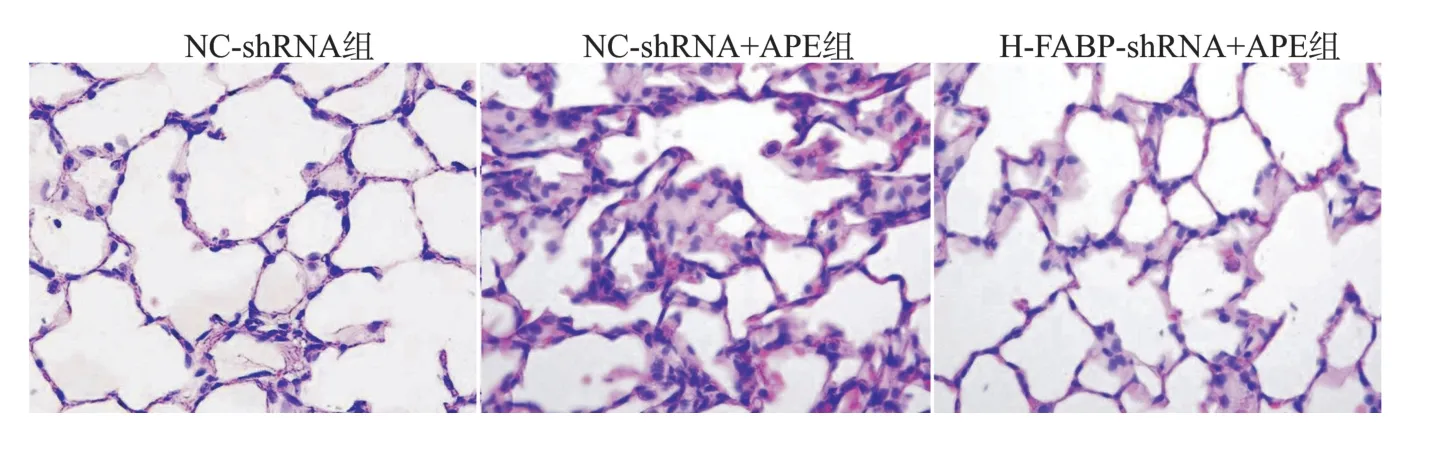
图3 NC-shRNA组、NC-shRNA+APE组、H-FABP-shRNA+APE组大鼠肺组织病理改变的比较(苏木精-伊红染色,×400)Fig.3 Comparison of lung tissue pathological changes of rats among NC-shRNA group,NC-shRNA+APE group,and H-FABP-shRNA+APE group(HE staining,×400)
2.5 敲低H-FABP对APE大鼠肺组织中炎症反应的影响
NC-sh RNA+APE组大鼠肺组织中NF-κB的表达水平及MCP-1、TNF-α、IL-1β的含量显著高于NC-sh RNA组(均P<0.05);H-FABP-sh RNA+APE组大鼠肺组织中NF-κB的表达水平及MCP-1、TNF-α、IL-1β的 含 量 显 著 低 于NC-sh RNA+APE组(均P<0.05)。见图4、表2。

表2 NC-shRNA组、NC-shRNA+APE组、H-FABP-shRNA+APE组大鼠肺组织炎症细胞因子的比较Table 2 Comparison of inflammation cytokines of rats among NC-shRNA group,NC-shRNA+APE group,and H-FABP-shRNA+APE group
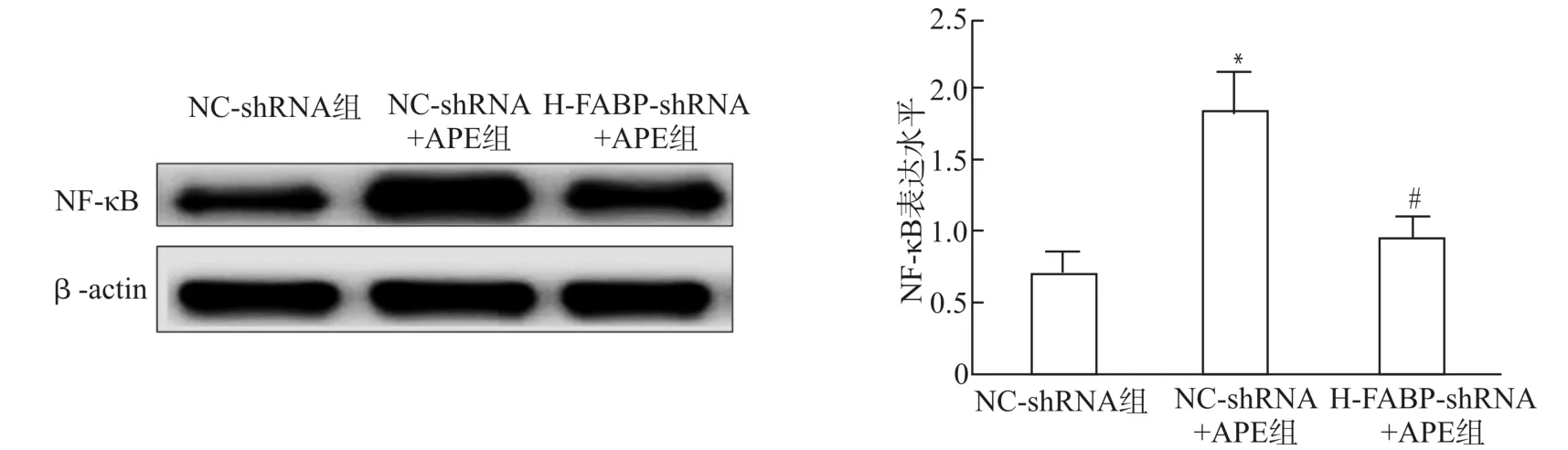
图4 NC-shRNA组、NC-shRNA+APE组、H-FABP-shRNA+APE组大鼠肺组织中NF-κB的比较Fig.4 Comparison of NF-κB in lung tissue of rats among NC-shRNA group,NC-shRNA+APE group,and H-FABP-shRNA+APE group
3 讨论
H-FABP又称为FABP3,最早在心肌细胞内发现并被用作评估心肌损伤的标志物[5-6]。近年来的分子生物学研究证实H-FABP不仅参与心肌细胞能量代谢的调控[7-8],还在肾脏足细胞[3]、肺泡上皮细胞[9]的损伤中起重要作用。在脂肪酸引起肾脏足细胞损伤、脂多糖引起肺泡上皮细胞损伤的过程中,H-FABP表达增加并且促进炎症反应、氧化应激、内质网应激、细胞凋亡等生物学环节的发生。本研究以H-FABP作为标志物,对APE的发病机制进行了探究。
在APE的发病过程中,血小板的活化和聚集、炎症反应的级联放大激活是与病情发展变化密切相关的因素。当来自体循环的各种栓子堵塞肺动脉及其分支后,一方面直接造成动脉栓塞、组织缺血坏死;另一方面则在栓塞局部大量招募血小板及炎症细胞,进而造成血栓加重、缺血坏死范围扩大,并且血小板的活化和炎症细胞的激活具有相互促进的作用[10-12]。目前,APE的发病机制尚不十分清楚,本研究以H-FABP作为靶点,通过自体血栓法建立APE大鼠模型后检测到APE大鼠肺组织中HFABP的表达水平明显增加,表明H-FABP的高表达与APE的发病有关。
为了阐明H-FABP在APE发病中的作用,本研究通过尾静脉注射sh RNA腺病毒的方式对APE大鼠肺组织中高表达的H-FABP进行敲低,观察了敲低H-FABP后肺组织的病理改变。与注射NC sh RNA腺病毒的大鼠比较,注射NC sh RNA腺病毒后进行APE造模大鼠的肺组织出现了肺动脉内血栓形成、肺泡内渗出增多、肺泡间隔内炎症细胞浸润等APE典型病理改变;注射H-FABP sh RNA腺病毒后进行APE造模,大鼠肺组织的APE病理改变明显减轻,表明敲低H-FABP能够改善APE病理改变,高表达的H-FABP促进APE的发生。
血小板的活化和聚集、炎症反应的级联放大激活是与APE发生及发展密切相关的因素,Gao等[3]的研究已经证实H-FABP对炎症反应的激活具有促进作用,本研究进一步分析了H-FABP在APE发病过程中对血小板活化及炎症反应激活的调控作用。CD62P、CD63是血小板活化后的表面标志物,TXA2是血小板活化后脱颗粒释放的产物。三者可作为评价血小板活化程度的指标,也有研究报道APE大鼠血清中上述三项指标的含量增加[13]。本研究检测到注射H-FABP shRNA腺病毒后APE大鼠血清中CD62P、CD63、TXA2的含量降低,表明敲低H-FABP抑制APE大鼠血小板活化。NF-κB是调控炎症反应的关键转录因子,能够启动下游促炎因子MCP-1、TNF-α、IL-1β的表达[14-15]。本研究检测到注射H-FABP sh RNA腺病毒后APE大鼠肺组织中NF-κB的表达水平及MCP-1、TNF-α、IL-1β的含量均降低,表明敲低H-FABP抑制APE大鼠肺组织中炎症反应的激活。
综上所述,本研究结果表明肺组织中H-FABP表达增加与APE的发病有关,敲低H-FABP能够抑制血小板活化及炎症反应激活,高表达的HFABP可能在APE的发病过程中促进血小板的活化和聚集、炎症反应的级联放大激活。
