湿寒证大鼠模型的构建及其评价
2022-02-28穆妮热排尔哈提古丽娜孜肉孜买买提明努尔买买提海力里麦麦提阿衣努尔买提斯迪克
穆妮热·排尔哈提,古丽娜孜·肉孜,买买提明·努尔买买提,海力里·麦麦提,阿衣努尔·买提斯迪克
(新疆医科大学维吾尔医学院,乌鲁木齐 830011)
证候是中医学认识疾病的主要模式,是中医四诊信息的高度概括和归纳[1],证候模型是研究疾病发生发展的有效工具[2].,病因造模法是证候模型的经典制备思路[3].。传统医学认为,环境、膳食及精神因素是导致证候的潜在病因。本研究选取临床湿寒证致病因素(湿寒环境及膳食)施加于实验大鼠,观察大鼠外在生物表征,测定相关指标的变化,并“以方测证”来证实模型成立,为湿寒证本质研究提供模型支持。
1 材料与方法
1.1 动物SPF 级雌性SD 大鼠30只,体重(240±10)g,由新疆医科大学实验动物中心提供,合格证号:IACUC20190916-01,动物生产许可证[ SCXK(新)2018-0002]。适应性喂养5 d 按随机数字表法随机分为3 组,正常对照组、湿寒证模型组、药物反证组,各组10 只。
1.2 主要试剂与仪器ACTH 试剂盒(武汉贝茵莱生物科技有限公司,批号202009) ; CORT 试剂盒(武汉贝茵莱生物科技有限公司,批号202009);湿寒证对应方(新疆维吾尔自治区维吾尔医院提供,标准号MZJW-0113-2013);寒凉性饲料(委托江苏省协同医药生物工程有限责任公司加工);RQH-350 型人工气候箱(上海精宏实验设备有限公司);S-3400N型扫描电镜(日本日立公司)。
1.3 模型建立与给药方法湿寒证模型组给予寒凉性饲料(基础饲料70%+芫荽实、菠菜实30%),控制人工气候箱条件,模拟湿寒饲养环境[室温(6±1)℃,相对湿度85%~95%],外加冷水游泳[(水温:(6±1)℃,1 d/次、持续5 min]等因素持续刺激24 d,观察不同时间段相关指标的变化,并与正常对照组进行比较;药物反证组,造模的第1天开始,受湿寒应激前1 h灌胃湿寒证对应方药,给药浓度为0.35 g/100 g,灌胃容量为1mL/100 g,相当于临床用量等效剂量的6 倍,每日1次,连用24 d,观察相关指标,并与正常对照组、湿寒证模型组进行比较。
1.4 观察指标
1.4.1 大鼠外观表征 观察并记录各组大鼠的外观表征并评分,见表1。
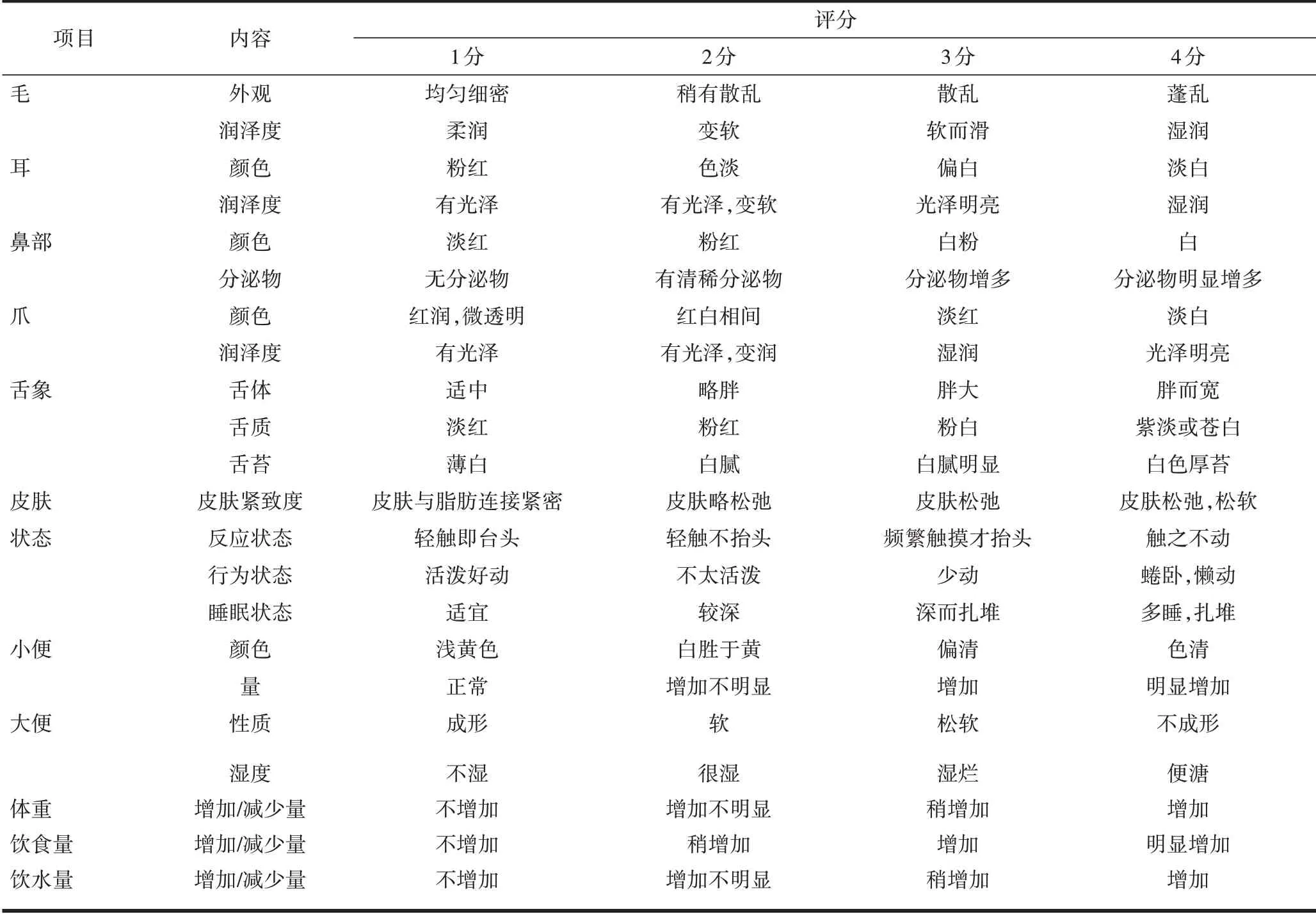
表1 大鼠外观表征评分表
1.4.2 定量指标 体重:每日固定时间称量;摄食量=(每笼中加入饲料量-24 h 后剩余量)/大鼠只数;摄水量=(每笼中加入饮用水量-24 h 后剩余量)/大鼠只数。
1.4.3 大鼠血清ACTH、CORT 的测定 Elisa 法检测大鼠血清ACTH、CORT 水平,按照试剂盒说明书进行操作。
1.4.4 舌体表面组织形态学观察 取材后,将舌体样本置于扫描电镜下,观察舌体显微结构。
1.5 统计学分析采用SPSS 23.0 进行数据分析,所有数据进行正态性检验,并进行方差齐性检验;体征评分值,体重、摄食水量用一般线性模型(general lin⁃er model)重复测量法进行方差分析;大鼠血清应激相关指标用单因素方差分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 大鼠外观表征观察结果造模结束时,正常对照组体毛稠密光滑,行动活泼,精神佳,食欲可,眼睛明亮,反应尚可,大小便正常;湿寒证模型组大鼠一般状态有不同程度的改变,鼻部、爪部色泽变淡,舌质暗,舌苔白腻明显,蜷卧少动,大便湿软,尿色清;药物反证组大鼠精神状态一般,反应尚灵活,体毛稍有散乱,鼻部、爪部色泽红润或稍淡,大便偶有干湿不调。
2.2 3 组大鼠外观表征评分的比较造模前各组间外观表征评分值比较,差异均无统计学意义(P>0.05)。造模第6、9、12、15、18、21、24 天,湿寒证模型组体征评分值均高于正常对照组与药物反证组,与正常对照组相比,差异有统计学意义(P<0.05)。造模第21、24天时药物反证组与正常对照组相比,差异无统计学意义(P>0.05),与湿寒证模型组相比,差异有统计学意义(P<0.05)。见表2。
表2 3组大鼠在不同时间点外观表征评分的比较(分,±s)
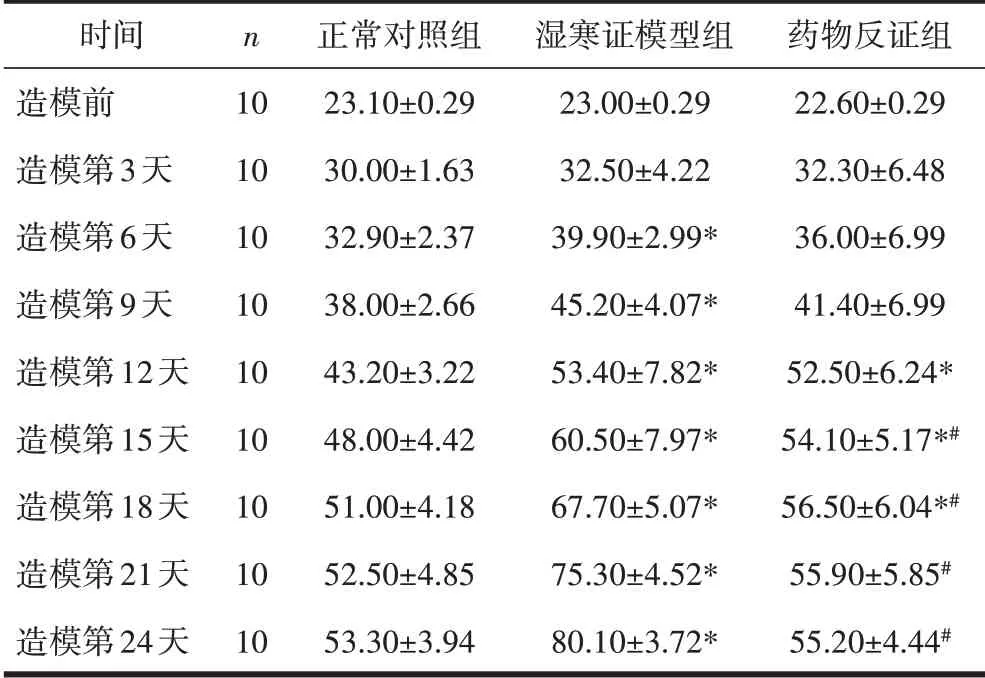
表2 3组大鼠在不同时间点外观表征评分的比较(分,±s)
注:与同一时间点的正常对照组比较,*P<0.05;与同一时间点的湿寒证模型组比较,#P<0.05。
时间造模前造模第3天造模第6天造模第9天造模第12天造模第15天造模第18天造模第21天造模第24天n 10 10 10 10 10 10 10 10 10正常对照组23.10±0.29 30.00±1.63 32.90±2.37 38.00±2.66 43.20±3.22 48.00±4.42 51.00±4.18 52.50±4.85 53.30±3.94湿寒证模型组23.00±0.29 32.50±4.22 39.90±2.99*45.20±4.07*53.40±7.82*60.50±7.97*67.70±5.07*75.30±4.52*80.10±3.72*药物反证组22.60±0.29 32.30±6.48 36.00±6.99 41.40±6.99 52.50±6.24*54.10±5.17*#56.50±6.04*#55.90±5.85#55.20±4.44#
2.3 不同时间点3 组大鼠体重的变化造模前和造模第3、6 天,各组间体重比较,差异均无统计学意义(P>0.05)。造模第9、12、15、18 天,湿寒证模型组、药物反证组与正常对照组相比,差异均有统计学意义(P<0.05)。造模第21、24 天,药物反证组的体重升高,与正常对照组相比,差异无统计学意义(P>0.05),与湿寒证模型组相比,差异有统计学意义(P<0.05)。见表3。
表3 3组大鼠在不同时间点上的体重比较(g,±s)
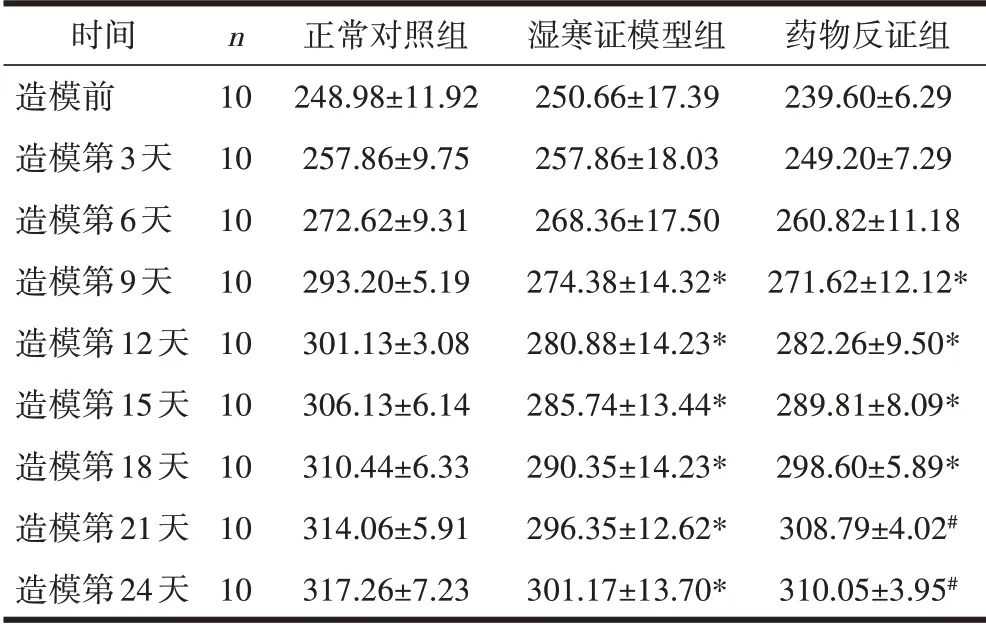
表3 3组大鼠在不同时间点上的体重比较(g,±s)
注:与同一时间点的正常对照组比较,*P<0.05;与同一时间点的湿寒证模型组比较,#P<0.05。
时间造模前造模第3天造模第6天造模第9天造模第12天造模第15天造模第18天造模第21天造模第24天n 10 10 10 10 10 10 10 10 10正常对照组248.98±11.92 257.86±9.75 272.62±9.31 293.20±5.19 301.13±3.08 306.13±6.14 310.44±6.33 314.06±5.91 317.26±7.23湿寒证模型组250.66±17.39 257.86±18.03 268.36±17.50 274.38±14.32*280.88±14.23*285.74±13.44*290.35±14.23*296.35±12.62*301.17±13.70*药物反证组239.60±6.29 249.20±7.29 260.82±11.18 271.62±12.12*282.26±9.50*289.81±8.09*298.60±5.89*308.79±4.02#310.05±3.95#
2.4 不同时间点3 组大鼠摄食量的变化造模前和造模第3 天,各组间摄食量比较,差异均无统计学意义(P>0.05)。造模后第9、12、15、18 天,湿寒证模型组摄食量增加,与正常对照组、药物反证组相比,差异有统计学意义(P<0.05)。造模第21、24 天,药物反证组摄食量与正常对照组相比,差异无统计学意义(P>0.05),与湿寒证模型组相比,差异有统计学意义(P<0.05)。见表4。
表4 3组大鼠在不同时间点上的摄食量比较(g,±s)
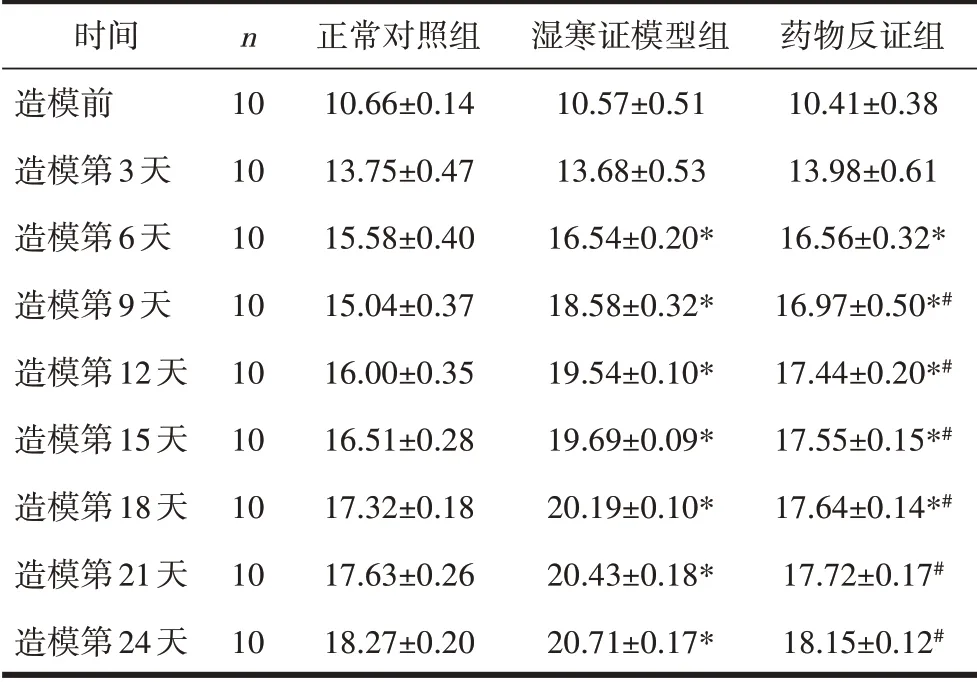
表4 3组大鼠在不同时间点上的摄食量比较(g,±s)
注:与同一时间点的正常对照组比较,*P<0.05;与同一时间点的湿寒证模型组比较,#P<0.05。
时间造模前造模第3天造模第6天造模第9天造模第12天造模第15天造模第18天造模第21天造模第24天n 10 10 10 10 10 10 10 10 10正常对照组10.66±0.14 13.75±0.47 15.58±0.40 15.04±0.37 16.00±0.35 16.51±0.28 17.32±0.18 17.63±0.26 18.27±0.20湿寒证模型组10.57±0.51 13.68±0.53 16.54±0.20*18.58±0.32*19.54±0.10*19.69±0.09*20.19±0.10*20.43±0.18*20.71±0.17*药物反证组10.41±0.38 13.98±0.61 16.56±0.32*16.97±0.50*#17.44±0.20*#17.55±0.15*#17.64±0.14*#17.72±0.17#18.15±0.12#
2.5 不同时间点3 组大鼠摄水量的变化造模前和造模第3 天,各组间摄水量比较,差异均无统计学意义(P>0.05)。造模后第9、12、15、18 天,湿寒证模型组、药物反证组摄水量减少,与正常对照组相比,差异均有统计学意义(P<0.05)。造模第21、24 天,药物反证组摄水量与正常对照组相比,差异无统计学意义(P>0.05),与湿寒证模型组相比,差异有统计学意义(P<0.05)。见表5。
表5 3组大鼠在不同时间点上的摄水量比较(mL,±s)

表5 3组大鼠在不同时间点上的摄水量比较(mL,±s)
注:与同一时间点的正常对照组比较,*P<0.05;与同一时间点的湿寒证模型组比较,#P<0.05。
时间造模前造模第3天造模第6天造模第9天造模第12天造模第15天造模第18天造模第21天造模第24天n 10 10 10 10 10 10 10 10 10正常对照组17.39±0.15 18.27±0.27 20.40±0.28 22.04±0.40 23.51±0.59 24.61±0.58 25.43±0.55 25.79±0.47 26.26±0.33湿寒证模型组17.49±0.26 18.22±0.15 19.50±0.30*20.12±0.14*20.58±0.07*21.54±0.10*22.44±0.06*22.80±0.25*23.11±0.05*药物反证组17.37±0.26 18.19±0.73 19.59±0.09*21.56±0.23*#22.46±0.04*#23.95±0.49*#24.83±0.04*#25.66±0.16#26.11±0.27#
2.6 血清ACTH、CORT 的变化结果慢性应激后,湿寒证模型组大鼠血清ACTH、CORT 水平均增高,与正常对照组相比差异有统计学意义(P<0.05);药物反证组血清ACTH 水平与正常对照组相比,差异无统计学意义(P>0.05),血清CORT 差异有统计学意义(P<0.05)。见表6。
表6 3组大鼠血清ACTH、CORT的变化(ng/mL,±s)
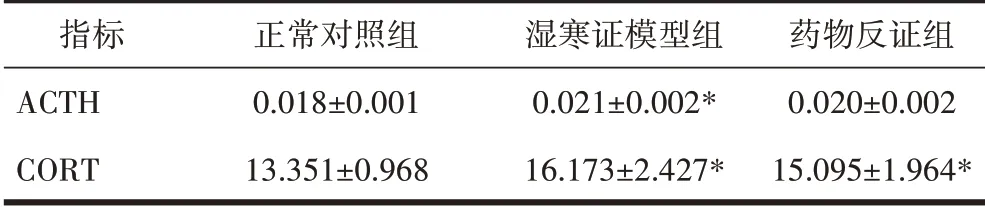
表6 3组大鼠血清ACTH、CORT的变化(ng/mL,±s)
注:与正常对照组比较,*P<0.05。
指标ACTH CORT正常对照组0.018±0.001 13.351±0.968湿寒证模型组0.021±0.002*16.173±2.427*药物反证组0.020±0.002 15.095±1.964*
2.7 大鼠舌体表面组织形态学变化
2.7.1 3组大鼠舌体丝状乳头角质化程度的比较 正常对照组大鼠丝状乳头表面光滑,乳头基部呈现一定的角质化;与正常对照组相比,湿寒证模型组大鼠的舌体丝状乳头较长,乳头间的空隙较小,乳头表面凹凸不平,裂纹较多,角质层较厚且角化程度较严重,出现剥脱现象;药物反证组大鼠角质层较模型组薄,乳头间的空隙较大,乳头表面较光滑,剥落现象不明显。结果见图1。
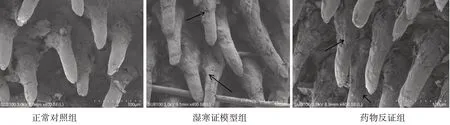
图1 3组大鼠舌体丝状乳头形态
2.7.2 3组大鼠舌体菌状乳头角质化程度的比较 正常对照组大鼠舌体菌状乳头中央可见味孔,中央平滑,裂纹少,周围呈现一定的角质化;与正常对照组相比,湿寒证模型组大鼠舌体菌状乳头中央未见味孔,裂纹较多,周围被角质层包裹,且角化组织较厚;药物反证组大鼠舌体的菌状乳头中央可见味孔,裂纹较模型组少,角质层较少而薄。见图2。

图2 3组大鼠舌体菌状乳头形态
3 讨论
湿寒证是多因长期食用湿寒属性食物、药品,长期居住在湿寒环境、缺乏运动等原因导致的整体性反应。证候研究中,动物模型信息的采集与分析评价方法日趋成熟。有学者提出,在证候模型的基础上,依据辨证论治的原则,以经典方药干预,观察实验动物各项指标恢复情况,“以药反证””的方法验证动物模型复制是否成功[4-5]。本研究所采用多病因造模法通过对大鼠进行多样的,随机的刺激,复制出证候动物模型。观察动物外在表征,并进行评分赋值,舌体组织形态学变化和应激相关指标进行评价,并使用湿寒证对应方,从“方证相应”角度进行逆向辨证,判定动物模型证型属性。
慢性应激可导致行为活动减少,动物随应激时程延长,其行为表现为由兴奋状态转变为抑制状态[6]。本研究显示,随着造模时间的延长,大鼠在应激源的刺激下活动量明显减少,喜扎堆,对刺激的反应度降低。湿寒证模型组大鼠皮毛蓬乱不洁,鼻、爪部色泽淡白,舌部白色厚苔明显,精神倦怠,喜扎堆,嗜睡,小便颜色清,量明显增多,大便细长,出现黏液便。各组外观表征评分排序为湿寒证模型组>药物反证组>正常对照组,其中湿寒证模型组评分值最高,造模第24天时达到80.10分。
冷暴露对大鼠的能量代谢有重要影响[7]。冷暴露4 周的雄性大鼠体重增长与对照组相比显著性降低[8]。本研究显示,随着造模的进行,湿寒证模型组大鼠体重增长速度缓慢,与上述研究结果一致。环境温度的改变能够影响正常机体的生理功能,牛亭惠等[9]研究发现,低温暴露能够引起大鼠的摄食量与摄水量的增加。Zhang 等[10]研究发现,雄性布氏田鼠通过增加食物的摄入量以补偿寒冷中的高能量需求。本研究显示,湿寒证模型组大鼠摄食量与摄水量显著性增加,可能是因为慢性应激导致动物的排泄量增加,许多内源性物质丢失,因此需要食物和水分来补充丢失的能源物质,以维持正常的代谢活动。
机体的应激反应主要由下丘脑-垂体-肾上腺(HPA)轴来调控。下丘脑、垂体释放促肾上腺皮质激素释放激素(CRH)、促肾上腺皮质激素(ACTH )[11],此外ACTH 还可激活肾上腺皮质,最终刺激皮质酮(cor⁃ticosterone,CORT)的合成和释放[12],脊椎动物发生冷应激时,血清中CORT 水平会升高[13]。CORT是HPA轴的终末产物,可反馈于HPA 轴的各个水平。ACTH和CORT 常被认为是应激相关研究最经典最重要指标之一,本研究中由于湿寒环境及寒凉性饲料,外加冷水游泳等多因素的复合作用下,湿寒证模型组的ACTH 与CORT 水平明显上升,血清ACTH 浓度:湿寒证模型组>药物反证组>正常对照组,湿寒证模型组与正常对照组差异显著。血清CORT 浓度:湿寒证模型组>药物反证组>正常对照组。提示,湿寒证大鼠HPA 轴可能处于应激状态,从而引起ACTH 及CORT血清水平的改变。
随着现代医学的发展,扫描电镜技术逐渐被运用到舌象的诊断上。本研究采用扫描电镜技术从舌体微观结构观察舌体在应激状态下的改变。本研究发现,湿寒证模型组大鼠舌体表面的丝状乳头间的空隙较小。在临床上湿寒证病人的舌质呈淡紫或苍白,这可能就与丝状乳头间的空隙小,且覆盖了舌体以及舌体皮下的毛细血管有关。本研究还发现,湿寒证模型组大鼠舌体表面丝状乳头和菌状乳头角质化程度较高。舌苔是成片的丝状乳头以及菌状乳头根部的角质层构成,这与临床上湿寒证病人舌苔较厚的现象相符。本研究显示,药物反证组舌体的角质化程度比湿寒证模型组低,角质层较少而薄。表明湿寒证对应方能有效防止对应“证候”的出现,但是不能完全消除其影响。方证对应是指每一具体方剂都有其适应的病证,临床特定病症要求有特定的方剂进行治疗,当方剂的功效与其所治病证相对应时,方剂才能显效[14]。本研究观察了湿寒证对应方对湿寒证大鼠模型的治疗作用,结果显示湿寒证对应方在大鼠外观生物表征、体重、摄食水量、舌体组织形态和血清ACTH 和CORT 含量方面均显示出较好的改善作用。根据方证对应的原理,可判定此动物模型呈现出的证候为湿寒证。由此本研究进一步确定模型组大鼠表现出的特征与临床“湿寒证”证候特征高度一致,这种造模方法可复制临床“湿寒证”模型。
综上所述,本研究以湿寒证的病因因素作为应激源,采用湿寒膳食及环境复合作用并模拟出大鼠湿寒证动物模型,该方法尽可能模拟湿寒证的发病条件及机制,但确切的机制尚不可知,仍需进一步的开展后续研究,为证候属性研究提供更深入、更科学的评价体系。
