骨软骨组织工程仿生梯度支架研究进展
2022-02-26王海蟒胡刻铭张洪玉
万 李,王海蟒,蔡 谞,胡刻铭,岳 文,张洪玉*
(1 中国地质大学(北京) 工程技术学院,北京 100083;2 清华大学 机械工程系 摩擦学国家重点实验室,北京100084;3 清华大学附属北京清华长庚医院 骨科,北京102218;4 清华大学临床医学院,北京 102218)
骨软骨缺损是导致老年人骨关节炎和关节残疾的重要原因[1]。在骨关节炎发展过程中,关节软骨将会变薄和退化,关节间隙变窄,骨赘形成和软骨下骨重塑[2]。在骨关节炎早期阶段,疼痛和僵硬是主要表现症状,因此治疗方法主要是物理疗法、服用镇痛药和非甾体类消炎药减轻疼痛[3]。随着骨关节炎的发展,如果软骨缺损的范围和程度仍然很小,那么在此阶段微骨折骨髓刺激是行之有效的治疗方法。微骨折骨髓刺激法是一种微创手术,首先去除受损的软骨,然后于软骨下骨下表面形成孔道,使血液和骨髓穿过软骨下骨/软骨界面,其中包含的间充质干细胞有助于形成和修复软骨和软骨下骨。然而,再生软骨主要为纤维软骨,它不具有与天然关节软骨类似的耐久性。在骨关节炎中晚期阶段,骨软骨组织自体或异体移植、组织工程支架和膝关节局部表面置换可用于治疗中小型病变[4]。如果骨软骨缺损已发展到非手术治疗不再有效的阶段,则必须进行全关节置换手术。全关节置换外科手术通常不能恢复关节的全部功能,并且伴随高并发症率风险。因此,开发一种修复受损骨软骨组织的方法具有非常重要的临床意义[5-7]。
骨软骨组织工程汇集了工程学、材料科学、生物学和化学的原理和方法,旨在开发骨软骨仿生梯度支架,恢复、维持或改善受损骨软骨组织的功能[8-9]。该学科涉及多种细胞类型、支架材料和生长因子与细胞因子,它克服了同种异体骨软骨移植和自体组织移植的限制[10]。性能优异的生物材料和适当的制造方法在开发理想的骨软骨仿生梯度支架方面起着至关重要的作用。目前,研究人员已开发了用于制备三维多孔骨软骨仿生梯度支架的天然聚合物材料、合成聚合物材料和生物活性材料[11]。骨软骨仿生梯度支架的制造方法可分为常规方法和3D打印方法。常规的支架制造技术(例如溶剂浇铸[12]、静电纺丝[13]、气体成型和冷冻干燥[14])具有一定的成本效益,且可以对骨软骨仿生梯度支架的孔隙率和孔径进行控制。3D打印技术可对骨软骨仿生梯度支架的宏观和微观特征进行独立的调控,进一步开发具有特定结构的骨软骨仿生梯度支架[15]。
骨软骨缺损通常涉及软骨和软骨下骨的损伤。相关研究表明,具有离散或连续梯度特性的骨软骨仿生梯度支架在修复骨软骨缺损方面优于单相组织支架[16-17]。通过缝合、胶合或压入配合可制造双相或三相离散梯度支架,然而大多数此类型支架具有结合强度不足的缺点,因而增加了植入后相分层的风险[18-19]。连续梯度支架不易发生相分层,具有在软骨和软骨下骨之间提供平滑过渡的潜力,可促进应力在骨软骨仿生梯度支架内的传递,避免界面不稳定并更加相似地模拟骨软骨组织的自然结构[3,20]。本文总结了骨软骨组织的生化组成、结构和力学性能的梯度特征,并介绍了3D打印技术和有限元建模方法在骨软骨梯度支架制造方面的研究进展。
1 骨软骨组织的生化组成、结构和力学性能
骨软骨组织由软骨和软骨下骨组成,具有特定的骨软骨单元结构梯度和生物学特性。因此,设计骨软骨仿生梯度支架,必须了解其组成、结构和功能的骨软骨单元。
1.1 骨软骨组织的生化组成和结构
骨软骨组织具有特定的自然梯度,它是由从软骨表面到软骨下骨的生化组成、结构和力学特性的变化来定义的[21-23]。骨软骨组织由软骨和软骨下骨两部分组成[6,24],如图1(a)所示。软骨可分为非钙化软骨和钙化软骨。非钙化软骨包含3个区域,即深层区域、中间区域和浅表带[25]。软骨主要由水、细胞外基质(主要是Ⅱ型胶原纤维)和软骨细胞组成[26]。胶原纤维的直径和方向由软骨的表层区域到深部区域发生变化,表层区域包含最细的胶原纤维(30~35 nm),它以与关节表面高度平行的方向排列,胶原纤维的直径在软骨的中部增加,在软骨的深部,胶原纤维的直径为40~80 nm,取向垂直于关节表面,以增强软骨与软骨下骨之间的结合强度[27]。

图1 骨软骨组织结构(a)骨软骨单元:软骨和软骨下骨[6,24](Tidemark表示矿化和非矿化软骨之间的离散带);骨的宏观(b)、微观(c)和纳米(d)结构[24]Fig.1 Structure and properties of osteochondral(a)osteochondral unit: cartilage and subchondral bone[6](Tidemark denotes a discrete band between mineralized and non-mineralized cartilage);macrostructure(b), microstructure(c) and nanostructure(d) of bone[24]
钙化软骨位于骨软骨组织的过渡区域,该区域的胶原纤维锚固在软骨下骨上,用于固定软骨和软骨下骨。钙化软骨下方是软骨下骨,由水(约10%,质量分数,下同)、有机成分(Ⅰ型胶原蛋白约30%)和矿物质成分组成[28]。软骨下骨是高度血管化的生物矿化结缔组织,具有很高的机械强度和结构复杂性。天然软骨下骨组织在宏观结构、微观结构和纳米结构水平上具有明显的层次性(图1(b)~(d))。在宏观结构水平上,软骨下骨可分为皮质骨和松质骨。在微观结构水平上,皮质骨由重复的骨单位组成,而松质骨由小梁骨的互连框架组成,且形成了骨髓填充的空间。每个骨质都有20~30个同心胶原纤维层,绕着哈弗氏管并包含各种血管和神经[29]。在纳米结构水平上,存在大量的胶原纤维、磷酸钙晶体和非胶原有机蛋白[30]。
1.2 骨软骨组织的力学性能
骨组织中的细胞包括成骨细胞、破骨细胞、成熟骨细胞和间充质干细胞。成骨细胞与形成新软骨下骨和羟基磷灰石的合成有关,破骨细胞与骨吸收有关,骨细胞可调节成骨细胞和破骨细胞之间的相互作用[31]。骨组织的力学性能在很大程度上取决于骨细胞外基质的特定结构和组织。骨软骨组织的结构和力学特性从软骨表面到软骨下骨各不相同。软骨呈凝胶状结构且孔隙率为60%~85%,软骨细胞由流过软骨孔的关节液提供营养物质。皮质骨具有高刚度,其孔隙率为5%~30%,随着孔隙率的增加,刚度从皮质骨到小梁骨逐渐降低,小梁骨的孔隙率为30%~90%。软骨下骨组织中的多孔结构充满了血管和神经纤维,这些血管和神经纤维为骨细胞提供营养并清除废物[23-24]。软骨的抗压模量和抗压强度从表层到深部逐渐增加,抗压模量从0.2 MPa增大到6.44 MPa,抗压强度从0.005 MPa增大到4 MPa[11,22]。由于有机和无机成分的排列,软骨下骨组织具有各向异性。例如,皮质骨的横向弹性模量和纵向模量分别为10.1 GPa和17.9 GPa,纵向拉伸强度和抗压强度分别为135 MPa和205 MPa,横向拉伸强度和抗压强度分别为53 MPa和131 MPa[21-22]。表1[11]总结了天然骨软骨组织的组成、结构和力学性能。骨软骨组织表现出从软的软骨到硬的软骨下骨的梯度转变,因此,在骨软骨组织工程中,实现这种梯度转变具有非常重要的意义。
表1 天然骨软骨组织的组成、结构和力学性能[11]Table 1 Summary of composition,structure and mechanical properties of natural osteochondral tissue[11]
2 骨软骨组织工程中的细胞、生长因子和材料
骨软骨缺损通常包括关节软骨破坏和软骨下骨缺损。当前,骨软骨缺损的外科手术治疗取决于病变的严重程度。微骨折骨髓刺激法常用于治疗小面积的软骨缺损,这种方法通过刺激软骨下骨中间充质干细胞修复软骨组织,但再生的软骨组织与原软骨组织组成和结构并不一致。自体移植或同种异体移植用于治疗1~4 cm2范围内的病变,但自体移植组织的供应受到限制,而同种异体移植组织可能存在发生微生物感染的风险。严重的骨软骨缺损需要进行全关节置换手术,但存在假体磨损和松动的风险[32]。尽管这些疗法在不断进步和发展,但由于其局限性仍要求研发新的疗法。骨软骨组织工程利用各种生物材料和合成材料模拟天然骨软骨组织的梯度特征,制备具有维持、替代或再生骨软骨组织的骨软骨仿生梯度支架。
2.1 骨软骨组织工程中的细胞和生长因子
用于骨软骨组织重建的自体细胞来源短缺,限制了间充质干细胞的应用[33]。在使用祖细胞或间充质干细胞进行骨软骨组织工程的研究中[14],载有生长因子的骨软骨仿生梯度支架可导致间充质干细胞高度的分化。由于生长因子在体内的生物半衰期短,因此需要延长释放生长因子的时间,并要求生长因子与靶细胞之间的扩散距离较短,以最大化生长因子的活性。例如,载有转化生长因子的明胶微球可用于诱导间充质干细胞组装成细胞聚集体,进一步可刺激细胞聚集体形成软骨,这可以通过其产生的DNA、糖胺聚糖和Ⅱ型胶原的量对再生软骨进行评估[34]。
骨软骨仿生梯度支架也可以预接种嵌入式骨髓间充质干细胞,但由于预接种细胞分泌的细胞外基质会触发免疫反应,使得骨软骨仿生梯度支架显示出不良反应,导致不良的愈合过程[35]。因此,在某些情况下更优先使用无细胞预接种的骨软骨仿生梯度支架,但必须对骨软骨仿生梯度支架进行生物活性分子预修饰,以诱导周围祖细胞或多功能干细胞的黏附和分化。生长因子是触发组织再生所需的细胞级联反应内信号的关键生化因素,因此它们通常被掺入骨软骨仿生梯度支架中,以传递促进有丝分裂活性和诱导新血管形成的生化信号[36]。例如,常见的转化生长因子具有诱导干细胞分化为上皮细胞和成纤维细胞的功能,通常用于加速伤口愈合和促进软骨成骨。同时,需要骨形态发生蛋白诱导和维持特定组织的特性,以再生诸如软骨下骨之类的硬组织[14,37]。例如在一项人类临床实验中[38],掺入重组人骨形态发生蛋白的胶原海绵比自体植骨具有更可靠的骨诱导作用。
2.2 骨软骨组织工程中的材料
性能优异的生物材料在开发理想的骨软骨仿生梯度支架方面起着至关重要的作用。目前,研究人员已开发了多种材料来制备骨软骨仿生梯度支架,包括天然聚合物材料(胶原蛋白/明胶[39]、纤维蛋白[40]、丝素蛋白[41-42]、甲壳素/壳聚糖[39]、硫酸软骨素[43]、透明质酸[44]、藻酸盐[42,45])、人工合成聚合物材料(聚己内酯[1,37]、聚乳酸-羟基乙酸共聚物[39]、聚乙醇酸[39]、聚乙二醇[45]、聚乳酸[39]和聚醚醚酮[46]等)、生物活性材料(羟基磷灰石[47-49]、磷酸钙[39]和生物活性玻璃)以及多孔钛合金材料等[50]。它们与细胞外基质的结构相似且具有良好的生物相容性。例如,胶原蛋白为结缔组织的主要成分,而且是骨软骨仿生梯度支架制造中常用的天然聚合物材料。天然聚合物材料具有较快的生物降解速率,由单一胶原材料制备的支架缺乏维持结构完整的力学性能,可以进行交联处理以延长其耐久性和机械强度。明胶具有低成本和易于制备的特点,但力学性能较差,通常与其他材料(例如羟基磷灰石和壳聚糖)结合使用。丝质材料稳定,柔韧性好,并且具有很高的抗拉和抗压能力,也用于骨软骨仿生梯度支架的制造[41]。尽管天然聚合物更加亲和天然软骨组织,但由于稳定性和机械强度低等原因,需要与其他合成材料或生物活性材料联合使用。合成生物材料因其优异的力学性能、良好的生物相容性和高度可定制化而被广泛研究。但大多数合成聚合物材料具有疏水性,相互作用位点数量不足,可能会导致细胞黏附和分化方面的限制,因此可将疏水性和亲水性聚合物混合使用,用于增强亲水性并促进细胞附着。羟基磷灰石、磷酸钙和生物玻璃等生物活性材料能够刺激生物矿化以修复骨软骨组织[20,37]。在一些研究中[19,51],通过改变磷酸钙中钙磷比可以控制骨软骨仿生梯度支架的生物降解性,但生物活性材料很脆并且不能抵抗机械应力,因此也需要与天然材料和合成材料联合使用。
3 3D打印和有限元建模用于骨软骨仿生梯度支架制备
3.1 3D打印用于骨软骨仿生梯度支架制备
骨软骨仿生梯度支架的制造不仅需要优良的生物材料,而且需要合适的制造方法。制造方法可以分为常规方法[51]和3D打印方法[4,52]。常规的骨软骨仿生梯度支架制造方法(例如溶剂浇铸、气体成型、冷冻干燥和静电纺丝)具有高性价比,且在一定程度上可以对骨软骨仿生梯度支架的孔隙率和孔径进行控制[53]。然而,相比较常规方法,基于CAD模型的3D打印技术可对支架宏观和微观特征进行独立的调控,能够进一步开发具有特定结构的骨软骨仿生梯度支架。经过近些年的发展,3D打印已成为一种用于骨软骨仿生梯度支架制造的重要方法。在3D打印中,通过计算机辅助设计模型指导骨软骨仿生梯度支架逐层制造,此方法可以很好地控制支架孔的几何形状[6]。3D打印可制造100%互连的孔结构并优化支架的力学性能[37,52]。目前,已有几种3D打印技术用于创建骨软骨组织仿生梯度支架,包括基于固体(例如熔融沉积建模)、基于粉末(例如选择性激光烧结和选择性激光熔化)和基于液体(例如喷墨打印、立体光刻和生物打印等)的技术[11]。然而,各种3D打印技术都有其优势和局限性。一方面,熔融沉积建模可以用来创建支架梯度结构,但由于其高温处理,难以在骨软骨仿生梯度支架内部获得材料梯度,且在打印过程中不能预接种干细胞和生物活性因子。同理,在选择性激光烧结和激光熔化过程中,涉及粉末前体的烧结或熔化,也不能预接种干细胞和生物活性因子。另一方面,在室温下,可以使用基于液滴和挤压的生物打印工艺来处理预接种生长因子和干细胞的骨软骨仿生梯度支架。然而,使用这种方法难以制造具有复杂几何孔形状的骨软骨仿生梯度支架[6,54]。
尽管3D打印技术有一定的局限性,但它正在推动骨软骨仿生梯度支架向个性化发展方向转变。例如,可以将个人的关节扫描图像转换为计算机辅助设计图像,然后将其用于定制患者所需的骨软骨仿生梯度支架[6,54]。这种个性化的骨软骨仿生梯度支架,不仅可在软骨下骨和软骨之间提供连续的梯度,而且还能在骨软骨仿生梯度支架和宿主组织之间提供连续的过渡。此外,在逐层3D打印过程中,可以将几种类型的细胞、生长因子和生物材料预接种在骨软骨仿生梯度支架内部,因此,3D打印技术能够提供符合骨软骨单元梯度特性的方案。通过3D打印制造的骨软骨仿生梯度支架包括材料梯度和结构梯度。例如Gao等[17]配制了聚(N-[三(羟甲基)甲基]丙烯酰胺)共聚水凝胶(PNT)生物油墨,采用生物3D打印技术制造了一种骨软骨仿生材料梯度支架,其顶层是含有PNT和转化生长因子的水凝胶,底层是含有PNT和磷酸钙的水凝胶。体外测试结果表明,转化生长因子和磷酸钙改善了骨髓间充质干细胞的增殖和分化;体内动物研究表明,该骨软骨仿生梯度支架可以促进骨软骨再生。
3.2 有限元建模用于骨软骨仿生梯度支架制备
随着3D打印技术的进一步发展,有限元建模方法结合3D打印技术已被用来设计和分析骨软骨仿生梯度支架,从而使研究人员能够探索骨软骨仿生梯度支架拓扑、力学性能和组织再生之间的关系。例如,在Liu等[7]和Xu等[50]的研究中,利用具有晶格结构的钛合金设计了6种不同类型支杆半径的复合晶格结构,包括简单立方(结构A)、体心立方(结构B)和边心立方(结构C)单元格。首先通过有限元方法对支架的设计结构进行仿真和分析,然后使用选择性激光熔化法制造具有最佳晶胞和支杆半径的钛晶格(CP-Ti)结构。研究结果表明,在6种类型的复合晶格结构中,BA,CA和CB组合结构具有较小的最大Von-Mises应力,表明这些结构具有较高的强度。根据应力/比表面积对支撑杆半径的拟合曲线,BA,CA和CB结构的最佳支柱半径分别为0.28,0.23 mm和0.30 mm,其相应的压缩屈服强度和压缩模量分别为42.28,30.11 MPa和176.96 MPa,以及4.13,2.16 GPa和7.84 GPa。具有CB单元结构的CP-Ti与皮质骨强度和压缩模量相似,使其成为软骨下骨修复潜在的应用材料。有限元分析方法与3D打印技术相结合,拓展了可调机械强度的骨软骨仿生梯度支架的制造方式,该骨软骨仿生梯度支架可动态模拟各种生物组织的机械特性。
4 骨软骨仿生梯度支架的制备
由前述可知,天然材料、合成材料或生物活性材料性能较为单一,因此使用复合材料的骨软骨仿生梯度支架具有更优异的综合性能[20,39]。例如,Golafshan等[55]采用聚己内酯(PCL)和Sr2+离子改性的生物活性材料磷酸镁(MgP)通过3D打印技术制备了聚合物/生物活性材料复合支架(MgPSr-PCL30),其具有与纯聚己内酯支架相似的应力应变行为。聚合物含量的增加导致复合材料的弹性模量和屈服应力均降低。与纯聚己内酯支架相比,MgPSr-PCL30的弹性模量和屈服应力分别增加了4.5倍和2.7倍,达到36.8 MPa和4.3 MPa。此外,MgPSr-PCL30的弹性模量比MgPSr-PCL40和MgPSr-PCL50分别提高1.5倍和2.3倍。在MgPSr陶瓷相中添加40%或30%聚己内酯后,复合支架的抗压强度分别达到375.5 kJ/m3和324.8 kJ/m3。MgPSr-PCL30是一种具有高3D打印分辨率、高抗压韧性(324.8 kJ/m3)和10%拉伸应变的复合生物材料。因此,复合生物材料在骨软骨仿生梯度支架制备中可调控其力学性能,具有更加明显的优势。
此外,添加不同天然材料、合成材料或生物活性的复合材料可更好地模拟天然骨软骨组织内软骨-钙化软骨-软骨下骨的梯度。一些研究者[6]通过使用复合材料开发出离散型和连续型的骨软骨仿生梯度支架(图2所示)。在离散型骨软骨仿生梯度支架中,每层相对应于天然骨软骨组织的各个不同的层,而连续骨软骨仿生梯度支架中过渡是渐变发生的。
图2 离散型骨软骨仿生支架和连续型骨软骨仿生支架示意图[6]Fig.2 Schematic representations of discrete and continuous gradient osteochondral scaffolds[6]
4.1 离散型骨软骨仿生梯度支架
离散梯度支架可分为双相或多相支架,将单个软骨下骨支架和软骨支架连接即可构成双相骨软骨仿生梯度支架。Shen等[18]制备由大孔纤维蛋白上层支架和硅灰石下层支架(CS-Mg8)整合而成的离散型骨软骨仿生梯度支架,体内外实验表明骨髓间充质干细胞黏附在CS-Mg8支架上并显示出良好的迁移。Zhao等[56]制备了多孔聚乳酸-羟基乙酸共聚物(PLGA)和多孔钛(Ti)双相结构,体内实验结果表明PLGA/Ti骨软骨仿生梯度支架比PLGA或Ti支架具有更好的骨软骨组织修复功能。此外,Chen等[57]也开发了一种双相离散型骨软骨仿生梯度支架,其中转化生长因子活化的壳聚糖/明胶用于软骨形成层,而骨形态发生蛋白活化的羟基磷灰石/壳聚糖/明胶则用于软骨下骨形成层。将接种间充质干细胞的支架植入兔膝关节缺损模型12周后显示,该骨软骨仿生梯度支架能够促进骨软骨组织再生。三相/多相离散型骨软骨仿生梯度支架具有与天然骨软骨组织中的软骨、钙化软骨和软骨下骨更加相似的状态。例如,Jiang等[58]开发了三相骨软骨仿生梯度支架,PLGA和接种成骨细胞的生物活性玻璃用于创建软骨下骨层,软骨细胞接种的琼脂糖水凝胶形成软骨层,PLGA和琼脂糖水凝胶的组合产生钙化软骨层,体外实验结果表明各层均可形成适当的骨软骨组织。总而言之,在大多数研究中使用生物相容性优异的天然生物材料构成离散梯度支架的软骨层,力学性能优异的合成材料(或掺杂生物活性材料的天然生物材料)构成离散梯度支架的成骨层,但是离散型支架上下层界面之间力学性能差异较大,这种差异造成了支架发生潜在断裂的风险。
4.2 连续型骨软骨仿生梯度支架
与离散型骨软骨仿生梯度支架相比,连续型骨软骨仿生梯度支架具有诱导骨软骨组织成分之间平滑过渡的潜力,降低了界面的不稳定性。Bittner等[59]制备了具有结构梯度和材料梯度的PCL/羟基磷灰石连续型骨软骨仿生梯度支架,其通过改变孔径(0.2,0.5 mm或0.9 mm)和羟基磷灰石的含量(0%,15%或30%)来实现。Gao等[17]通过一步共聚法,合成了可3D打印的高强度热响应性N-丙烯酰基甘氨酰胺共聚N-[三(羟甲基)甲基]丙烯酰胺超分子水凝胶,可控的3D结构证明该连续型骨软骨仿生梯度支架制备成功。该支架通过一体化构造,具有出色的力学性能,拉伸强度高达0.41 MPa,伸长率高达860%,抗压强度高达8.4 MPa,能够有效降低支架植入体内后受应力作用发生界面断裂的可能性。同时,这种上下层分别预接种了转化生长因子和磷酸钙的连续型骨软骨仿生梯度支架,可促进骨髓间充质干细胞的附着、扩散以及成软骨和成骨分化,通过大鼠模型实验表明它显著促进了软骨和软骨下骨同时再生。Dormer等[60]使用微流控技术开发了连续型PLGA骨软骨仿生梯度支架,支架的顶部和底部四分之一分别包含转化生长因子和骨形态发生蛋白,同时把间充质干细胞接种在PLGA梯度支架上,体外实验结果表明,成骨分化和碱性磷酸酶的活性均得到改善。此外,Parisi等[54]通过从底部到顶部改变胶原蛋白与羟基磷灰石的比例开发了连续型骨软骨仿生梯度支架。支架的底部具有高含量的羟基磷灰石,羟基磷灰石含量向顶部逐渐减少至零,通过调节生物材料组成将支架从成软骨区域渐变为成骨区域,同时调节支架的力学性能和生化性能。总而言之,连续型骨软骨仿生梯度支架在材料组成方面具有更好的连续性,整体力学性能更加稳定,与天然骨软骨组织结构更加相似。表2[3,17-19,54,57,60-63]总结了在动物实验研究中评估过的典型的骨软骨仿生梯度支架功能和效果。

表2 用于动物体内研究的骨软骨仿生梯度支架的性质和性能[3,17-19,54,57,60-63]Table 2 Properties and performance of scaffolds used for in vivo animal studies[3,17-19,54,57,60-63]
近些年来,尽管骨软骨组织工程领域取得了显著的进展,但要重建具有和天然骨软骨组织类似结构和功能的支架材料仍需进一步研究,同时也需要降低离散型梯度支架发生潜在断裂的风险。Qiao等[64]受天然骨软骨组织中细胞外基质组成和胶原纤维结构所启发,设计并制造了由聚ε-己内酯-聚乙二醇(PCEC)组成的三相骨软骨仿生梯度支架,包括浅软骨层、深软骨层和软骨下骨层,并且将负载特异性生长因子和间充质干细胞的甲基丙烯酰胺化明胶水凝胶填充在支架中,如图3所示。将PCEC纤维引入到明胶水凝胶中可显著提高其机械强度,并在一定程度上降低支架断裂的风险。在随后进行的动物实验中发现,三相骨软骨仿生梯度支架组在术后24周时可实现软骨和软骨下骨同时再生,其宏观修复评分显著高于其他组。更为重要的是,引入浅软骨层可以使再生的软骨组织具有一定的润滑和抗磨损性能,其表面粗糙度更低,摩擦因数更小。上述结果表明,该三相骨软骨仿生梯度支架在未来临床研究中具有良好的应用前景。
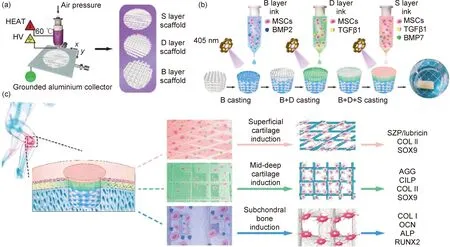
图3 骨软骨仿生梯度支架的制备过程示意图[64](a)通过生物3D打印制备三相骨软骨仿生梯度支架;(b)将载有细胞和生长因子的明胶水凝胶前体溶液依次注入到支架网络后,紫外光交联;(c)骨软骨仿生梯度支架在骨软骨组织诱导和再生中的应用Fig.3 Schematic diagrams showing the preparation process and application scenario of the tri-layered fiber-reinforced and GF-loaded hydrogel construct[64](a)fiber networks for the S,D and B layers were fabricated by meltelectrowriting;(b)integrated tri-layered composite was constructed using the UV-assisted,stepwise infiltration and crosslinking procedures.As shown, with the assistance of UV-crosslinking,the cell and growth factor-laden GelMA hydrogel precursor solution of the respective layer was successively infused into the fiber networks for the B,D and S layers to construct the tri-layered fiber-reinforced hydrogel composite;(c)application of the tri-layered composite scaffold in layer-specific osteochondral tissue induction and regeneration
5 商业骨软骨仿生梯度支架
目前,采用临床实验评估骨软骨仿生梯度支架设计的研究较少,可商购的骨软骨仿生梯度支架主要是模仿整个骨软骨单元的双相或三相结构。Exactech开发的“TruFit”是一种经典的双相骨软骨仿生梯度支架,它是由多孔PLGA/聚乙醇酸和磷酸钙组成[65]。尽管临床实验显示“TruFit”支架一年内具有稳定的骨软骨组织修复功能,但“TruFit”与周围骨软骨组织整合不充分,长期修复结果还需进一步观察。Dell’osso等[66]指出,如果该骨软骨仿生梯度支架的设计可用其他方法更相似地模拟天然骨软骨组织,则“TruFit”骨软骨仿生梯度支架将表现出更好的性能。
此外,Finceramica开发的“MaioRegen”是一种正在进行临床实验的骨软骨仿生梯度支架。它的软骨层由Ⅰ型胶原组成,钙化软骨层由60%的Ⅰ型胶原蛋白和40%的镁-羟基磷灰石组成,骨层由30% Ⅰ型胶原和70%镁-羟基磷灰石组成。一些病例报道显示MaioRegen具有良好的治疗效果[67]。在该例子中,一名患者通过术前MRI检查诊断为髌骨外侧关节面软骨的ICRS Ⅳ度损伤。在手术过程中该处损伤被植入了一块2.5 cm2大小的MaioRegen支架。术后2年的随访中,患者的膝关节疼痛明显缓解,膝关节功能也较术前大幅提高,临床方面的改善十分明显。然而文中没有给出患者随访的MRI资料,所以影像学评估尚不明确。在另一些病例报道中[68]使用MaioRegen支架对10例骨软骨缺损患者进行了临床研究,其中6例为膝关节骨软骨缺损,4例为踝关节骨软骨缺损。结果表明,术后1年和2.5年随访中,虽然膝关节的临床功能评分有部分改善,但踝关节的临床功能较术前变化不大。此外更值得注意的是,影像学方面,术后只在2名患者中观察到不完全的骨缺损修复,而MRI评估则提示软骨的再生几乎为零。患者的关节表面没有完整或与周围宿主组织完全融合。基于这项研究的结果,一些国家建议谨慎使用MaioRegen支架。尽管市售的骨软骨仿生梯度支架结构层次类似于天然骨软骨组织结构,但仍然需要进一步改进来提高骨软骨仿生梯度支架的组织再生能力。
6 展望
作者根据骨软骨组织从软骨表层到软骨下骨在生化组成、结构和力学性能方面的梯度特性,讨论了骨软骨仿生梯度支架模拟天然骨软骨组织梯度特性进行骨软骨组织修复的研究进展。为了复合多种材料的优良性能以及控制骨软骨仿生梯度支架的孔径和孔隙率,一方面,性价比高的常规制造方法已被用于骨软骨仿生梯度支架的制造;另一方面,基于CAD设计的3D打印技术可调控孔的几何形状并能够构造高度互连的孔结构,在骨软骨仿生梯度支架加工方面具有较大的潜力。该方法的局限性之一是缺乏用于骨软骨仿生梯度支架加工的合适材料,需要进一步发展无毒、可控生物降解、成软骨和成骨特性的新合成或复合材料。3D打印技术制备的骨软骨仿生梯度支架与CAD模型之间存在显著差异,因此,需要为骨软骨仿生梯度支架制造优化3D打印过程。此外,有限元模拟和3D打印技术的结合为骨软骨仿生梯度支架的发展提供了新思路。使用有限元建模方法,在压缩载荷和流体动力环境下,根据压缩应变和流体壁剪切应力,对3D打印的骨软骨仿生梯度支架模型进行评估是一种高性价比的方法。
相比于离散型骨软骨仿生梯度支架,连续型骨软骨仿生梯度支架可以更相似地模拟天然骨软骨组织单元的结构,且各层之间不会产生性能突变。因此,连续型骨软骨仿生梯度支架在整体性能方面比离散型骨软骨仿生梯度支架更有应用前景。尽管在骨软骨组织再生方面,大多数骨软骨仿生梯度支架在体内外实验中均取得了良好的效果,但长期的临床研究并未提供令人满意的结果,仍然需要对骨软骨仿生梯度支架进行进一步深入研究。
