牙科陶瓷材料的摩擦学性能研究进展
2022-02-26伍雨驰程子晋
雷 磊,伍雨驰,程子晋,刘 莉,郑 靖*
(1 西南交通大学 材料先进技术教育部重点实验室 摩擦学研究所,成都 610031;2 西南交通大学医院 口腔科,成都 610031)
牙齿是人体内直接行使咀嚼功能的器官,具有优异的耐磨性[1-2]。恒牙无法再生,一旦疾病、外伤等因素导致人体天然牙缺损或缺失,会诱发咀嚼功能障碍、颞下颌关节紊乱病、营养摄入障碍,甚至全身系统性疾病,需及时使用牙科修复材料重建牙齿解剖形态与生理功能[3]。陶瓷材料因具有优异的耐磨性、化学稳定性、生物相容性和美观性,作为牙科修复材料使用至今已有超过200年历史,并在牙科修复领域占据越来越重要的位置[4]。
1774年,法国人Alexis Duchateau发明了第一颗陶瓷义齿,随后研究人员一直致力于改善牙科陶瓷材料的美学性能。1838年,Elias Wildman成功开发出与天然牙齿色泽接近的半透明长石质瓷[5],鉴于长石质瓷的力学性能不佳,研究人员尝试将长石质瓷熔附在金属框架上以制备强度更高的牙科修复体,但陶瓷和金属框架之间热膨胀系数不匹配容易导致界面失效。19世纪60年代,人们通过添加白榴石调控长石质瓷的热膨胀系数,开发了玻璃陶瓷,用于制备烤瓷熔附金属修复体,但修复体表面磨损会导致裂纹萌生,引发烤瓷层崩裂或剥落[6]。近几十年,人们将目光转向全陶瓷修复体的研发,这对材料的力学性能提出了更高要求,催生了以氧化锆陶瓷为代表的多晶牙科陶瓷材料[7]。
陶瓷修复体在口腔内承受咀嚼磨损,其摩擦学性能一直备受关注。经过200多年的发展,牙科陶瓷材料的美观性和力学性能得到极大改善,陶瓷修复体的脆性断裂问题基本得到解决,然而,表面磨损诱发陶瓷修复体断裂失效问题仍时有发生[8-10],同时,随着牙科陶瓷材料力学性能的不断提高,陶瓷修复体诱发对颌天然人牙过度磨损问题日益凸显[11-13]。因此,亟须从摩擦学角度,尤其是与天然人牙摩擦学性能匹配角度出发,设计开发牙科陶瓷材料。本文综述了牙科陶瓷材料摩擦学性能的研究现状,归纳了典型摩擦学测试方法,从仿生摩擦学角度探讨了牙科陶瓷材料的未来发展趋势。
1 牙科陶瓷材料的力学性能
牙科修复体的主要功能是修复受损人牙的解剖形态并替代受损人牙行使生理功能,因此,天然牙齿组织的理化特性是牙科材料设计开发的重要参考和依据。天然人牙由牙釉质、牙本质、牙骨质和牙髓构成,其中,牙冠外层的牙釉质是承受咀嚼磨损的主要区域[1]。牙釉质由96%~97%(质量分数)的无机矿物质以及少量有机物质和水组成,弹性模量约为47~120 GPa,硬度约为2.7~6.4 GPa,挠曲强度约为60~90 MPa,断裂韧度约为0.5~2.5 MPa·m1/2[14-17]。
根据材料微观结构,牙科陶瓷材料可以分为长石质瓷、玻璃陶瓷、玻璃渗透陶瓷、多晶陶瓷和树脂渗透陶瓷五大类,如表1所示[5,18-47]。
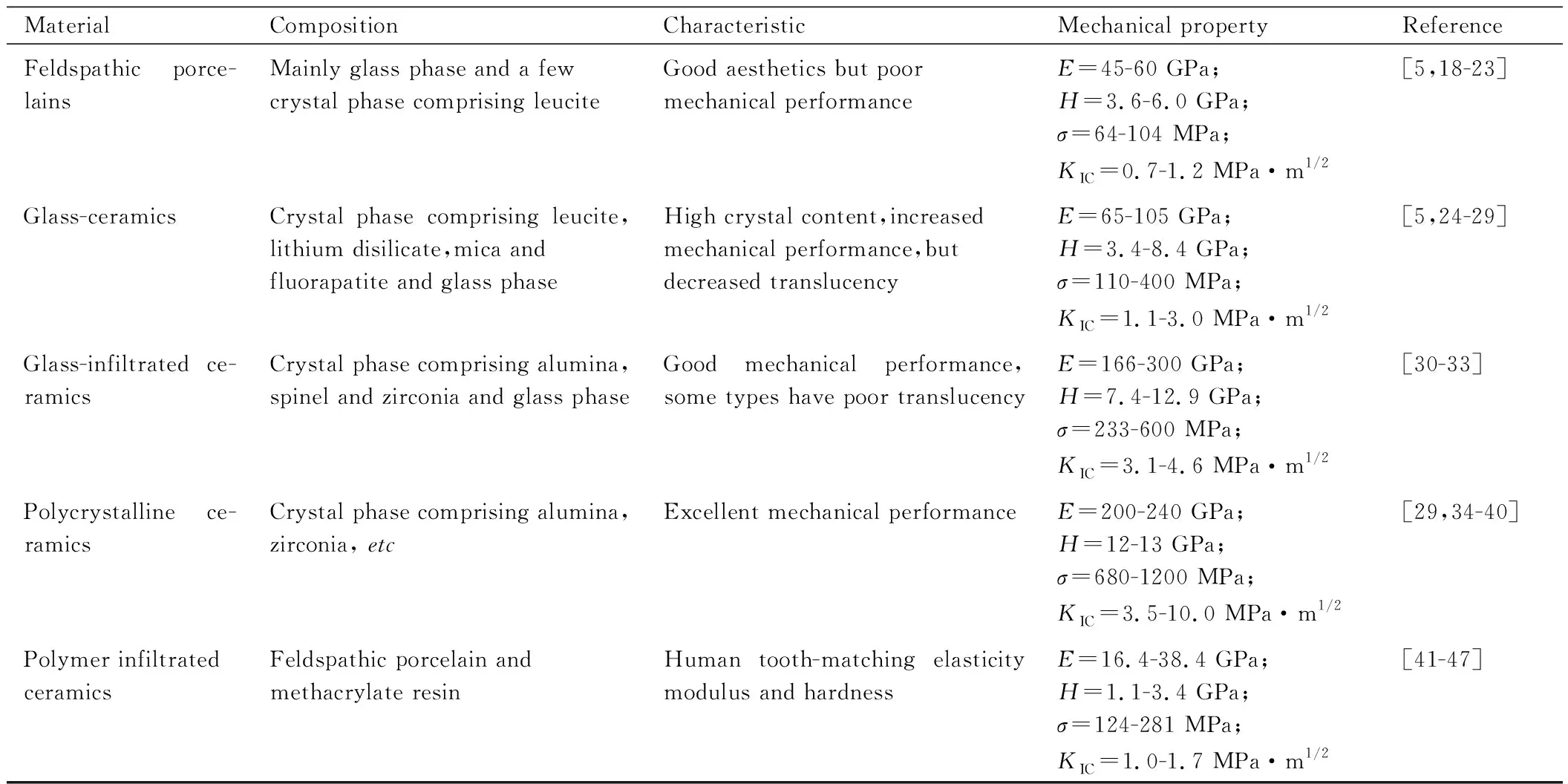
表1 牙科陶瓷材料分类[5,18-47]Table 1 Classification of dental ceramics[5,18-47]
长石质瓷是天然长石、石英和高岭土三组分经高温烧结而成的非晶玻璃材料,力学性能较差,但光学性能非常接近天然牙齿[5],主要用于制作贴面、嵌体、高嵌体、烤瓷熔附金属修复体和烤瓷熔附陶瓷修复体[19-20,22]。玻璃陶瓷的成分与长石质瓷相似,但晶体颗粒含量远高于长石质瓷[5],这些均匀嵌入玻璃相基质中的晶体颗粒充当增强体,阻止裂纹扩展、提高材料力学性能[24]。根据晶体成分不同,玻璃陶瓷分为白榴石玻璃陶瓷、二硅酸锂玻璃陶瓷、云母玻璃陶瓷和氟磷灰石玻璃陶瓷[28]。以二硅酸锂玻璃陶瓷为例,晶体颗粒含量高达70%(体积分数),弹性模量约为95 GPa,硬度约为6 GPa,挠曲强度约为400 MPa,断裂韧度约为3.0 MPa·m1/2[25,27]。得益于较高的力学性能和良好的光学特性,玻璃陶瓷广泛应用于制作贴面、嵌体、高嵌体以及前牙的单冠和三单元固定桥[26,29]。
玻璃渗透陶瓷是将熔融玻璃渗入预先制备的多孔陶瓷框架中制成,独特的玻璃/陶瓷互穿网络结构能够抑制裂纹萌生与扩展,提高材料整体强度[30]。根据陶瓷框架成分不同,玻璃渗透陶瓷分为玻璃渗透氧化铝陶瓷、玻璃渗透尖晶石陶瓷和玻璃渗透氧化锆陶瓷。玻璃渗透陶瓷的力学性能远优于长石质瓷和玻璃陶瓷,临床上常用于制作前后牙的单冠和三单元固定桥的底层结构[33]。随着强度和韧性更高的多晶陶瓷牙科材料问世,玻璃渗透陶瓷逐渐被取代并退出牙科材料市场。
多晶陶瓷是由晶体直接烧结而成的致密陶瓷材料,拥有极高的强度和刚度[29,37]。根据晶体成分不同,多晶陶瓷分为氧化铝陶瓷、氧化锆陶瓷以及氧化铝-氧化锆复合陶瓷,其中高韧性的氧化锆陶瓷在牙科修复领域的应用最广。氧化锆陶瓷具有三种主要晶型,分别为单斜相、四方相和立方相。纯氧化锆陶瓷在室温下只能以单斜相稳定存在,通过添加氧化钇、氧化钙和氧化镁等金属氧化物,能够制备出室温下部分稳定的四方相氧化锆陶瓷,其裂纹尖端在应力作用下发生相变生成单斜相并产生体积膨胀,对裂纹形成压应力,阻碍裂纹扩展。目前临床常用的氧化锆陶瓷是3%(摩尔分数,下同)氧化钇稳定的四方相氧化锆陶瓷,力学性能十分优异,但半透明性较差,多用于制作后牙的单冠和多单位固定桥的底层结构[35,38]。通过增加氧化钇含量,可以引入更多光学各向同性的立方相氧化锆,同时减少氧化铝颗粒和孔隙等二次相造成的光散射,能够有效提高氧化锆陶瓷的半透明性,目前已经开发出氧化钇含量为4%和5%的高透明氧化锆陶瓷[39]。
陶瓷材料的刚度和硬度较高,植入人体口腔后易引发对颌天然人牙过度磨损。为解决这一问题,德国VITA公司基于玻璃渗透陶瓷体系,开发了树脂聚合物渗透多孔陶瓷网络框架的新型复合材料[42],即树脂渗透陶瓷。树脂相的引入能够显著降低陶瓷材料的弹性模量、硬度和脆性,改善陶瓷修复体与天然人牙的刚度失配问题。以VITA公司推出的树脂渗透陶瓷Enamic为例,它含有质量分数为86%的长石质瓷和质量分数为14%的甲基丙烯酸酯树脂,弹性模量约为38 GPa,硬度约为2.4 GPa,挠曲强度约为150 MPa,断裂韧度约为1 MPa·m1/2,整体力学性能介于天然人牙釉质和牙本质之间[41,47]。近几年,研究人员采用氧化锆陶瓷作为框架材料,制备了树脂渗透氧化锆陶瓷[44-46],弹性模量约为59~88 GPa,硬度约为3.2~4.8 GPa,挠曲强度约为202~336 MPa,断裂韧度约为3.7~4.6 MPa·m1/2,力学性能更加接近人牙釉质。
2 牙科陶瓷材料的摩擦学性能
牙科陶瓷材料的磨损机制和磨蚀性与其化学成分和微观结构密切相关。表2[39,48-60]汇总了牙科陶瓷材料的磨损机制和磨蚀性。长石质瓷和玻璃陶瓷均由晶体颗粒和玻璃相组成,磨损机制主要为疲劳磨损诱发磨粒磨损,对人牙釉质的磨蚀性强;玻璃渗透陶瓷和多晶陶瓷的力学性能优异,能够有效抵抗表面破坏、抑制磨损,自身耐磨性佳,其中,多晶陶瓷的弹性模量和硬>度高,会引发天然人牙表面发生应力磨蚀和疲劳磨损;树脂渗透陶瓷的弹性模量和硬度与人牙釉质接近,磨蚀性低,但自身耐磨性不佳。
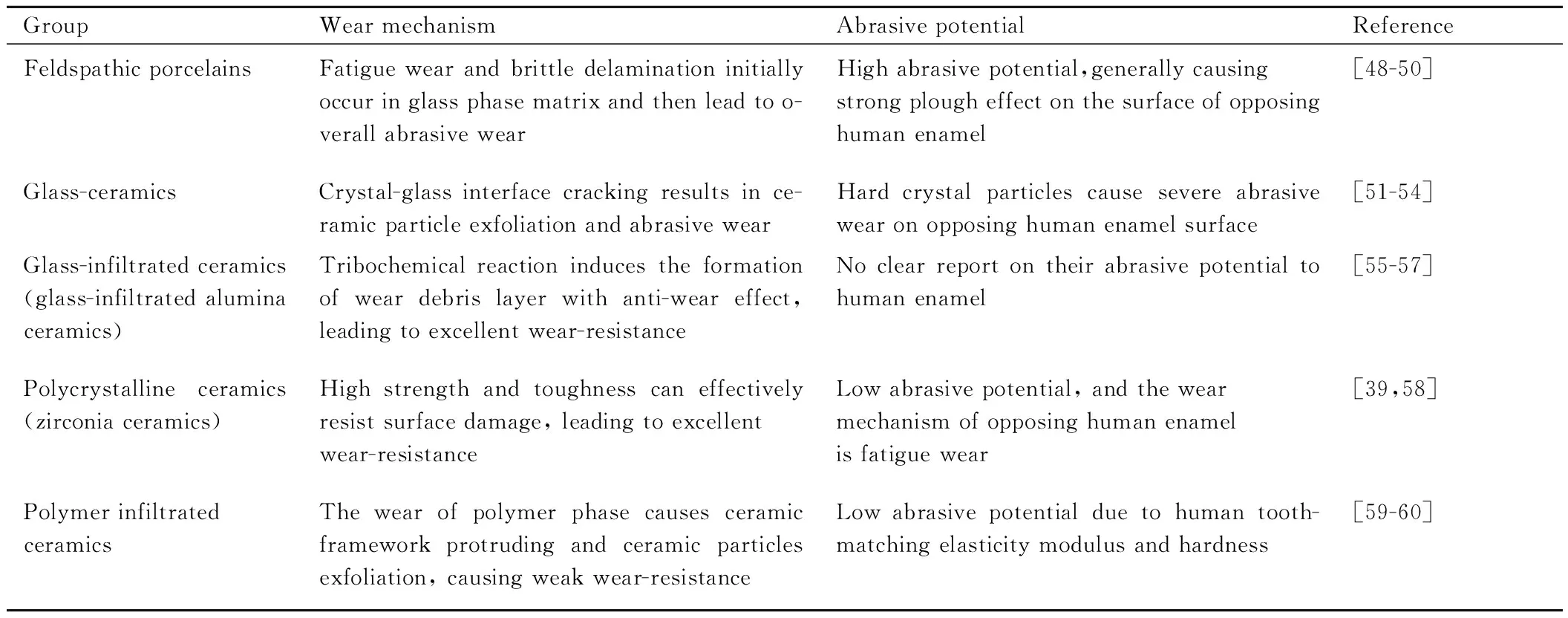
表2 牙科陶瓷材料的磨损机制与磨蚀性[39,48-60]Table 2 Wear mechanism and abrasive potential of dental ceramics [39,48-60]
2.1 牙科陶瓷材料的摩擦磨损机制
长石质瓷的主要成分是玻璃相基质,其机械强度低、抗疲劳性能差,在摩擦磨损过程中易发生疲劳开裂和剥落,进而引发剧烈磨粒磨损(图1(a))[50]。玻璃陶瓷的材料组成与长石质瓷类似,但晶体颗粒含量高,能够有效抑制玻璃相基质的开裂和剥落,提高材料耐磨性,不过,微裂纹容易在晶体颗粒-玻璃相基质界面萌生,高硬度的晶体颗粒一旦脱落,会造成接触表面剧烈磨损(图1(b))[51]。因此,玻璃陶瓷的摩擦学性能与晶体颗粒的种类、形状和尺寸密切相关。相比白榴石晶体,氧化锆晶体的强度和韧性更高,对玻璃陶瓷耐磨性的增强效果更显著[54];针状晶体边缘锋利且不易被磨钝,脱落后将显著加剧磨损,圆形晶体虽然较针状晶体更易脱落,但能够在接触界面滚动从而减轻磨损[52];减小晶体颗粒尺寸能有效抑制微裂纹萌生和晶体颗粒脱落,降低磨损[53]。

图1 牙科陶瓷材料磨损表面扫描电镜形貌(a)长石质瓷[50];(b)玻璃陶瓷[51];(c)玻璃渗透氧化铝陶瓷[56]Fig.1 SEM images of ceramic worn surface(a)porcelain[50];(b)glass ceramic[51];(c)glass-infiltrated alumina ceramic[56]
相比玻璃陶瓷,玻璃渗透陶瓷的晶体网络能够大幅度提高材料的强度、韧性和耐磨性。以玻璃渗透氧化铝陶瓷为例,其表面磨损以轻微擦伤为主,仅在少数晶体颗粒边界出现微裂纹(图1(c))[55-57]。此外,当摩擦界面存在水基介质时,氧化铝晶体通过摩擦化学作用转变成较软的水合氧化铝,作为柔性黏结剂与磨屑颗粒混合,形成转移膜覆盖在陶瓷表面,填平磨损表面的裂纹和剥落坑,并充当第三体调控界面剪切应力,从而避免陶瓷表面发生剧烈磨损[56]。
氧化锆陶瓷是目前力学性能最好的牙科陶瓷材料,抗疲劳性能优异,能够有效抵抗裂纹萌生和扩展,抑制表面磨损,耐磨性远高于长石质瓷和玻璃陶瓷[52,61-62]。在模拟口腔环境下,氧化锆陶瓷表面磨损轻微,以轻微擦伤和局部颗粒脱落为主,无开裂或剥落现象(图2)[39]。近几年全锆冠修复体的迅速普及使得高透明氧化锆陶瓷(高氧化钇含量)的临床需求日益增加。氧化锆陶瓷的强度和韧性随着氧化钇含量增加而下降,但最新研究结果表明,氧化钇含量分别为3%,4%和5%的氧化锆陶瓷的摩擦学性能并无显著性差异[39]。此外,水热老化会诱导氧化锆由四方相转变成单斜相,引发陶瓷表面开裂,这可能会导致氧化锆陶瓷的耐磨性能降低[63],但是,不同研究采用的老化处理方式不同,测试结果差异较大,目前尚无定论。

图2 氧化锆陶瓷磨损表面SEM形貌[39](a)磨损表面的犁沟;(b)图(a)中心区域的放大图Fig.2 SEM images of zirconia ceramic worn surface[39](a)ploughed furrows on the worn surface;(b)enlarged view of center part in fig.(a)
树脂渗透陶瓷是为了解决传统牙科陶瓷材料磨蚀性强这一难题而开发的新型陶瓷基复合材料,磨损机制与人牙釉质具有一定的相似性,但耐磨性能显著低于人牙釉质[59]。在磨损初期,树脂相先于陶瓷相发生磨损并脱落(见图3(b)中的圆圈),陶瓷框架逐渐暴露在磨损表面;随着循环次数增加,陶瓷颗粒剥落,磨损表面出现大量孔隙(图3(c))。需要指出的是,树脂聚合物的引入在显著降低牙科陶瓷磨蚀性的同时,会导致材料的耐磨性和化学稳定性显著降低[64-65],并存在树脂易染色等隐患。
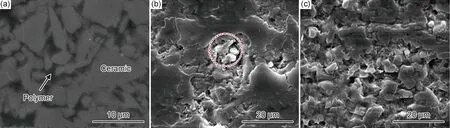
图3 树脂渗透陶瓷表面SEM形貌[59](a)原始表面;(b)磨损初期;(c)稳定磨损阶段Fig.3 SEM images of polymer-infiltrated ceramic surface[59](a)original surface;(b)worn surface at running-in stage;(c)worn surface at steady-state stage
2.2 牙科陶瓷材料对人牙釉质的磨蚀性
陶瓷修复体植入人体口腔后多与天然人牙直接接触摩擦。人牙釉质是人体内矿化程度最高、最硬的组织,对咀嚼磨耗具有较大的抵抗力,一旦磨损耗尽,将导致内层牙本质暴露,诱发多种口腔疾病[1]。因此,牙科陶瓷材料对人牙釉质的磨蚀性直接关系到修复体的临床应用。
长石质瓷的力学性能与人牙釉质十分接近,但诸多研究结果却显示长石质瓷对人牙釉质表现出高磨蚀性,这是因为长石质瓷脆性大,在摩擦磨损过程中容易发生开裂剥落,致使人牙釉质表面发生严重磨粒磨损(图4(a))[58]。提高长石质瓷的断裂韧度和抗疲劳性能是改善磨蚀性的有效途径。玻璃陶瓷对人牙釉质的磨蚀机制与长石质瓷相似,以诱发人牙釉质磨粒磨损为主,但其磨蚀性主要源于暴露或脱落的晶体颗粒[52,58,66-67]。因此,为了降低玻璃陶瓷的磨蚀性,除了改善玻璃基质的力学性能外,还需要加强玻璃相基质与晶体颗粒之间的相互作用,并优化晶体颗粒。
氧化锆陶瓷的强度和韧性极高,能够有效抵抗表面破坏,避免因材料脆性剥落引发的对颌天然人牙表面剧烈磨损,因此,氧化锆陶瓷的磨蚀性远低于长石质瓷和玻璃陶瓷[49,58,66,68]。但体内研究结果表明,氧化锆陶瓷修复体造成的对颌天然人牙磨损仍然大于天然人牙,这主要源于氧化锆陶瓷和人牙釉质之间刚度失配[69]。氧化锆陶瓷的弹性模量和硬度远大于人牙釉质,二者在接触对摩过程中,人牙釉质表面会出现应力集中,并引发应力磨蚀(图4(b))。此外,氧化锆陶瓷对人牙釉质的磨蚀性与其表面处理密切相关[70-72]。氧化锆陶瓷抛光表面与人牙釉质接触对摩时,牙釉质磨损轻微,表面无明显破坏,粗糙表面则会导致人牙釉质发生严重磨粒磨损,磨损表面呈现犁削现象[58],而上釉处理会显著提高氧化锆陶瓷表面粗糙度,加剧陶瓷修复体对人牙釉质的磨蚀[70,72-73]。因此,通过材料改性降低氧化锆陶瓷材料的弹性模量和硬度,并对修复体表面进行精细抛光加工,是改善磨蚀性的有效途径。
玻璃渗透陶瓷常用作全瓷修复体的底层结构,较少与对颌天然人牙直接接触对摩,对人牙釉质的磨蚀性鲜见报道。有研究发现,玻璃渗透氧化铝陶瓷会造成对摩件羟基磷灰石陶瓷表面严重开裂和剥落[55,57],但羟基磷灰石陶瓷自身韧性不佳可能是其表面发生严重脆性破坏的原因之一。树脂渗透陶瓷是目前磨蚀性最低的牙科陶瓷材料,在与人牙釉质对摩时,材料表面暴露出的陶瓷框架或脱落的陶瓷颗粒会引发人牙釉质表面发生轻微磨粒磨损(图4(c))[60]。

图4 人牙釉质磨损表面SEM形貌(a)与长石质瓷对摩[58];(b)与氧化锆陶瓷抛光表面对摩[58];(c)与树脂渗透陶瓷对摩[60]Fig.4 SEM images of enamel worn surface(a)against porcelain[58];(b)against zirconia polished surface[58];(c)against polymer-infiltrated ceramic[60]
综上所述,现有牙科陶瓷材料与人牙釉质的摩擦学性能相去甚远,这是陶瓷修复体磨蚀性强、易导致对颌天然人牙过度磨损的主要原因。
3 摩擦学性能体外测试方法
摩擦学性能评价对牙科陶瓷材料的临床应用和新材料研发至关重要。体内测试是评估陶瓷牙科修复体磨损和磨蚀性能的理想方法[8]。由于受试者口腔环境、咀嚼习惯以及牙齿宏观形态和微观结构的个体差异,体内研究通常昂贵耗时且测试结果分散性较大,一般作为牙科陶瓷材料摩擦学性能评价的最后一步。体外研究可以控制摩擦磨损工况参数,不仅有助于揭示牙科陶瓷材料的磨损机制,而且可以在标准化条件下评估不同牙科陶瓷材料的磨损和磨蚀性能。目前,牙科陶瓷材料摩擦学性能的体外测试大多采用往复式和销盘式摩擦磨损试验机[49,52,61,65],如图5所示。摩擦磨损测试的工况参数主要涉及以下三个方面。
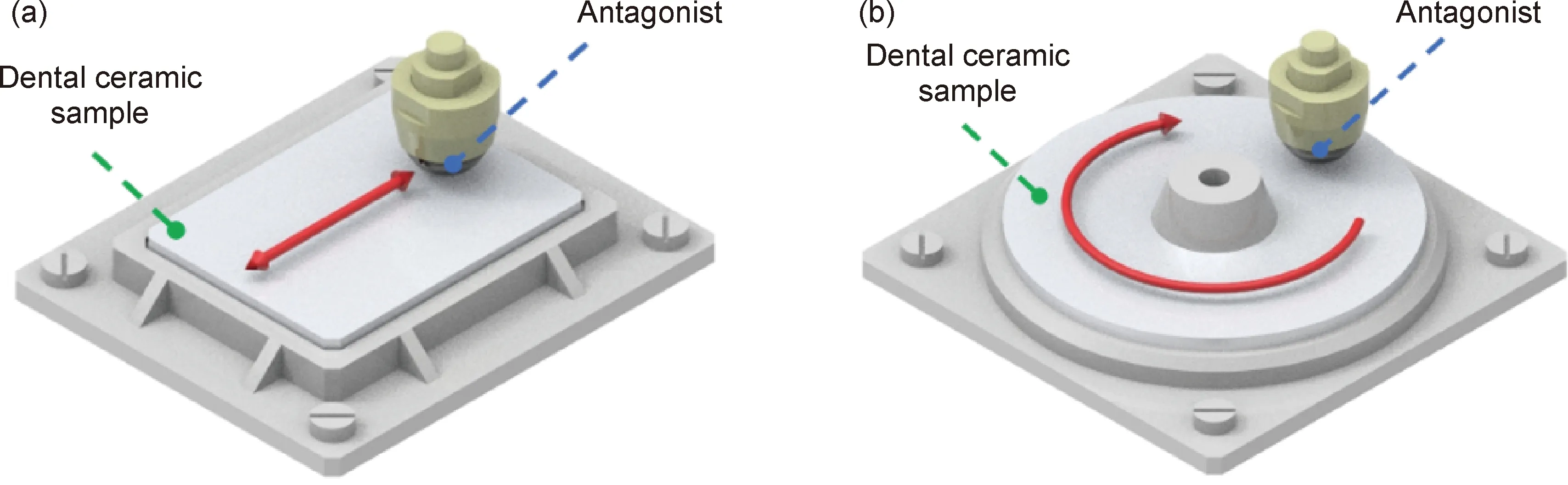
图5 摩擦磨损试验机示意图 (a)往复式;(b)销盘式Fig.5 Schematic illustration of wear testing machine (a)reciprocating;(b)pin-on-disc
3.1 实验介质
唾液是口腔环境最重要的化学组分,无色无味,pH值为6.6~7.1,具有润滑、调节口腔环境和促进消化等多种功能[74]。唾液的成分复杂,主要由水(98.5%~99%,质量分数)、蛋白质、无机物及微量元素等构成[75]。大部分体外研究采用水或者人工唾液代替天然唾液作为润滑介质使用[51,58,61,72],常用人工唾液的配方为:氯化钠0.4 g,氯化钾0.4 g,二水氯化钙0.795 g,二水磷酸二氢钠0.78 g,九水硫化钠0.005 g,尿素1 g,蒸馏水1000 mL。随着世界范围酸性食品和饮料(pH值约为1~6)的消费量快速增加,牙齿和修复体暴露在酸性口腔环境变得愈加普遍[62,76]。考虑到陶瓷材料中的玻璃成分在酸性环境下会选择性释放碱性离子,加速材料老化,一些研究选用盐酸、乙酸和柠檬酸等溶液充当酸性介质,考察牙科陶瓷材料的磨损行为[64,77]。此外,一些研究还选用食物浆料作为第三体,考察牙科陶瓷材料在三体磨粒磨损工况下的摩擦学行为[70,78]。
3.2 摩擦副
合理选择对摩副对研究牙科陶瓷材料磨损机制和考察牙科陶瓷材料磨蚀性均十分重要。采用天然人牙牙尖作为对摩副能够尽可能地模拟口腔内天然牙和修复体之间的摩擦接触,然而,天然牙尖几何形状不规则且个体差异极大,难以用于牙科陶瓷材料磨蚀性的定量表征[48,68,71]。因此,Palmer等提出采用机加工方式制备几何形状标准化的人牙牙尖[79]。然而,Heintze等[11]采用两种人牙牙尖作为对摩副考察几种典型牙科陶瓷材料的磨蚀性,发现标准化人牙牙尖作为对摩副并不能降低磨蚀性测试结果的分散性,由此推测分散性主要源于天然人牙微观结构与成分的差异。
考虑到天然人牙的主要成分是羟基磷灰石,一些研究选择合成羟基磷灰石陶瓷替代天然牙齿作为对摩副[57,80],需要指出的是,尽管成分相似,但两者的摩擦学性能差异极大[81]。滑石因其硬度与人牙釉质接近常被用于考察牙科陶瓷材料的磨蚀性[39,52],然而,已有研究报道滑石与人牙釉质的摩擦学性能存在显著差异[82]。此外,氧化锆陶瓷、氧化铝陶瓷和氮化硅陶瓷等具有高耐磨性的材料被广泛用作标准对摩副,评价牙科陶瓷材料的耐磨性[27,50,52,64],其优势在于能够在摩擦磨损测试过程中基本保持形状不变,从而避免对摩副表面变化对测试结果产生影响。
3.3 载荷、位移和循环次数
在口腔环境中,正常咀嚼过程中对颌牙之间的咬合力介于3~36 N,滑动位移为0.9~1.2 mm,咀嚼频率不高于2 Hz,每天的总接触行程约为100 m[83-85]。现有体外研究采用的测试参数差异较大,其中,法向载荷在0.4~75 N之间,滑动位移在0.25~5 mm之间,往复运动频率在1~4 Hz之间,循环次数在几千到上百万次之间[6,49,50,56,58,62,68,86]。
4 牙科陶瓷材料的发展趋势与研究方向
陶瓷材料因其优异的耐磨性、化学稳定性、生物相容性和美观性,广泛用于牙齿缺失与缺损临床修复,并在牙科修复领域占据越来越重要的位置。早期的牙科陶瓷材料强度低、韧性差,研究主要关注磨损引发的陶瓷修复体脆性断裂失效问题。通过不断优化材料成分和结构,牙科陶瓷材料的力学性能大幅提升,磨损诱发断裂失效问题得到逐步改善,然而,牙科陶瓷材料的高弹性模量和高硬度会引发天然人牙表面发生应力磨蚀。引入柔性树脂相可以降低陶瓷材料刚度、改善磨蚀性,但同时会导致材料耐磨性显著下降。目前,牙科陶瓷材料和天然人牙的摩擦学性能失配已成为制约陶瓷修复体临床应用的核心问题。
理想的牙科修复材料应当具有与人牙釉质相似的摩擦学性能,以便在兼具耐磨性的同时不加剧对颌天然人牙磨损。人牙釉质是一种天然结构材料,耐磨性能优异,在口腔内的年均磨损深度仅为15~29 μm[87-88],能够承受数百万次咀嚼循环。研究表明,人牙釉质优异的摩擦学性能与其独特的跨尺度多级结构密切相关[81,89-91]。牙釉质的最小结构单元是纳米尺寸的羟基磷灰石晶体颗粒,这些纳米颗粒通过界面蛋白质粘接组装成纳米纤维束,进而平行排列组装成微米尺寸的锁孔状釉柱,相邻釉柱被矿化程度稍低的釉间质隔开,形成软硬相间的微观结构[92],如图6所示。在摩擦磨损过程中,人牙釉质内由羟基磷灰石晶体-界面蛋白-羟基磷灰石晶体相间排列而成的纳米结构能够有效耗散能量、降低磨损,而软硬相间的釉柱-釉间质微米结构则能够抑制裂纹扩展,避免人牙釉质在服役过程中发生灾难性断裂失效[81,89,93]。通常,较软的釉间质先于釉柱发生磨损,随后,釉柱发生挤压变形并剥落去除[94]。从牙齿中来,到牙齿中去,基于天然人牙的摩擦学构效关系,从材料微纳结构设计角度出发,研制仿生陶瓷基复合材料应该是解决陶瓷修复体与天然人牙摩擦学性能失配难题最具潜力的策略。因此,成分复合化和结构仿生化是下一代牙科陶瓷材料的主要发展趋势与研究方向。
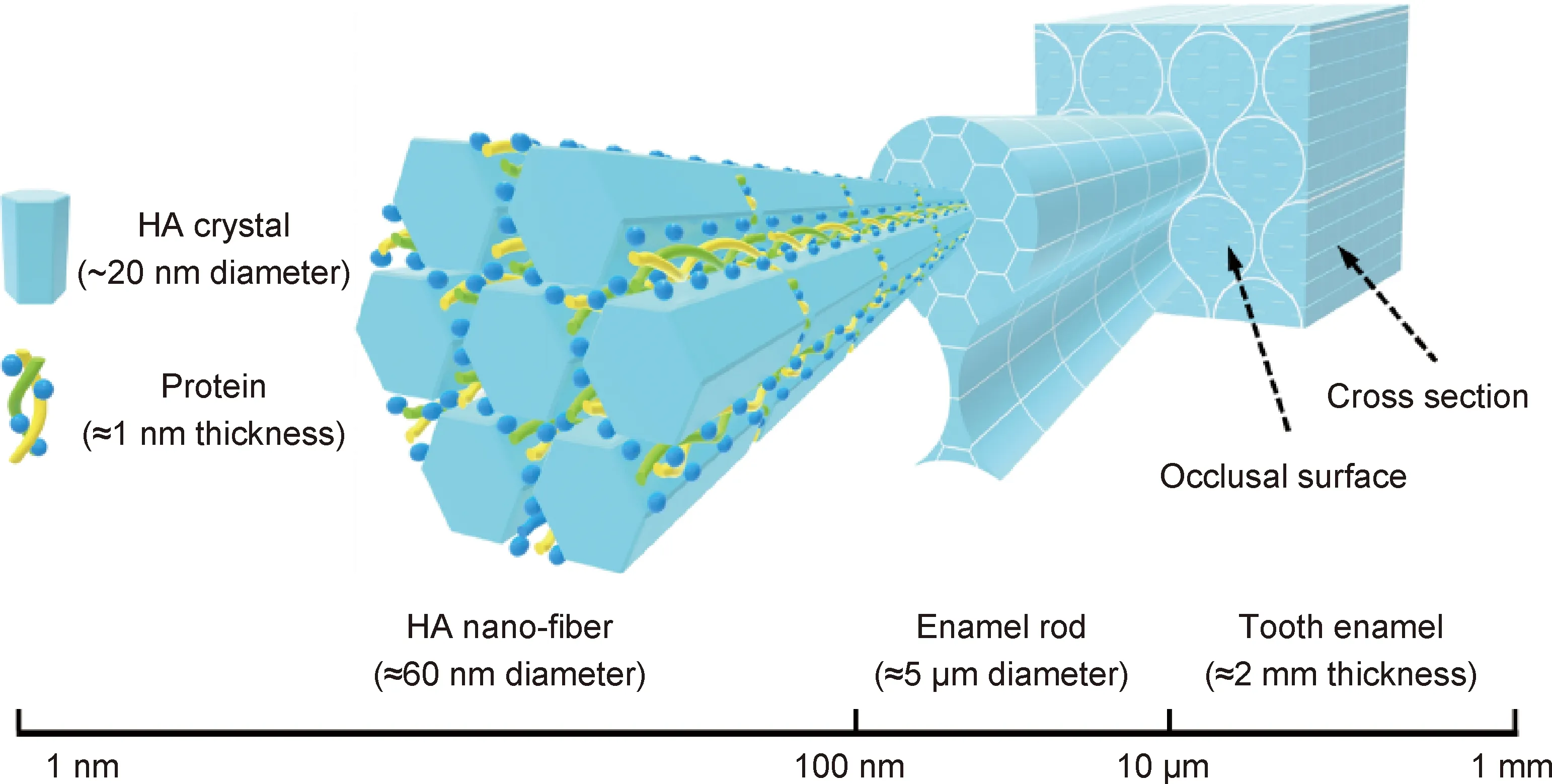
图6 人牙釉质跨尺度多级结构示意图[89]Fig.6 Schematic diagram of the hierarchical structure of tooth enamel[89]
5 结束语
巨大的临床需求使得牙科陶瓷材料拥有广阔的应用前景和市场,近年来牙科陶瓷材料的研究开发受到了前所未有的关注和重视。牙齿是人体内最重要的咀嚼器官,牙科陶瓷材料的耐磨性及其对人牙釉质的磨蚀性直接关系到陶瓷修复体的临床应用。
早期的牙科陶瓷材料强度低、韧性差,易造成陶瓷修复体自身和对颌天然人牙严重磨粒磨损。通过材料成分和结构优化,牙科陶瓷材料的力学性能和耐磨性得到大幅提高,磨蚀性显著降低,然而,现有牙科陶瓷材料与天然人牙的摩擦学性能仍相去甚远,这是陶瓷修复体自身过早失效以及对颌天然人牙过度磨损的主要原因。天然人牙的摩擦学性能优异,这与自身独特的微观结构密切相关,因此,从仿生摩擦学角度出发,基于天然人牙的摩擦学构效关系设计制备结构化牙科陶瓷材料,应该是解决陶瓷修复体与天然人牙摩擦学性能失配难题最具潜力的策略。
需要指出的是,体外研究是评价牙科陶瓷材料摩擦学性能的主要手段。目前,体外测试方法和参数不一,这导致不同机构的研究结果难以对比,甚至相互矛盾,而且大多数体外研究结果与临床测试结果缺少相关性,无法有效指导牙科陶瓷材料的临床应用和新型牙科陶瓷材料的研制。因此,亟须研究制定牙科陶瓷材料摩擦学性能体外测试规范和标准。
