次磷酸钠对锌-镍合金电沉积和镀层耐蚀性的影响
2022-02-24刘军松潘秀田驰
刘军松,潘秀,田驰
(中国振华集团云科电子有限公司,贵州 贵阳 550018)
20世纪80年代,科研学者们发现锌-铝合金的耐蚀性比纯镀锌层好,锌基合金逐渐开始进入人们的视野[1],其中锌-镍合金在各方面表现出较为优异的性质,在工业实际生产中已得到广泛的应用[2-6]。为了进一步提高锌-镍合金镀层的耐蚀性及硬度、疏水性、磁性等其他方面的性能,近年来不少研究人员在锌-镍合金的基础上进一步改进提升,主要是在锌-镍合金中掺入第3种元素或者纳米颗粒,以进一步提升镀层的防护性能,减缓材料的腐蚀,延长设备寿命,具有极大的意义和价值。如Popescu等[7]在氯化物电镀锌-镍合金体系中加入次磷酸钠来镀制锌-镍-磷合金镀层,结果表明这种合金具有很好的磁性,热处理温度达到900 K后磁性有很大的转变,在电子、电器等设备方面具有很大的应用潜力。自从1963年Brenner[8]提出将P元素掺入Ni-P镀层中能显著改善其硬度、耐蚀性等性能以来,许多学者开始研究掺入P元素对其他镀种性能的影响,其中包括对锌-镍-磷合金沉积机理和镀制工艺的探索[9-14]。为了进一步优化锌-镍-磷合金电镀工艺,本文采用电化学分析的方法研究了添加次磷酸钠对锌-镍合金的电沉积行为以及镀层微观形貌和耐蚀性的影响。
1 实验
1.1 电镀基材
小槽试验的基材为50 mm × 50 mm × 2 mm的45钢,赫尔槽试验采用10 cm × 6 cm × 0.1 cm的镀锌铁片。
1.2 锌-镍合金基础镀液配方及工艺条件
氯化锌80 g/L,氯化镍120 g/L,乙酸铵80 g/L,乙酸钠40 g/L,乙二胺四乙酸二钠(EDTA-2Na )4 g/L,氯化钾180 g/L,十二烷基硫酸钠(SDS)0.04 ~ 0.10 g/L,电流密度0.5 ~ 5.0 A/dm2,pH 4 ~ 5,温度30 ~ 50 °C,电镀时间20 min,镍板阳极。
1.3 电化学测试
采用武汉科思特公司的CS350H型电化学工作站,室温下进行循环伏安(CV)测量,在三电极体系中以配制的镀液为测试液,工作电极为直径3 mm的玻碳电极(工作面积为0.070 65 cm2),参比电极为饱和甘汞电极(SCE),对电极为铂电极(面积1 cm2),扫描速率为20 mV/s,扫描电势范围为-1.5 ~ 1.0 V。
在3.5%的NaCl溶液中,以Pt电极为对电极,SCE为参比电极,工作电极为直径1 cm(面积0.758 cm2)的圆形镀层试样。先进行电化学阻抗谱测试,交流振幅5 mV,频率从10 kHz至0.01 Hz,再进行塔菲尔曲线测试,扫描速率为2 mV/s,扫描电位范围为-1.5 ~ 1.0 V。
1.4 微观结构表征
采用日本日立仪器有限公司的SU-1500型扫描电子显微镜(SEM),在不同位置和不同倍数下观察镀层微观形貌,并用扫描电镜自带的能谱仪(EDS)对镀层组成进行打点分析,采用荷兰帕纳科公司公司的Zetium-Ultimate型X射线荧光光谱仪(XRF)对镀层组成含量进行面扫描分析。
采用荷兰帕纳科公司的X’Pert PRO MPD型X射线衍射仪(XRD)分析镀层的相组成,Cu靶辐射,管电压40 kV,管电流40 mA,扫描速率0.02°/s,扫描范围(2θ)20° ~ 100°。
2 结果与讨论
2.1 循环伏安分析
在室温下采用循环伏安法分析次磷酸钠对Zn2+和Ni2+电沉积行为的影响,测试镀液组成如下:
(a) 基础溶液:CH3COONH480 g/L,CH3COONa 30 g/L,EDTA-2Na 4 g/L,KCl 180 g/L,SDS 0.08 g/L,pH 5。
(b) 基础溶液 + 10 g/L次磷酸钠。
(c) 基础溶液 + 80 g/L ZnCl2。
(d) 基础溶液 + 100 g/L NiCl2·6H2O。
(e) 基础溶液 + 100 g/L NiCl2·6H2O + 10 g/L次磷酸钠。
(f) 基础溶液 + 80 g/L ZnCl2+ 10 g/L次磷酸钠。
(g) 基础溶液 + 80 g/L ZnCl2+ 100 g/L NiCl2·6H2O。
(h) 基础溶液 + 80 g/L ZnCl2+ 100 g/L NiCl2·6H2O + 10 g/L次磷酸钠。
溶液a为镀液配方的基础成分,作为空白背景对照;溶液b用于考察次磷酸钠在基础溶液中单独存在时的氧化还原行为;溶液c和d是为了分别考察基础溶液中Zn2+和Ni2+的氧化还原行为;溶液e用于考察次磷酸钠和Ni2+共存时的氧化还原行为;溶液f是为了考察次磷酸钠和Zn2+共存时的氧化还原行为;溶液g和h用于考察添加次磷酸钠与Zn2+、Ni2+共同存在时的氧化还原行为。
图1中基础溶液所测得的循环伏安曲线在正向扫描时出现了一个平缓的峰,但峰电流值很小,为3.8 mA,可能是基础溶液中的有机物会发生少量的氧化反应,从-1.26 V开始电流变为负值,阴极电流开始增加,表明基础溶液开始析氢;而在基础溶液中添加次磷酸钠后测量循环伏安曲线时,正向扫描中未出现氧化峰,负向扫描时电流在-1.21 V后变为负值,说明添加次磷酸钠后析氢电位正移了50 mV。
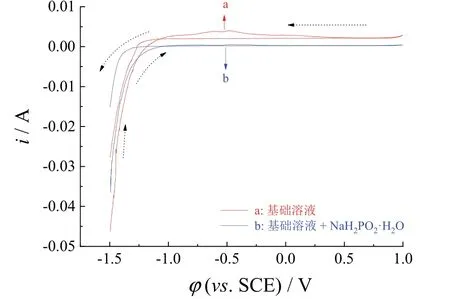
图1 无次磷酸钠(a)和有次磷酸钠(b)的基础溶液的循环伏安曲线Figure 1 CV curves of (a) base solution and(b) base solution + NaH2PO2·H2O
从图2中基础溶液里只有Zn2+单独存在时的循环伏安曲线可知,在负向扫描至-1.11 V时阴极电流开始增加,表明溶液中的Zn2+开始被还原,负扫至-1.25 V时出现一个明显的还原峰。正向扫描过程中,电位超过-1.12 V时阳极电流开始增加,表明Zn2+在此时开始被氧化,另外Zn开始被氧化时和开始被还原时的电位相同,说明在基础溶液的背景下Zn2+/Zn的平衡电位为-1.12 V。基础溶液中Ni2+单独存在时的循环伏安曲线显示,负向扫描过程中在-0.76 V时阴极电流开始增加,表明Ni开始被还原沉积,正扫过程中从-0.25 V开始阳极电流增加,表明镍开始氧化溶解,扫描至0.69 V时出现一个较大的氧化峰。
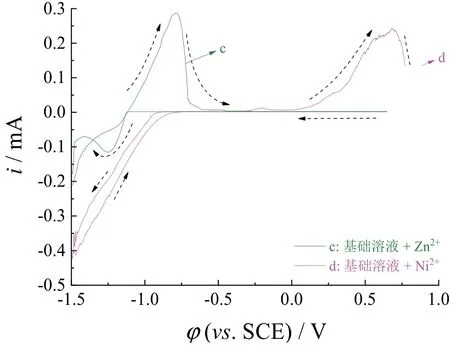
图2 Zn2+(c)和Ni2+(d)在基础溶液中单独存在时的循环伏安曲线Figure 2 CV curves of base solution containing Zn2+ (c) and Ni2+ (d), respectively
图2表明Zn2+和Ni2+在基础溶液中的循环伏安曲线都是完全不可逆过程,且在负向扫描时都存在感抗性电流环,说明在同一电位负扫时的电流要大于正扫时的电流。这是因为在基础溶液中Zn2+和Ni2+受到CH3COO-、EDTA的配位而形成螯合物,使金属离子被还原沉积时需要克服过电位,而金属氧化溶解时不需要克服过电位。感抗性电流环的存在也说明Zn2+和Ni2+单独沉积时都是成核生长[15]。
由图3可知,在含Ni2+的基础溶液中添加次磷酸钠后Ni2+的还原沉积电位为-0.65 V,比无次磷酸钠时正移了0.11 V,表明次磷酸钠的添加有助于Ni的沉积,使得Ni2+的还原变得更容易。曲线e负向扫描至-1.3 V时出现一个明显的还原峰,应为Ni-P共沉积的还原峰。对比曲线d和曲线e可知,未添加次磷酸钠时的阴极电流比添加次磷酸钠后的阴极电流小。阴极电流增大说明阴极发生还原的反应速率增大,还原沉积速率加快,且还原电位正移说明次磷酸钠的添加加速了Ni的沉积。在正扫过程中,曲线d正扫至0.69 V时对应着Ni的氧化峰,曲线e正扫至0.25 V时对应着Ni-P的氧化峰。
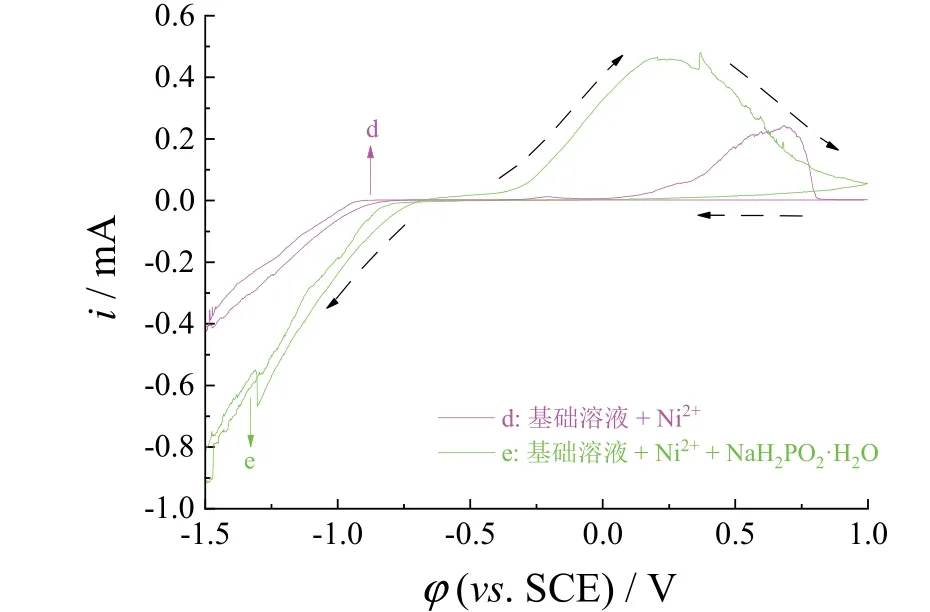
图3 基础溶液 + 100 g/L NiCl2·6H2O(d)和基础溶液 +100 g/L NiCl2·6H2O + 10 g/L次磷酸钠(e)的循环伏安曲线Figure 3 CV curves of (d) base solution + 100 g/L NiCl2·6H2O and (e) base solution + 100 g/L NiCl2·6H2O + 10 g/L NaH2PO2·H2O
基础溶液中80 g/L ZnCl2和10 g/L次磷酸钠共存时的循环伏安曲线(图4中曲线f)显示,在负向扫描至-1.13 V时电流变为负值,阴极电流开始增加,在-1.29 V时出现一个还原峰。对比曲线c和f可看出添加次磷酸钠后还原电位和还原峰的位置略有负移,这归因于次磷酸钠添加使溶液中离子浓度增加,溶液电导率随之增加,导致Zn2+的沉积电位有轻微的改变,但总体来说在基础溶液中添加次磷酸钠对Zn2+的沉积影响不大。正扫过程中在-1.12 V时曲线c和f的阳极电流开始增加,表明阴极上的还原产物开始发生氧化,添加次磷酸钠后正扫时的氧化电流小于未添加次磷酸钠时正扫的氧化电流,说明次磷酸钠的添加会减缓还原物的氧化。
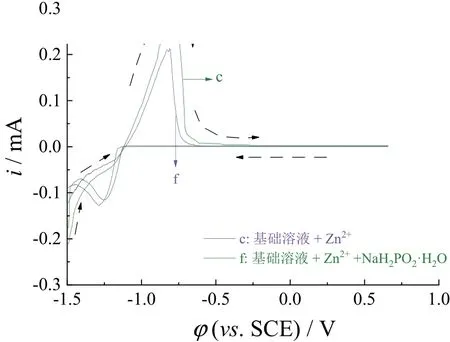
图4 基础溶液 + 80 g/L ZnCl2(c)和基础溶液 + 80 g/L ZnCl2 + 10 g/L次磷酸钠(f)的循环伏安曲线Figure 4 CV curves of (c) base solution + 80 g/LZnCl2 and(f) base solution + 80 g/L ZnCl2 + 10 g/L NaH2PO2·H2O
图5中曲线g在负扫至-1.16 V时阴极电流增加,表明金属离子在阴极上开始被还原,对比曲线h的初始还原电位-1.14 V,添加次磷酸钠后溶液中Zn2+和Ni2+的还原电位负移了0.02 V,说明添加次磷酸钠对沉积电位的影响不明显。从之前的实验结果可知,次磷酸钠有利于Ni的沉积,而对Zn的沉积影响不大。但是,在Zn2+、Ni2+、次磷酸钠同时存在的溶液中,正扫时的氧化电流峰值比只含有Zn2+和Ni2+的溶液正扫时的氧化电流峰值小得多。
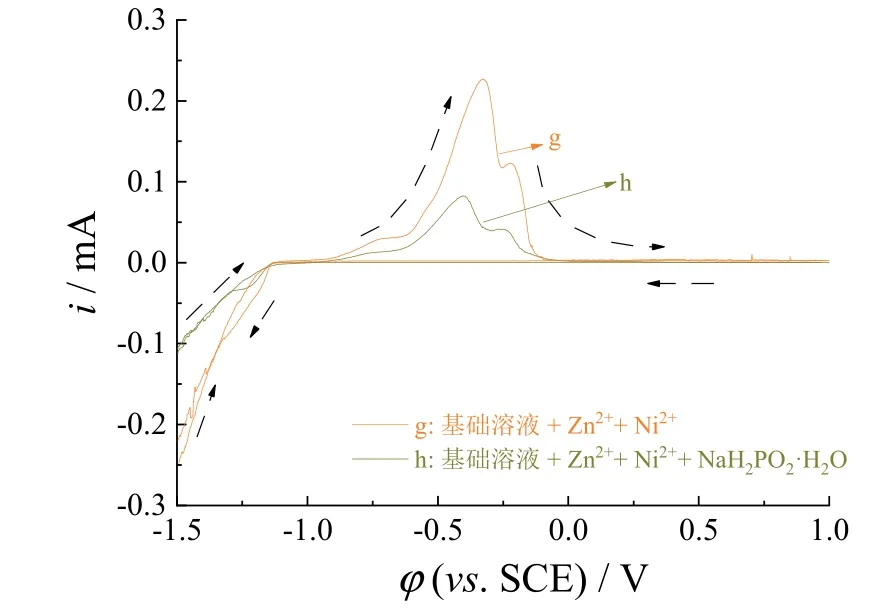
图5 基础溶液 + 80 g/L ZnCl2 + 100 g/L NiCl2·6H2O(g)和基础溶液 + 80 g/L ZnCl2 + 100 g/L NiCl2·6H2O +10 g/L次磷酸钠(h)的循环伏安曲线Figure 5 CV curves of (g) base solution + 80 g/L ZnCl2 +100 g/L NiCl2·6H2O and (h) base solution + 80 g/L ZnCl2 +100 g/L NiCl2·6H2O + 10 g/L NaH2PO2·H2O
2.2 pH对锌-镍-磷循环伏安曲线的影响
如图6所示,不同pH的测试液在负向扫描过程时阴极电流都在-1.13 V后开始增加,表明发生了还原反应,Zn、Ni、P开始沉积,不同pH的测试液都在-0.4 V附近出现了还原电流峰,可见pH对还原沉积电位的影响不大,但在负扫过程中较低pH时发生还原反应的峰电流比在较高pH下的还原峰电流更大,表明在pH较低时发生还原沉积反应的速率更快,更有利于共沉积的发生;同样,在正扫过程中,pH较低时对应的电流要比pH较高时的峰电流大,表明pH较低时沉积的镀层发生氧化溶解的速率更快。考虑到沉积速率,确定pH为4.5时较为适宜。
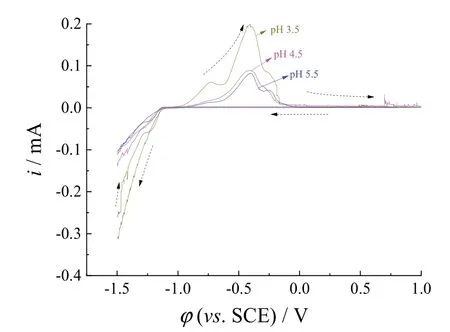
图6 pH对基础溶液 + 80 g/L ZnCl2 + 100 g/L NiCl2·6H2O + 10 g/L次磷酸钠的循环伏安曲线的影响Figure 6 Effect of pH on CV curve of the base solution containing ZnCl2 80 g/L, NiCl2·6H2O 100 g/L, and NaH2PO2·H2O 10 g/L
2.3 电流密度和pH对镀层外观的影响
图7示出了不同电流密度下进行小槽电镀所得到镀层的外观。当电流密度为0.6 A/dm2时,镀片外观为略带光泽的深黑色,致密平整,晶粒细致,结合力较好;当电流电流密度增大至0.8 A/dm2时,镀层光泽增加,变成亮黑色,晶粒细致平整,未出现针孔、毛刺、粗糙等不良现象;增大电流密度到1.0 A/dm2时镀层外观变成了银白色,但出现轻微发雾现象,继续增大电流密度到1.2 A/dm2时镀层外观变成灰白色。镀层外观变化的主要原因可能是镀层成分发生了变化。于是采用XRF对镀片进行面扫描,以确定镀层的成分。

图7 电流密度对镀层外观的影响Figure 7 Effect of current density on appearance of coating
从图8可观察到随着电流密度增大,镀层中Ni和P的含量呈降低趋势,镀层中Zn含量的比例随电流密度的增大而增大,在低电流密度时Ni、P含量较高,表明此时Ni与P之间的协同共沉积效应更为明显,Ni与Zn是正常共沉积。随着电流密度增大,镀层中Ni、P含量下降,Zn含量增加,原因可能是Zn的大量沉积会在阴极产生Zn(OH)2胶体膜,Ni2+需要穿过胶体膜到达阴极界面才能被还原,胶体膜的阻碍导致了Ni含量下降。由于Ni、P存在协同共沉积效应,Ni的沉积减少会导致P的还原沉积也减少,因此Ni、P含量均随电流密度增大而呈下降趋势。另外,当电流密度增大到一定之后,锌、镍的共沉积表现为异常共沉积。在较大电流密度下的沉积过程中,锌、镍之间异常共沉积的影响大于Ni、P之间协同效应的影响,锌-镍异常共沉积占主导作用,镀层中锌、镍的含量愈发悬殊。电流密度对镀层中P含量的影响极大,当电流密度小于0.6 A/dm2时可得到P质量分数大于10%的镀层,电流密度大于1 A/dm2后只得到低P质量分数(0.4% ~ 0.9%)的镀层。
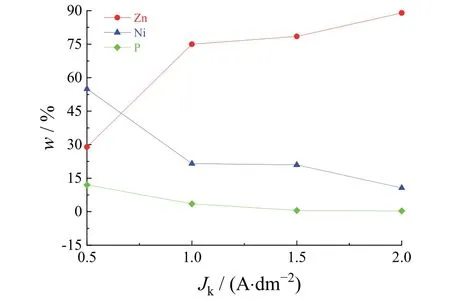
图8 电流密度对镀层成分的影响Figure 8 Effect of current density on composition of coating
2.4 温度对锌-镍-磷共沉积的影响
如图9所示,随着温度的升高,镀层中Zn含量呈减低的趋势,Ni和P含量增加。这归因于Ni与P之间存在的相互催化促进作用,在锌-镍-磷共沉积时P以新还原的Ni为反应催化中心进行还原沉积,温度升高将导致Ni-P之间的相互协同共沉积速率加快,以致镀层的Ni与P的含量都增加,但在实验过程中发现当温度超过50 °C后,镀层发灰发雾现象较为严重,镀层形貌和质量变差,因此温度取45 °C为宜。
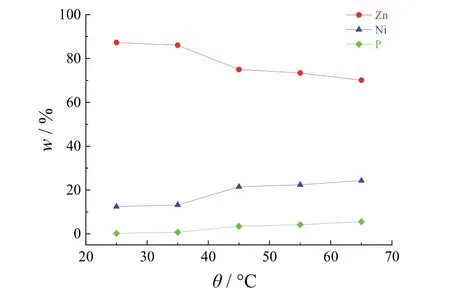
图9 温度对镀层成分的影响Figure 9 Effect of temperature on composition of coating
2.5 镀层性能表征
由图10a可见锌-镍合金镀层存在较多的裂纹,裂纹的存在是直接导致其防护性能不强的原因之一,腐蚀介质可通过裂纹直接腐蚀到基体。当放大到20 000倍时,镀层呈现出不规则紧密嵌布的“花岗岩状”,晶粒比较粗大(见图10b)。P质量分数小于1%的镀层的形貌图中裂纹完全消失,晶粒细致平整,无裂纹、针孔、凹陷、凸出等不良现象,说明镀层中P元素的掺入可以细化镀层晶粒、消除镀层裂纹,裂纹的消失是导致镀层耐蚀性提升的直接原因之一;P质量分数大于10%的镀层也无裂纹存在(见图10e),但相对于P质量分数<1%的镀层,其微观形貌粗糙不整,存在很多圆形胞状凸出(见图10f)。可见镀层中P掺入量过大会导致晶粒粗化,晶胞变大,最终有可能导致镀层的防腐蚀性能和机械性能下降。

图10 3种P含量的镀层的SEM照片Figure 10 SEM images of three coatings with different contents of P
采用EDS对镀层含量进行打点测定,结果如下:P质量分数小于1%的镀层含Zn 78%(质量分数,下同)、Ni 19.5%、P 0.84%,其余为Fe和O;P质量分数大于10%的镀层含Zn 47.6%、Ni 41.5%、P 10.2%,其余为Fe和O。上述结果与XRF面扫描的结果(见表1)略有偏差而已。
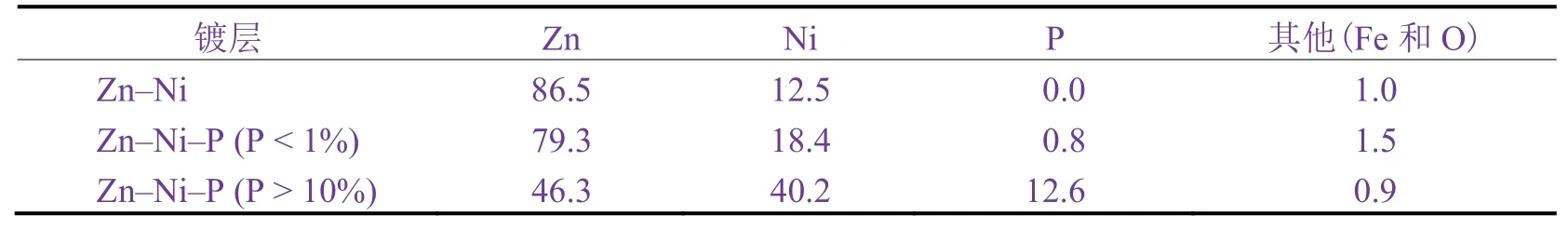
表1 XRF测定的镀层中各元素的质量分数Table 1 Mass fraction of individual element in coating determined by XRF(单位:%)
2.6 锌-镍-磷合金的物相组成分析
在图11示出的锌-镍合金的XRD谱图中,2θ为43.2°、64.9°、78.9°和82.5°处分别出现了基体Fe的衍射峰,在42.5°和62.5°处出现了δ相Ni3Zn22的衍射峰,在44.8°处出现了γ相Ni5Zn21的衍射峰。对于锌-镍-磷合金,2θ为44.8°处有γ相Ni5Zn21的衍射峰,43.2°和78.9°处的Fe衍射峰以及62.5°处的δ相Ni3Zn22衍射峰消失,而且无论是高P含量镀层还是低P含量镀层,均未出现含P元素的晶相出现,说明镀层中P元素可能是以非晶态形式或以结晶度较低的相存在。
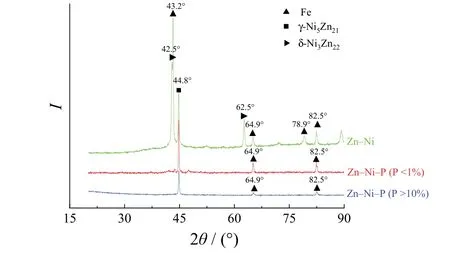
图11 不同P含量的3种镀层的XRD谱图Figure 11 XRD patterns of three coatings with different P contents
2.7 锌-镍-磷合金的电化学测试
从图12所示的极化曲线以及表2所列的拟合数据可以看出:P质量分数小于1%的锌-镍-磷合金镀层的腐蚀电位最正,腐蚀电流密度最小,表明其耐蚀性最好。P质量分数大于10%的锌-镍-磷合金镀层的耐蚀性最差。由图10可知,低P含量镀层耐蚀性得到显著提升最直接的原因之一就是P的掺入完全消除了镀层裂纹,避免了基体直接接触到腐蚀介质而被腐蚀,以及提高了镀层的致密性;高P含量的镀层由于P含量增加会导致Ni含量也相应增加,而当镀层中Ni含量超过一定比例时,锌-镍-磷合金镀层对于基体Fe而言不再是阳极性镀层,镀层将不再具有作为牺牲阳极的保护性质,镀层的防护性能因此下降。

图12 不同P含量的3种镀层在3.5% NaCl溶液中的Tafel极化曲线Figure 12 Tafel polarization curves of three coatings with different P contents
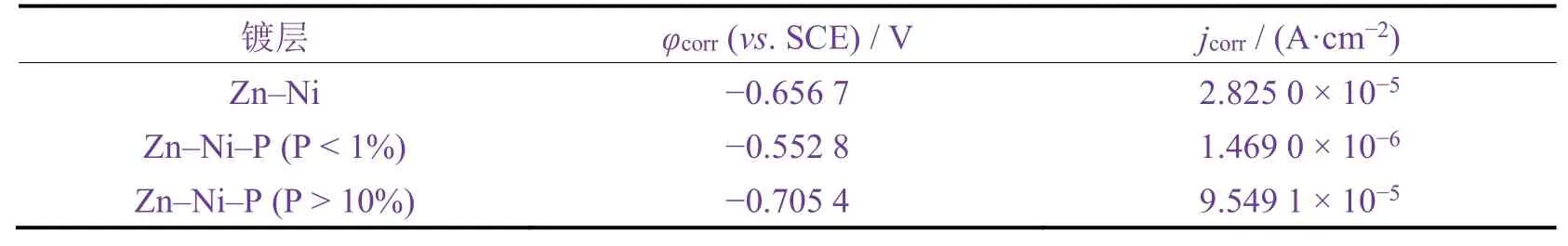
表2 Tafel曲线的拟合结果Table 2 Fitting results of Tafel curves
由图13可知,3种不同P含量的镀层的Nyquist谱图均为半圆弧状,阻抗弧半径越大则镀层耐蚀性越强,电化学阻抗谱的测量结果与Tafel极化曲线的分析结果一致。
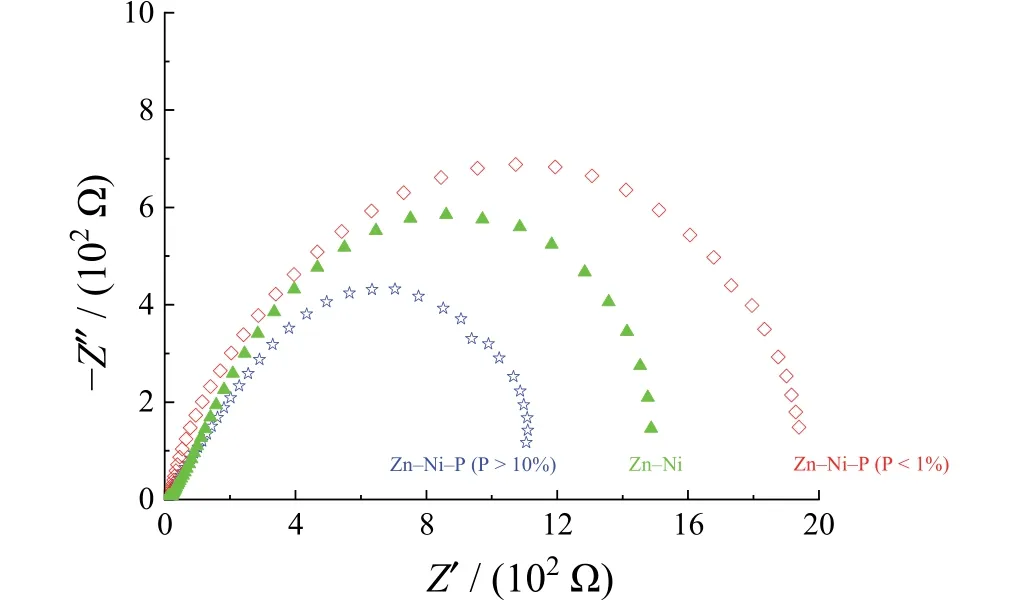
图13 不同P含量的3种镀层的电化学阻抗谱图Figure 13 Electrochemical impedance spectra of three coatings with different P contents
3 结论
(1) 循环伏安分析结果表明:P元素在不含Zn2+和Ni2+的基础溶液中不能单独被还原沉积,次磷酸钠有助于Ni的沉积而对Zn的沉积无明显影响;pH对沉积电位的影响不大,但在pH较低时发生还原反应的速率更快,有利于共沉积的发生;随着温度的升高,镀层中Zn含量呈降低趋势,Ni和P含量增加;电流密度增大会令镀层中P含量减少。
(2) SEM表征表明次磷酸钠的添加可以完全消除镀层裂纹,细化镀层晶粒,P质量分数小于1%的锌-镍-磷合金镀层的晶粒最为细致平整,不存在裂纹、针孔、凹陷、凸出等不良现象。XRD分析结果表明锌-镍-磷合金镀层主要由γ相Ni5Zn21组成。
(3) 电化学测试结果表明P质量分数小于1%的锌-镍-磷合金耐蚀性最好。
