苦笋壳提取物不同极性相抗氧化与降血糖活性研究
2022-02-23孟爱莲陈媛媛马嫄刘晓翠文学菊刘萍袁安琪叶坤月
孟爱莲,陈媛媛,马嫄,刘晓翠,文学菊,刘萍,袁安琪,叶坤月
(西华大学 食品与生物工程学院,四川 成都,611743)
糖尿病是一种常见的代谢疾病,餐后高血糖是Ⅱ型糖尿病的重要症状之一,高血糖可诱导多种蛋白的非酶糖基化,导致糖尿病慢性并发症的发生[1]。Ⅱ型糖尿病与机体氧化损伤有着密切关联,Ⅱ型糖尿病患者机体的抗氧化水平显著低于正常人体[2]。所以控制餐后血糖飙升对于糖尿病的治疗和减少慢性血管并发症至关重要。合成的α-葡萄糖苷酶抑制药物已广泛应用于糖尿病患者。但是一些合成α-葡糖苷酶抑制剂的副作用比较明显,因此亟待为糖尿病患者提供天然的降血糖产品及药物,实现多途径的降血糖作用。
α-葡萄糖苷酶和α-淀粉酶是参与人体对食物中淀粉吸收过程的重要酶类,α-葡萄糖苷酶抑制剂竞争性抑制位于小肠的各种α-葡萄糖苷酶,使淀粉类分解为葡萄糖的速度减慢,从而减缓肠道内葡萄糖的吸收,抑制α-葡萄糖苷酶催化的多糖降解为单糖,起到缓解碳水化合物迅速分解为葡萄糖的作用,从而达到调节糖尿病患者餐后血糖的作用[3-5]。α-淀粉酶是碳水化合物消化吸收的关键酶,能随机水解α-1,4糖苷键,消化淀粉,促进糖吸收,α-淀粉酶抑制剂是一种新型的治疗糖尿病的药物。α-淀粉酶抑制剂能与α-淀粉酶分子上的相应部位结合并改变α-淀粉酶分子构象,降低它的催化活性或使之丧失[6]。
苦笋是禾本科竹亚科苦竹属苦竹(Pleioblastusamarus)的幼芽,味苦而后甜,是天然的高蛋白、高膳食纤维、低脂型可食性森林蔬菜,同样也兼具着药用效果[7]。苦笋富含黄酮类、酚酸类、生物碱类、苯环衍生物及多种微量元素成分,具有抗炎、抗菌、降血糖和降血脂等作用[8]。目前对苦笋的研究主要集中在笋肉的保鲜、膳食纤维的处理以及亚硝化反应等活性方面的研究[9-10]。对苦笋壳的活性物质以及对α-葡萄糖苷酶、α-淀粉酶抑制活性的研究报道很少,本研究旨在为开发天然的苦笋壳降血糖食品提供理论支撑,促进苦笋产业的可持续发展。
1 材料与仪器
1.1 材料与试剂
苦笋,四川宜宾;α-葡萄糖苷酶来源于酿酒酵母(Saccharomycescerevisiae,EC 3.2.1.20≥100 units/mg protein)、对硝基苯基-α-D-葡萄糖吡喃苷(pNPG,98%)、猪胰α-淀粉酶(来源于猪胰腺,EC 3.2.1.1≥100 units/mg protein),美国sigma公司;其他所有试剂均为分析纯。
1.2 仪器与设备
Spectra Max M2e多功能酶标仪,美国Molecular Devices公司;KH3200E型超声波清洗器,昆山禾创超声仪器有限公司;A—1000S旋转蒸发仪,上海爱朗仪器有限公司;FDU-1200真空冷冻干燥机,东京理化器械株式会社;5424型台式离心机,德国Eppendorf公司。
2 实验方法
2.1 苦笋前处理
苦笋壳水提物的制备:苦笋壳20 g粉碎,过60目筛,以10倍的热水浸泡40 min,超声波浸提24 h,过滤、合并滤液,浓缩,真空干燥,加入适量的蒸馏水,超声波助溶,配制成质量浓度为0.2 g/mL的溶液。
苦笋壳醇提物的制备:苦笋壳20 g粉碎,以10倍体积分数70%乙醇浸泡40 min,回流提取2次,第1次1.5 h,第2次8倍的70%乙醇1 h。回流完毕,过滤、合并滤液,水浴上挥发至无醇味,浓缩,真空干燥,加入适量的70%乙醇,超声波助溶,配制成质量浓度为0.2 g/mL的溶液。
2.2 α-葡萄糖苷酶抑制活性测试
参照LI等[11]的研究方法分析苦笋提取物的α-葡萄糖苷酶抑制活性,将不同浓度的样品或阿卡波糖溶液(50 μL)与α-葡萄糖苷酶(50 μL,0.2U/mL,用 0.1 mmol/L,pH 6.9 PBS配制)在25 ℃温育6 min,然后加入pNPG溶液(50 μL,5 mmol/L),在25 ℃温育10 min后,将Na2CO3溶液(100 μL 0.2 mol/L)混合以终止反应,并使用酶标仪测量405 nm处的吸光度,α-葡萄糖苷酶的抑制率计算如公式(1)所示:
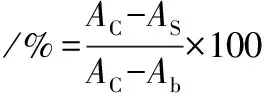
(1)
式中:AC,对照组的吸光度;AS,反应混合物的吸光度;Ab,混合物的吸光度;样品和α-葡萄糖苷酶分别用蒸馏水/70%乙醇和0.1 mmol/L pH 6.9 PBS代替。实验重复3次。
2.3 α-淀粉酶抑制活性测试
参照张凯等[12]方法,混合37 ℃水浴预热5 min,同时加入已预温的1%淀粉溶液(PBS配制)0.3 mL,在37 ℃水浴下反应一定的时间,立即加入0.5 mL DNS溶液显色,在沸水中水浴5 min,冷却后经蒸馏水稀释至10 mL,在540 nm处测定吸光值(A3)。用阿卡波糖(0.1、0.4、0.8、1.2、1.6、2.0 mg/mL)做阳性对照组,蒸馏水替代抑制剂及磷酸盐缓冲溶液(67 mmol/L pH 6.8)替代α-淀粉酶(A2)做空白对照物;磷酸盐缓冲溶液替代α-淀粉酶(A4)做背景对照组;以蒸馏水替代抑制剂(A1)做空白组。抑制率的计算如公式(2)所示。做3次平行实验,根据抑制率计算得IC50。
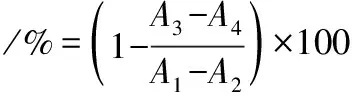
(2)
式中:A1,0.3 mL酶液+0.3 mL淀粉溶液+0.5 mL DNS溶液;A2,0.3 mL淀粉溶液+0.5 mL DNS溶液;A3,0.3 mL酶液+乙酸乙酯提取物+0.3 mL淀粉溶液+0.5 mL DNS溶液;A4,乙酸乙酯提取物+0.3 mL淀粉溶液+0.5 mL DNS溶液。
2.4 对α-葡萄糖苷酶抑制动力学试验
以对α-葡萄糖苷酶抑制活性最强相为抑制剂,α-葡萄糖苷酶抑制动力学实验参照文献[13]的方法进行。以底物浓度倒数(1/[S])为横坐标,反应速率倒数(1/V)为纵坐标进行Lineweaver-Burk双倒数作图分析,求得米氏常数Km和酶促反应最大速率Vmax,确定抑制类型及竞争方式[14]。最大反应速率Vmax和米氏常数Km计算如公式(3)、公式(4)所示:
V=Vmax[S]/(Km+[S])
(3)
1/V=Km/Vmax×1/[S]+1/Vmax
(4)
2.5 对α-淀粉酶抑制动力学试验
以对α-淀粉糖苷酶抑制活性最强相为抑制剂,乙酸乙酯相对α-淀粉酶抑制类型研究按照上述2.3中实验方法进行操作,在空白管中使用0.3 mL缓冲液代替α-淀粉酶液,分别于540 nm处测定质量浓度0.1 mg/mL的苦笋壳提取物的吸光值,3组平行实验。将酶浓度与反应速率作为横纵坐标作图,根据反应速率直线是否过原点,确定苦笋壳乙酸乙酯相对α-淀粉酶的抑制类型。分别配制淀粉溶液,按照2.3的试验方法进行操作,分别在540 nm下测定苦笋壳乙酸乙酯相的吸光值,3组平行实验。采用Lineweaver-Burk双倒数作图法,判断竞争方式。
2.6 统计分析
所得数据以平均值±标准差表示,运用SPSS 24.0统计分析软件对数据进行分析,采用origin 8.5软件进行数据处理与统计分析,试验数据均为3次重复测定结果的平均值。采用单因素方差分析样本间的差异显著性,P<0.05表示显著性差异。
3 结果与分析
3.1 苦笋壳粗提物有效成分分析
苦笋壳中含有丰富的活性物质如黄酮类、总酚、总糖,具有清除自由基和抗氧化、抗菌、防癌等多种生物活性作用。由图1可知,水提和醇提2种方式活性物质均为总糖含量最高,其中水提方式的总糖含量可达(97.3±0.28)%,而醇提方式的总糖含量只有(63.3±0.13)%,这是因为多糖具有较强的亲水性,大多数多糖易溶于水,难溶于醇等有机溶剂,因而多糖多用水提取[15]。除总糖外,其他成分黄酮和总酚在醇提方式下的含量较高,说明苦笋中的活性物质适合醇提,总酚和黄酮含量在醇提方式下差别不大。

图1 不同提取方式有效成分的测定Fig.1 Content of active ingredients in different extraction methods
3.2 水提和醇提方式对α-葡萄糖苷酶的抑制活性比较
如图2所示,随着样品浓度的增加,各提取物对α-葡萄糖苷酶抑制的能力逐渐增强,可见提取物与抑制活性间呈现剂量-效应关系。在本试验浓度内,苦笋醇提取物抑制活性>水提取物抑制活性,当提取物质量浓度为1.6 mg/mL时,醇提方式抑制率可达90%。对α-葡萄糖苷酶的抑制能力大小:醇提[IC50=(0.091±0.013) mg/mL]>水提[IC50=(0.130±0.010) mg/mL],醇提方式表现出极强的α-葡萄糖苷酶抑制活性。而水提方式较弱的主要原因可能是热水浸提以及超声波破坏多糖的分子链从而使其活性受到破坏[16]。
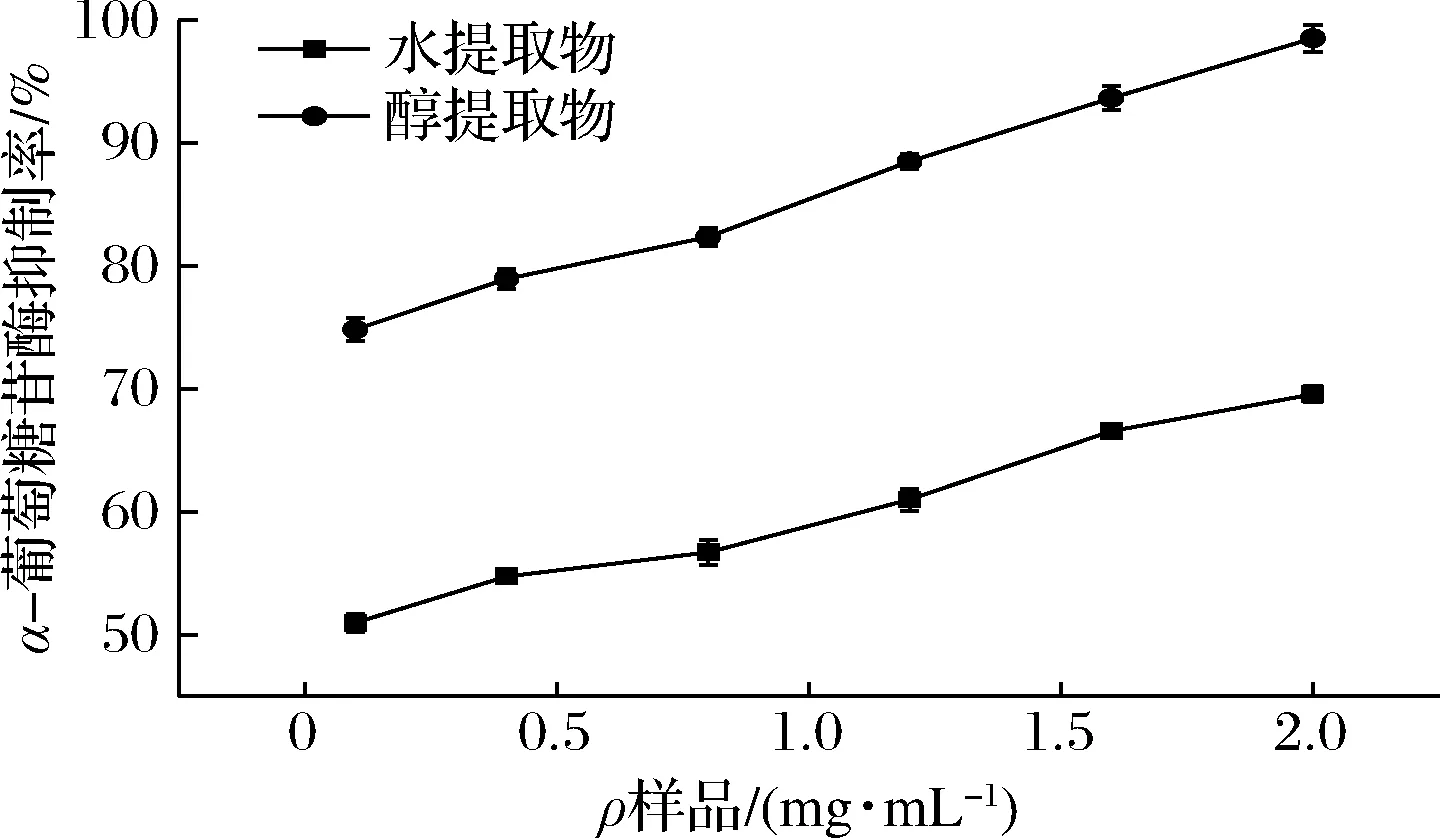
图2 不同提取方式对α-葡萄糖苷酶的抑制率Fig.2 Inhibition of α-glucosidase by different extraction methods
3.3 醇提方式有效成分分析
萃取相极性不同,对植物活性物质的提取效果也不同。由表1可以看出,活性物质含量:乙酸乙酯萃取相活性物质含量>正丁醇萃取相>石油醚萃取相,有研究表明,极性强的溶剂如乙酸乙酯、正丁醇能够有效提取含糖苷的多酚和黄酮类化合物[17]。乙酸乙酯萃取相的总酚含量达(193.00±2.65)mg GAE/100 g,而石油醚萃取相最低,为(139.83±5.06) mg GAE/100 g,说明在乙酸乙酯相中多酚、总糖类化合物极性较高。

表1 醇提物不同萃取相中总酚、总糖及总黄酮的含量 单位:mg GAE/100 g
3.4 醇提不同极性萃取相对α-葡萄糖苷酶抑制活性的影响
在酶活力反应体系中,测定不同底物(pNPG)浓度条件下,各抑制活性具有较大差异,乙酸乙酯的抑制活性与阿卡波糖较接近,由图3可以看出,抑制活性:乙酸乙酯相>正丁醇相>石油醚相,提取物质量浓度在2 mg/mL 时对乙酸乙酯相α-葡萄糖苷酶的抑制活性为(97.32±0.67)%,对照阿卡波糖抑制活性为(94.32±1.21)%,乙酸乙酯相高于阳性对照,3种提取物抑制能力大小为乙酸乙酯[IC50=(0.158±0.001)mg/mL]>正丁醇[IC50=(0.211±0.008)mg/mL]>石油醚相[IC50=(0.280±0.005)mg/mL],说明苦笋壳中发挥α-葡萄糖苷酶抑制作用的活性成分主要溶解在乙酸乙酯相中。
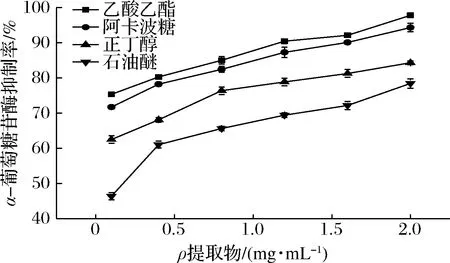
图3 醇提物萃取相对α-葡萄糖苷酶抑制活性的影响Fig.3 Alcohol extract relative α-glucosidase inhibitory activity
3.5 不同极性萃取相对α-淀粉酶抑制活性的影响
如图4所示,随着醇提物质量浓度的增加,抑制率也逐渐增加,阿卡波糖阳性对照组,在质量浓度范围内对α-淀粉酶的抑制率均达到90%,起初增幅较大,随后变得较为平缓,近似于抛物线,这与何贝桥等[18]研究葫芦茶提取物对α-淀粉酶抑制速率图结果保持一致。当质量浓度为2 mg/mL时,乙酸乙酯的抑制率为(92.21±0.45)%,其IC50=(0.104±0.006)mg/mL。阳性药物阿卡波糖的抑制率达到(98.13±0.85)%,其IC50=(0.094±0.005)mg/mL,乙酸乙酯萃取相与阿卡波糖的抑制率接近,说明乙酸乙酯萃取相对α-淀粉酶具有一定的抑制效果。
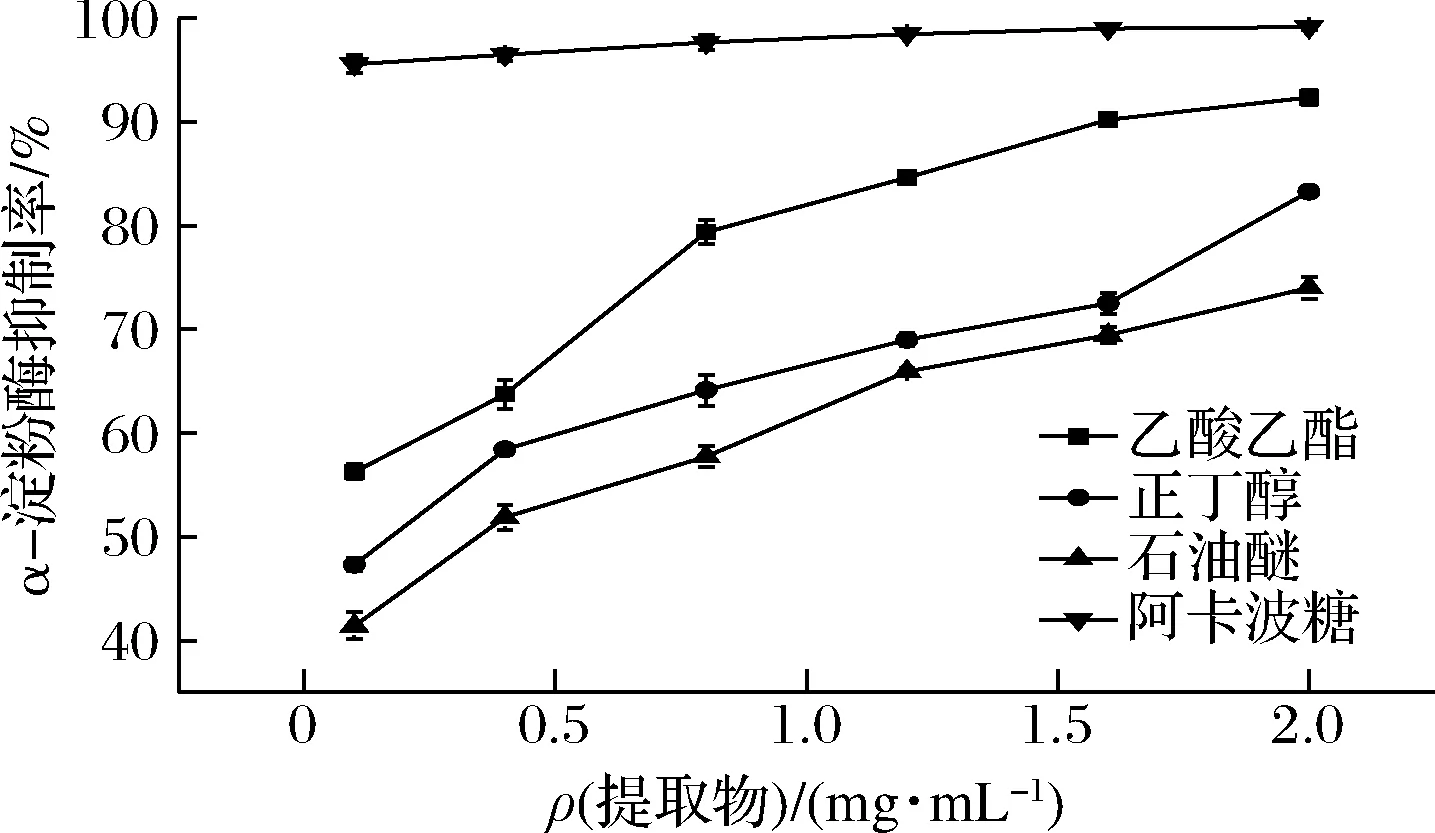
图4 醇提物萃取相对α-淀粉酶抑制活性的影响Fig.4 Alcohol extract relative α-amylase inhibitory activity
3.6 醇提物抗氧化能力测定
醇提物不同萃取相的抗氧化能力(以Trolox或维生素C为阳性对照)见表2。苦笋壳在3种不同萃取相中均表现出一定的抗氧化活性。各萃取相对3种自由基的清除能力均是:·OH>ABTS阳离子自由基>DPPH自由基,在苦笋壳中乙酸乙酯相中,·OH的清除能力最强,与Trolox的抗氧化能力相似。总抗氧化能力方面:乙酸乙酯相>正丁醇相>石油醚相,石油醚相提取物主要包含脂溶性物质,包括脂肪以及维生素和色素(石油醚相提取物主要包含脂肪、维生素以及色素等脂溶性物质),对抗氧化性没有起到主要作用。说明苦笋壳中发挥α-葡萄糖苷酶抑制作用的活性成分主要溶解在乙酸乙酯相中。

表2 醇提物不同萃取相的抗氧化能力测定Table 2 Determination of antioxidant ability of different extraction phases of alcohol extract
3.7 乙酸乙酯萃取相对α-葡萄糖苷酶、α-淀粉酶抑制类型
苦笋乙酸乙酯提取物对α-葡萄苷酶、α-淀粉酶抑制动力学拟合曲线如图5、图6所示,在反应过程中没有提取物存在时,反应速率大约是一条经过原点的直线,在原反应体系中加入酶抑制剂提取物后,反应速度随着酶量的多少及加入酶抑制剂后的变化而不同,由图5,图6可知,加入乙酸乙酯提取物后得到的反应速率直线通过原点,且斜率低于无抑制剂的曲线,由此可以看出,苦笋提取物对α-葡萄糖苷酶和α-淀粉酶的抑制类型属于可逆抑制类型,这是由于苦笋乙酸乙酯提取物与底物共同竞争同一位置,使得提取物与α-淀粉酶、α-葡萄糖苷酶结合,且酶不再与底物结合,从而降低反应速率,且产物形成可逆[19]。
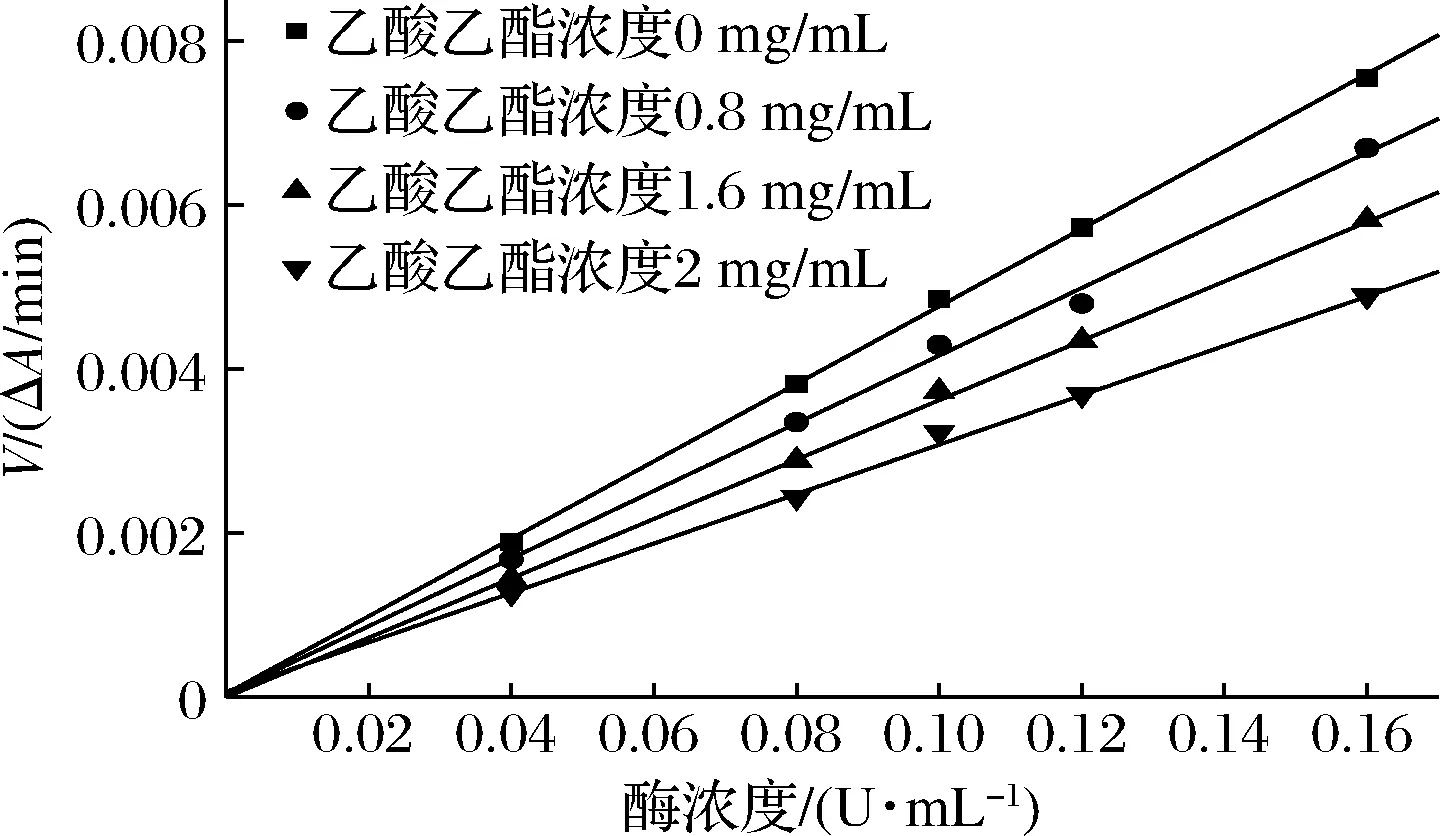
图5 乙酸乙酯提取物对α-葡萄糖酶抑制类型 Lineweaver-Burk曲线Fig.5 Lineweaver-Burk curve of the inhibition type of ethyl acetate extract on α-glucase
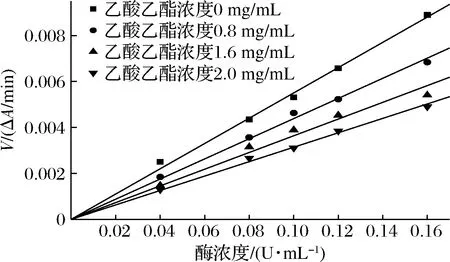
图6 乙酸乙酯提取物对α-淀粉酶抑制类型 Lineweaver-Burk曲线Fig.6 Lineweaver-Burk curve of the inhibition type of ethyl acetate extract on α-amylase
3.8 乙酸乙酯相对α-葡萄糖苷酶可逆抑制类型
利用Lineweaver-Burk作图法研究苦笋乙酸乙酯提取物对α-葡萄糖苷酶的可逆性抑制,由图7可知,苦笋乙酸乙酯提取物质量浓度为1.6 mg/mL得到的直线与未加抑制剂组的直线相交纵轴的一点,苦笋乙酸乙酯提取物直线斜率大于未加抑制剂组,提取物回归方程为:y=22.96x+38.01(R2=0.996 1,Vmax=0.026,Km=0.601);未加抑制剂回归方程:y=10.3x+37.83(R2=0.989 1,Vmax=0.026,Km=0.256),Vmax基本保持不变,Km增大,乙酸乙酯萃取相和底物对游离的α-葡萄糖苷酶的结合有竞争作用,相互排斥与α-葡萄糖苷酶形成可逆的复合物,乙酸乙酯萃取相与底物竞争酶的活性中心,从而阻止底物与酶的结合,使反应速度下降[20]。即乙酸乙酯醇提物对α-葡萄糖苷酶的抑制类型为竞争性抑制。
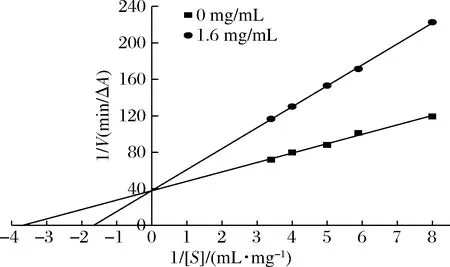
图7 乙酸乙酯提取物对α-葡萄糖苷酶抑制类型 Lineweaver-Burk曲线Fig.7 Lineweaver-Burk curve of the inhibition type of ethyl acetate extract on α-glucosidase
3.9 乙酸乙酯相对α-淀粉酶可逆抑制类型
由图8可知,1/[S]与1/[V]存在良好的线性关系,随着1/[S]逐渐增大,苦笋壳乙酸乙酯萃取组的反应速度低于无抑制剂的反应速度,两者线性回归方程延长线近似交于横坐标同一点,苦笋壳乙酸乙酯萃取组直线斜率大于无抑制剂组,在纵轴上的截距也增加(无抑制剂回归方程:y=21.67x+40.68,R2=0.974,Vmax=0.025,Km=0.532;提取物回归方程为:y=28.72x+54.47,R2=0.981,Vmax=0.018,Km=0.527),即最大反应速度Vmax减小,但Km几乎保持不变,所以酶对底物的亲和力不变。这表明底物和抑制剂与酶之间的结合没有竞争性,苦笋壳乙酸乙酯提取物通过与酶的活性位点以外的基团结合,使分子形状发生改变,抑制剂大部分与巯基结合,破坏酶的构象,从而降低酶活力,该现象称为非竞争性抑制,说明苦笋壳提取物中能抑制α-淀粉酶的组分较单一或是结构相似的一类化合物[21]。

图8 乙酸乙酯提取物对α-淀粉酶抑制类型 Lineweaver-Burk曲线Fig.8 Lineweaver-Burk curve of the inhibition type of ethyl acetate extract on α-amylase
4 结论
苦笋壳经水提和70%乙醇提取都含有总酚、总糖和黄酮类物质,其中水提物总糖含量较高,醇提物中黄酮和总酚含量较高。不同萃取溶剂的极性对苦笋壳的抗氧化活性有显著的影响:醇提的3个不同萃取溶剂中,乙酸乙酯相对清除ABTS阳离子自由基、DPPH自由基、·OH能力>正丁醇相和石油醚相,说明苦笋壳乙酸乙酯相的抗氧化能力大于石油醚相和正丁醇相。酶动力学分析显示,苦笋壳乙酸乙酯萃取相对α-葡萄糖苷酶的抑制类型为竞争性抑制,Vmax=0.026;对α-淀粉酶的抑制类型为非竞争性抑制,Km=0.527~0.532,苦笋壳粗提物及不同极性部位表现出一定的抗氧化作用和对α-淀粉酶、α-葡萄糖苷酶抑制作用,余颖等[22]研究甘草酸提取废液萃取物中,乙酸乙酯萃取相对α-葡萄糖苷酶的抑制作用最强为竞争性抑制。有研究表明非竞争性抑制剂与竞争性抑制剂之间存在着协同α-葡萄糖酶活性的作用[23]。周晓婷等[24]对苦荞粗提物进行萃取,发现实验组中的苦荞提取物对α-淀粉酶的抑制类型为非竞争性抑制。不同极性苦笋壳提取物间的相互作用的研究尚不明确,对苦笋壳中主要发挥功效作用的具体单体物质还需要进一部分离纯化,做进一步研究,本研究可对开发具有辅助降血糖的产品提供理论依据。
