常压室温等离子诱变选育L-色氨酸高产菌株
2022-02-23周旭波陈瑜琦丁鼎刘帅王健
周旭波,陈瑜琦,丁鼎,刘帅,王健
(江苏澳创生物科技有限公司,江苏 无锡,214000)
L-色氨酸是人和动物体内的一种必需氨基酸,是构成蛋白的重要组成部分,但人和动物自身不能合成L-色氨酸,必须从外界摄取[1]。色氨酸是生物体内合成5-羟色胺、褪黑素和犬尿氨酸等生理活性物质的前体,在生物体特定的生命活动中扮演重要角色[2-3]。在医学上,L-色氨酸是复合氨基酸制剂和氨基酸注射液的重要原料,用于改善患者蛋白质摄入不足、氨基酸吸收障碍等问题,以及改善手术后病人的营养状况。近年来的研究表明,色氨酸及其代谢物在许多人体疾病调控中发挥了不同的生物学效应,如部分肿瘤疾病、炎症、肝肾疾病、糖尿病、免疫系统疾病及神经系统疾病等[4-8]。在食品和饲料添加剂领域,色氨酸可用来强化食品和做饲料添加剂,对补充食物和饲料中的营养、提高蛋白质的利用率具有重要的作用。
目前L-色氨酸的生产方法以微生物发酵法为主[9],相比传统的化学合成法和蛋白质水解法,微生物发酵法具有更低的生产成本、更加绿色环保、更易于大规模生产等显著的优越性[10]。微生物发酵法生产L-色氨酸的过程中,微生物菌种的优劣决定着发酵生产过程中的生产工艺、生产成本甚至产品质量,因此,选育高产色氨酸优良菌株具有重要意义。常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变技术最近几年在科研及工业领域逐步得到应用,尤其在微生物突变育种中取得了良好的效果[11-13]。与其他诱变育种技术相比,ARTP诱变育种技术能够更有效造成DNA的突变,并且设备操作简单快捷,对环境条件要求较低,操作过程中安全性较高,在高效进化育种领域具有较大的应用潜力[14]。
本研究使用ARTP诱变育种技术并结合结构类似物抗性定向筛选,对色氨酸生产菌进行多次诱变处理和筛选,获得色氨酸高产突变株,为L-色氨酸的工业化生产提供优良菌株。
1 材料与方法
1.1 材料
1.1.1 菌种
色氨酸生产菌AC-1042(Escherichiacoli),江苏澳创生物科技有限公司保藏菌种。
1.1.2 培养基
斜面培养基(g/L):葡萄糖10,蛋白胨10,酵母浸出粉5,NaCl 5,琼脂20,pH 7.0~7.2,115 ℃灭菌20 min。
抗性培养基:斜面培养基中加入一定量的结构类似物。
种子培养基:葡萄糖 30 g/L,(NH4)2SO42 g/L,K2HPO4·3H2O 5 g/L,KH2PO43.5 g/L,MgSO4·7H2O 1.2 g/L,酵母粉5 g/L,柠檬酸 1.2 g/L,FeSO4·7H2O 5.6 mg/L,MnSO4·H2O 2 mg/L,pH 7.0~7.2,115 ℃灭菌20 min。
发酵培养基:葡萄糖10 g/L,(NH4)2SO45 g/L,KH2PO47.5 g/L,MgSO4·7H2O 2.4 g/L,酵母粉1 g/L,柠檬酸 2 g/L,FeSO4·7H2O 75 mg/L,MnSO4·H2O 2 mg/L,ZnSO4·H2O 2.4 mg/L,pH 7.0~7.2,115 ℃灭菌20 min。
1.1.3 仪器
ARTP-II型ARTP诱变系统,无锡源清天木生物科技有限公司;YXJ-2高速离心机,常州国华电气有限公司;30 L自动发酵罐,上海百仑生物科技有限公司;1260 Infinity II高效液相色谱仪,安捷伦科技有限公司;SBA-40C生物传感分析仪,山东科学院生物研究所。
1.2 试验方法
1.2.1 斜面活化培养
在无菌环境下打开保藏菌种划线接种于活化斜面上,置于36 ℃培养箱中培养20 h。
1.2.2 菌悬液的制备
从新鲜活化斜面菌落上挑取1环接种于种子培养基中,置于摇床中培养,摇床转数180 r/min、摇床温度36.5 ℃,培养4.5 h后,取1 mL种子液于1.5 mL 无菌离心(Eppendorf,EP)管中,4 000 r/min离心,去除上清液,加入1 mL无菌生理盐水,混匀,离心,反复3次,将菌悬液稀释,使菌悬液OD600值为0.6~1.0。
1.2.3 ARTP诱变致死率的测定
取10 μL 稀释菌液置于无菌不锈钢载片上涂抹均匀,将载片置于ARTP诱变系统中诱变处理。ARTP 诱变条件:射频功率120 W,处理距离2 mm,载气流量10 标准升每分钟(standard liters per minute,SLM),处理温度为室温(20~40 ℃),处理时间0、10、20、30、40、50、60、70和80 s。将处理过的载片放入装有1 mL 无菌生理盐水的EP管中,振荡混匀,然后稀释到10-1、10-2、10-3、10-4,各取100 μL均匀涂布到平板上,每个梯度做3个平行,36 ℃培养20 h后菌落计数,致死率计算如公式(1)所示:

(1)
1.2.4 ARTP诱变处理
取10 μL 稀释菌液置于无菌不锈钢载片上涂抹均匀,将载片置于ARTP诱变系统中诱变处理,ARTP 诱变条件同1.2.3,诱变处理时间选择致死率达到90%以上的处理时间。将处理过的载片放入装有1 mL 无菌生理盐水的EP管中,振荡混匀,然后稀释到10-1、10-2,各取100 μL均匀涂布到平板上,每个梯度做3个平行,36 ℃培养20 h。
1.2.5 抗性筛选
制备不同浓度梯度的5-甲基色氨酸(5-methyltryptophan,5-MT)、对氟苯丙氨酸(phenylalanine,PFP)抗性培养基平板[15]。用接种环从诱变处理后培养的平板中取一满环菌装入无菌EP管中,使用无菌水离心洗涤2次,然后使用无菌水制成菌悬液,直接将菌悬液分别涂布于抗性平板上,36 ℃培养2~3 d。
1.2.6 菌种初筛
将种子培养基分装到96孔板中,每孔0.1 mL,将平板上的单菌落挑到种子液孔板中,180 r/min,36 ℃ 培养6 h,并同时接种到另一块平板上,36 ℃培养22 h后放入冰箱。将发酵培养基分装到孔板中,每孔0.09 mL,种子液接0.015 mL,180 r/min,36.5 ℃培养20 h。挑取发酵产酸较高的菌种,将平板上对应序号的菌种挑至斜面,36.5 ℃培养20 h,甘油管保存。
1.2.7 菌种复筛
将初筛甘油管保藏的菌种分别划一支斜面,36 ℃培养20 h。从斜面上挑1环菌至500 mL种子摇瓶中,180 r/min,36.5 ℃培养5.5 h,转接500 mL发酵摇瓶,180 r/min,36.5 ℃培养22 h,测发酵摇瓶产酸,挑取产酸较高的菌种保藏。
1.2.8 30 L发酵罐培养验证
将保藏的菌种划线接种于活化斜面上,36 ℃培养20 h。从活化斜面上挑取2环接入装液量30 mL的500 mL摇瓶种子培养基中,置于200 r/min旋转式摇床上36.5 ℃振荡培养至OD600值为12~14。将培养结束的摇瓶种子按体积分数10%的接种量接入发酵培养基中。初始通气量10 L/min,初始搅拌转速为300 r/min,通过自动流加氨水控制pH在7.0左右,培养温度36.5 ℃。培养过程中,当溶氧降低至30%时交替提高转速和通气量,维持溶氧在30%~40%。当发酵液中葡萄糖质量浓度降至10 g/L时,开始流加质量分数为700 g/L的葡萄糖溶液。
1.2.9 分析检测方法
1.2.9.1 菌体生长测定
菌液用蒸馏水稀释后,测定600 nm下的OD600值。
1.2.9.2 葡萄糖质量浓度测定
使用生物传感分析仪测定。
1.2.9.3 色氨酸含量测定
采用分光光度法[16]和液相色谱法[17]。
2 结果与分析
2.1 ARTP致死曲线
ARTP诱变对色氨酸生产菌的致死率与一定条件下对其处理时间有很大关系。为了获得最佳的诱变条件,按照1.2.3的方法对出发菌进行诱变处理并计算致死率,结果见图1。随着ARTP诱变处理时间的延长,菌株的致死率逐渐上升,当处理时间为40 s时致死率为91.79%,处理时间为60 s时致死率为99.99%,70 s之后致死率达到100%。为对出发菌株进行有效诱变,需要有较高的致死率,本文选择将致死率控制在90%以上的诱变处理时间,即选择ARTP诱变时间为40 s。
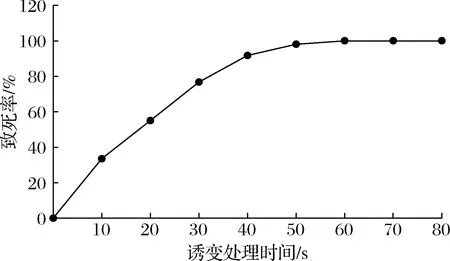
图1 不同ARTP诱变处理时间下色氨酸菌株的致死率曲线Fig.1 Lethality of L-tryptophan strains with different ARTP mutagenic treatment time
2.2 5-MT抗性菌株的筛选
5-MT是L-色氨酸的结构类似物,选育具有5-MT抗性的突变株可以减少或解除L-色氨酸对合成途径中酶的反馈抑制和阻遏,有利于提高菌株产L-色氨酸的能力[18]。以色氨酸生产菌AC-1042为出发菌株,经ARTP诱变处理后,选育5-MT的抗性菌株。首先要确定色氨酸生产菌株对5-MT耐受的临界浓度,将色氨酸生产菌的悬液涂布于5-MT梯度浓度平板上培养,生长情况如表1。
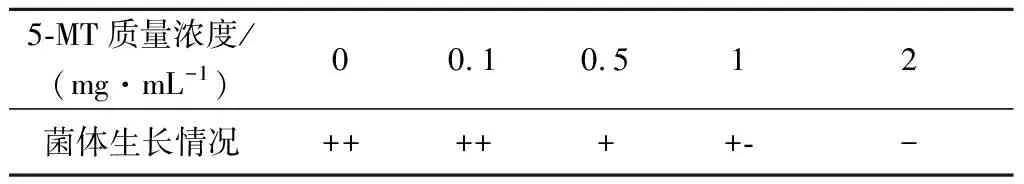
表1 5-MT临界浓度的确定Table 1 Critical concentration of 5-MT resistance
由表1可知色氨酸生产菌对5-MT的临界质量浓度为1 mg/mL。按照1.2.4的方法对色氨酸生产菌进行诱变处理,从诱变处理后涂布的平板上挑出生长良好的菌落,制成菌悬液分别涂布到含有1、1.5、2 mg/mL 5-MT的平板上,36 ℃培养3 d。从平板上挑选生长良好的菌落115株,分别转接斜面,命名为ACT001~ACT115。按照1.2.6和1.2.7的方法对得到的突变株进行筛选,筛选出色氨酸产量较高的5株菌株,结果如表2。
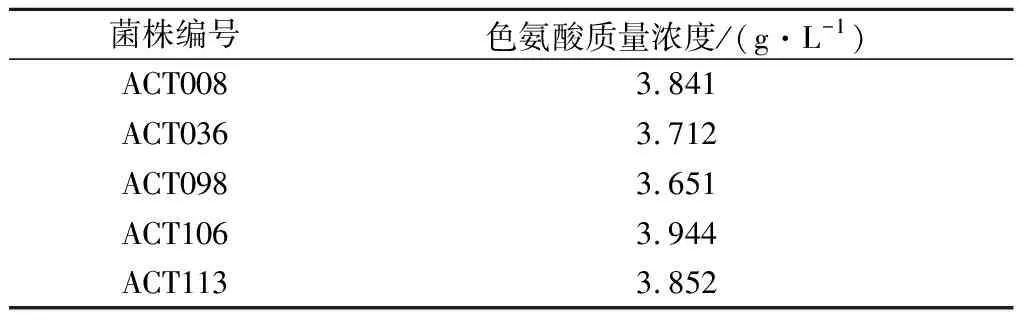
表2 突变株筛选结果Table 2 Results of the mutant strain screening
将表2中的5株菌株进行遗传稳定性实验,转接斜面传至第10代,取第10代菌株做摇瓶发酵产酸验证,与初代突变株产酸结果进行对照,试验结果见图2。经过传代试验,菌株ACT106产酸最高,并且能够稳定产酸,选择菌株ACT106做下一步诱变处理出发菌。
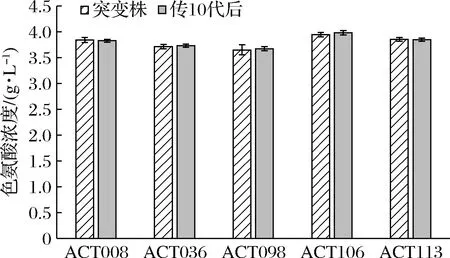
图2 遗传稳定性测定Fig.2 Determination of genetic stability
2.3 PFP抗性菌株的筛选
在色氨酸的生物合成途径中,3-脱氧-2-阿拉伯庚酮糖-7-磷酸(3-deoxy-2-arabina-heptanose-7-phosphate,DAHP)反应是第1个限速步骤,DAHP合成酶受L-色氨酸、L-苯丙氨酸和L-酪氨酸的协同反馈抑制,第1个分支点处的分支酸变位酶受L-苯丙氨酸和L-酪氨酸的部分抑制[19]。因此,选育L-苯丙氨酸、L-酪氨酸结构类似物抗性的突变株可以从遗传上减弱或解除这些反馈抑制作用,增强色氨酸合成途径的代谢流,提高色氨酸的产出[20]。以菌株ACT106为出发菌株,经ARTP诱变处理后,选育具有PFP抗性的突变菌株。首先确定色氨酸生产菌株对PFP耐受的临界质量浓度为0.5 mg/mL。按照方法1.2.4对菌株ACT106进行诱变处理,从诱变处理后涂布的平板上挑出生长良好的菌落,制成菌悬液分别涂布到含有0.5、1、1.5 mg/mL PFP的平板上,36 ℃培养3 d。最终从平板上筛选到生长良好的菌落109株,分别转接斜面,命名为ACTR001~ACTR109。按照1.2.6和1.2.7的方法对得到的突变株进行筛选,选出产量较高的5株菌株,摇瓶复筛后各菌株的产酸结果如表3所示。

表3 突变株筛选结果Table 3 Results of the mutant strain screening
将表3中的5株菌株进行传代,考察菌株的遗传稳定性,传至第10代时,取第10代菌株做摇瓶发酵产酸验证,与初代突变株产酸进行对照,结果见图3。经过传代试验,菌株ACTR103产酸最高,并且能够稳定产酸,选择菌株ACTR103做下一步诱变处理出发菌。
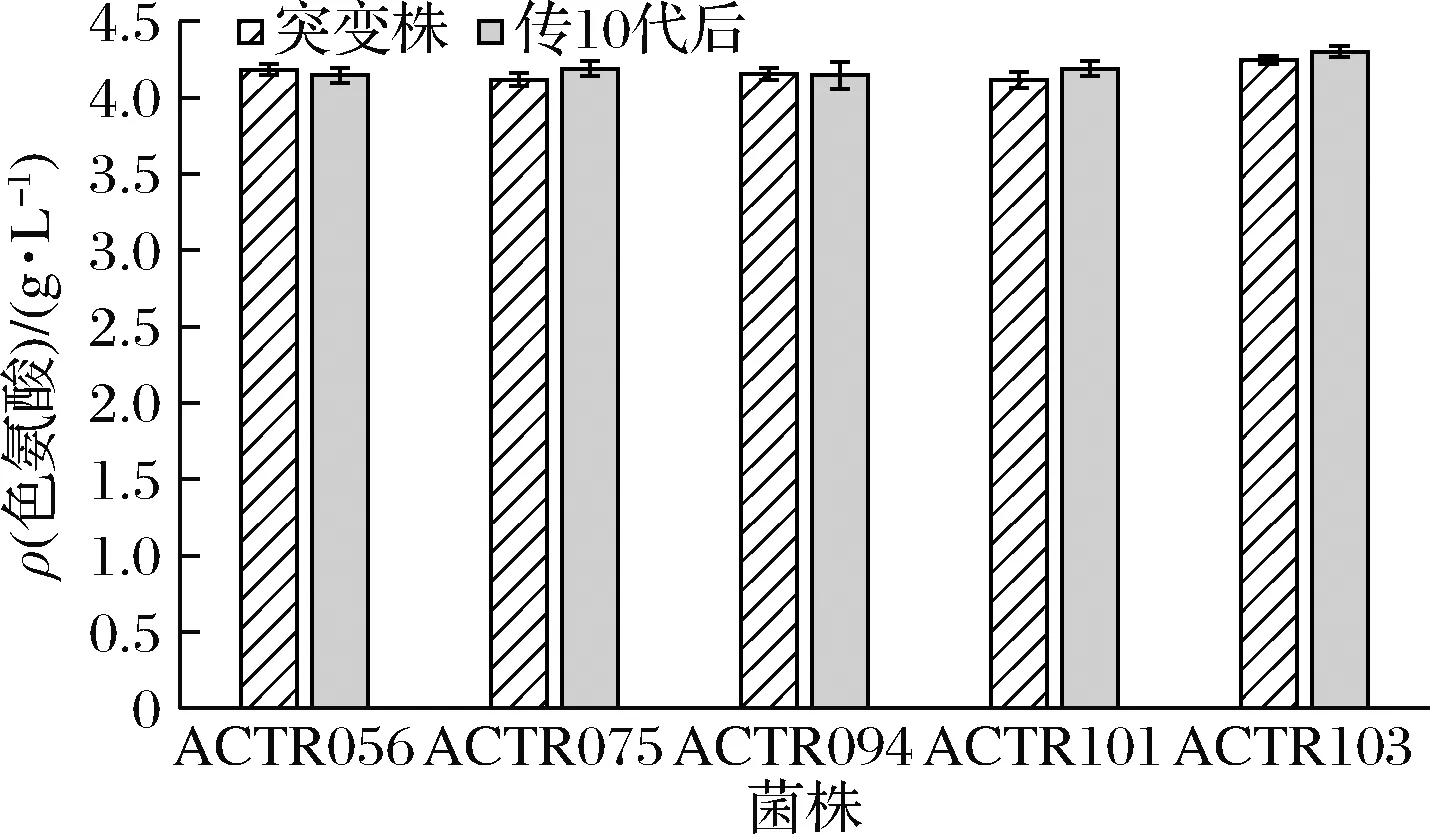
图3 遗传稳定性测定Fig.3 Determination of genetic stability
2.4 多次ARTP诱变处理+抗性筛选
将上述诱变筛选出菌株ACTR103按照1.2.4和1.2.5进行多次诱变处理和抗性筛选,使菌株对5-MT和PFP的抗性分别提高至5和3 mg/mL。经过筛选,选出产量较高的5株菌株,结果如表4。将表4中的5株菌株进行传代考察菌株的遗传稳定性,传至第10代时,取第10代菌株做摇瓶发酵产酸验证,与初代突变株产酸进行对照,结果见图4。经过传代复筛后上述5株菌株均能稳定产酸,其中菌株ACTRP104摇瓶发酵后的L-色氨酸质量浓度为4.591 g/L,比原始菌株AC-1042摇瓶发酵后的L-色氨酸质量浓度(3.570 g/L)提高了28.6%。
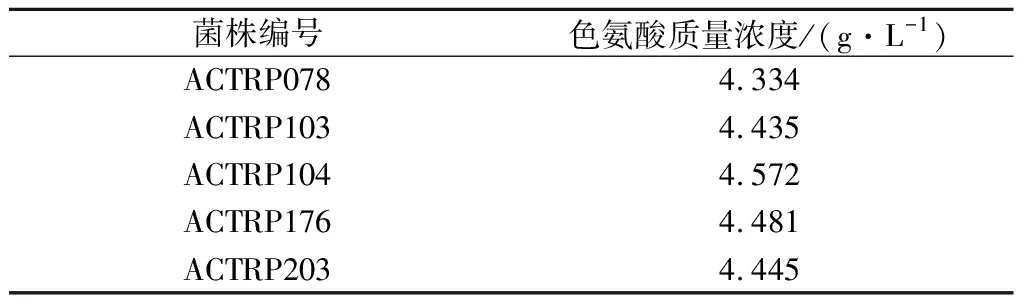
表4 突变株筛选结果Table 4 Results of the mutant strain screening
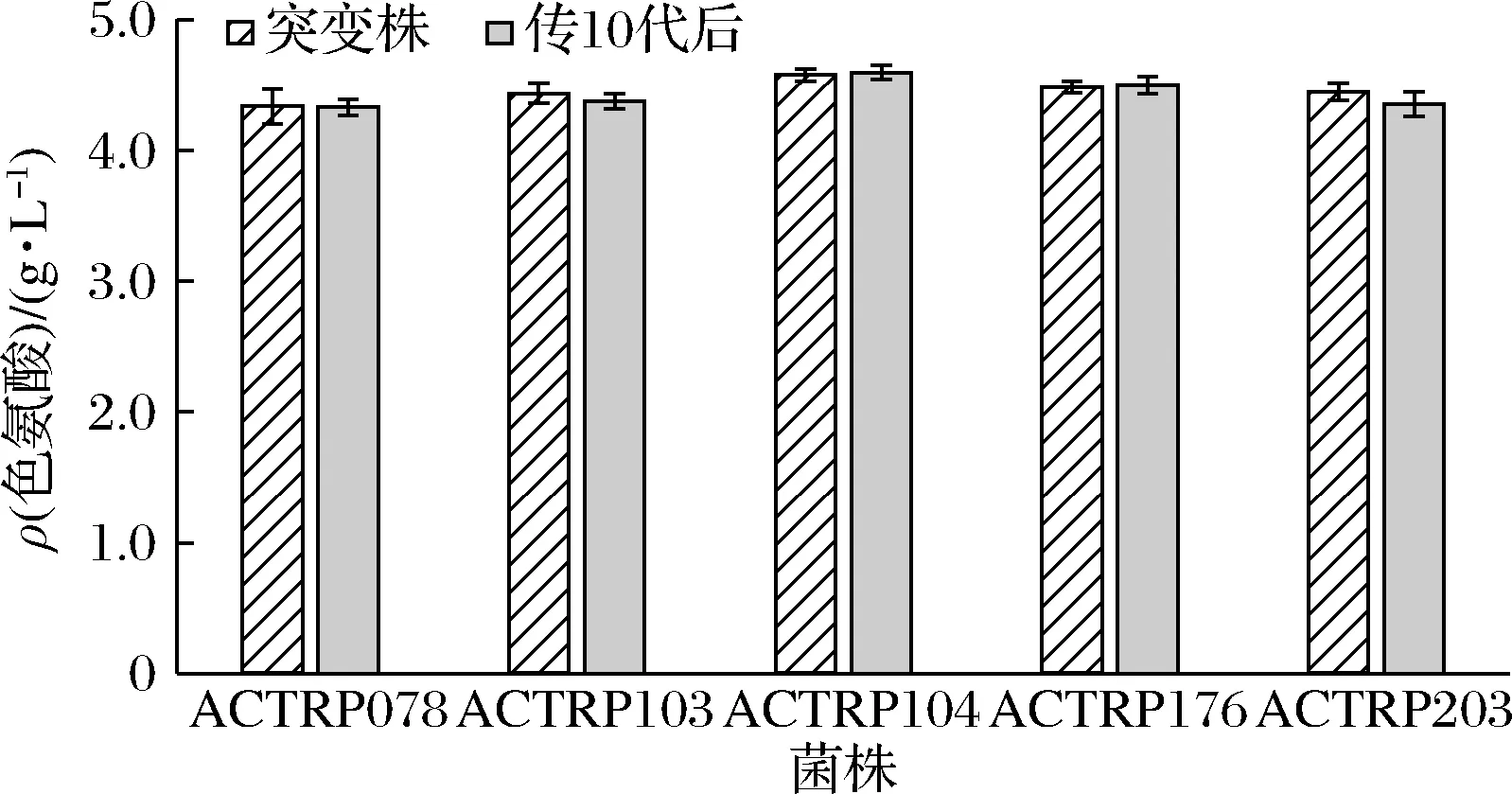
图4 遗传稳定性测定Fig.4 Determination of genetic stability
2.5 30 L发酵罐培养验证
为考察突变株ACTRP104发酵生产色氨酸的性能,使用30 L发酵罐按照1.2.8的方法进行发酵罐培养实验,同时以菌株AC-1042做对照。结果如图5所示。
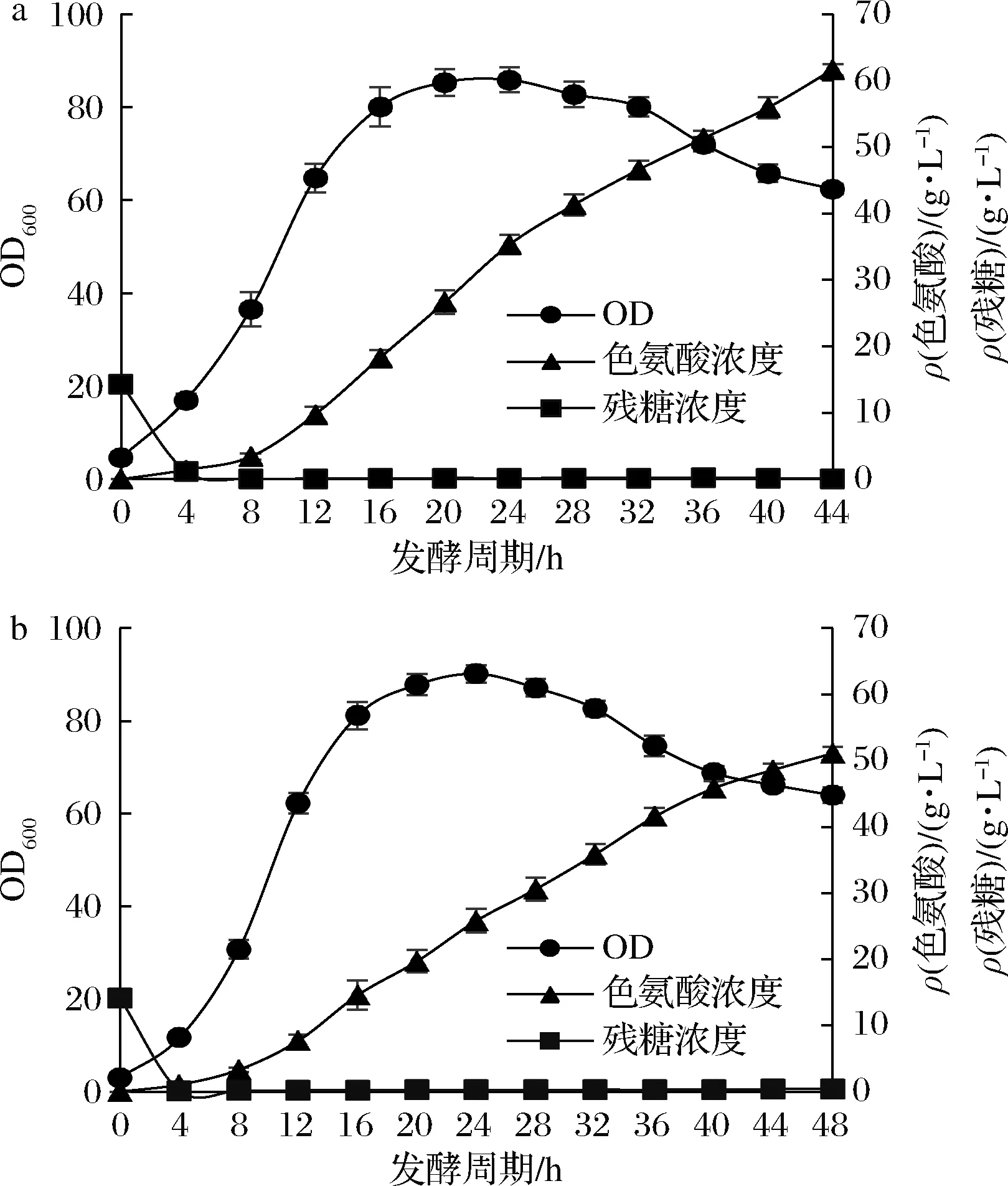
a-突变株ACTRP104;b-出发菌AC-1042图5 突变株ACTRP104与出发菌AC-1042发酵过程比较Fig.5 Comparision of fermentation process between mutant ACTRP104 and AC-1042
在发酵过程中,突变株ACTRP104菌体增长的OD600值和残糖浓度相比出发菌AC-1042差别不大,但是色氨酸浓度从8 h后突变株ACTRP104明显高于出发菌AC-1042。从30 L罐发酵的结果来看,出发菌AC-1042发酵结束时,色氨酸质量浓度为51.08 g/L,而突变株ACTRP104发酵结束时,色氨酸质量浓度达到61.65 g/L,相比出发菌AC-1042提高了20.69%。经过计算,突变株ACTRP104发酵结束葡萄糖转化率达到20.64%,比出发菌AC-1042的葡萄糖转化率(17.52%)提高了17.81%;同时,突变株ACTRP104的发酵周期也比出发菌AC-1042缩短了4 h。
3 结论与讨论
本研究通过使用ARTP诱变育种技术结合结构类似物抗性定向筛选技术,进行高产色氨酸菌株的选育。结果表明,经过ARTP诱变处理后更易于在结构类似物抗性的筛选平板上获得抗性突变株。ARTP诱变育种技术与结构类似物抗性定向筛选相结合的策略,可以高效地选育色氨酸高产菌株。ARTP诱变处理色氨酸生产菌株的处理时间选择40 s,致死率达到90%以上,使用分别含有5-MT、PFP的抗性培养基进行抗性筛选,筛选解除或减弱L-色氨酸、L-苯丙氨酸和L-酪氨酸反馈抑制的突变株。经过多次ARTP处理和抗性筛选,并经过遗传稳定性测定,最终获得1株高产色氨酸的突变株ACTRP104,经过30 L发酵罐培养,色氨酸质量浓度达到61.65 g/L,对葡萄糖的转化率达到20.64%,相比于出发菌AC-1042分别提高了20.69%和17.81%,同时发酵周期缩短了4 h。研究结果证明,本研究采用的ARTP诱变育种技术与结构类似物抗性定向筛选相结合的策略选育色氨酸高产菌株取得了良好的效果,可以进一步持续对色氨酸生产菌进行选育改良。色氨酸突变株ACTRP104发酵技术水平有了较大提升,菌种稳定性良好,应用于色氨酸工业化生产,可以显著提高色氨酸发酵的产酸率和转化率,降低发酵生产成本,具有较好的工业化推广与应用潜力。
