假丝酵母氨基甲酸乙酯水解酶的分子克隆及酶学性质
2022-02-23张献冯治平张耀张雪怡杨丽娟
张献,冯治平,2,张耀,张雪怡,杨丽娟,2*
1(四川轻化工大学 生物工程学院,四川 宜宾,644000) 2(酿酒生物技术及应用四川省重点实验室(四川轻化工大学),四川 宜宾,644000)
氨基甲酸乙酯(ethyl carbamate,EC),是发酵食品和酒精饮料在生产、储藏过程中生成的对人体具有潜在致癌性和遗传毒性的一种微量有害物质[1-3]。2007年国际癌症研究机构将其归为2A类致癌物后,EC问题引起世界各国的关注[4]。为保障食品安全,消除发酵食品和酒类中的EC刻不容缓。
目前针对由尿素产生酒精饮料EC问题,国内外主要涉及以下4个研究领域:对发酵工艺的优化[5-6]、物理吸附[7-8]、代谢工程改造酵母[9-10]以及生物酶法(如脲酶[11-13]),其中生物酶法是目前最理想的一种方法[14]。脲酶能够消除EC前体物质尿素,从而从源头上控制EC的产生[15],而氨基甲酸乙酯水解酶(urethanase,UH)能将已生成的EC降解成乙醇、氨和二氧化碳[16]。最早报道的UH是KOBASHI等[17]从Citrobactersp.分离得到的,随后又在Bacilluslicheniformis和B.thiaminolyticus发现了UH的活性[18-19]。2006年,AKUTSU-SHIGENO等[20]发现来自RhodococcusequiTB-60的55 kDa蛋白具有UH活性,获得其基因序列(GenBank:DD320008.1),并实现了异源表达。随后,李京京等[21]从小鼠肠道中筛选出了一株能降解EC的LysinibacillusfusiformisSC02并通过N端测序获得了其编码UH的基因序列(GenBank:KU353448.1),研究发现该酶为中性酶,且稳定性较差。2019年,MASAKI等[22]在Candidaparapsilosis中获得了该菌编码的UH基因序列(GenBank:LC511748.1),研究发现该菌的UH由4个大小为60 kDa的亚基组成。
本研究通过对假丝酵母的UH进行亚克隆并实现异源可溶性表达,研究了其酶学性质,研究结果可为后续的结构解析、分子改造及应用奠定了基础。
1 材料与方法
1.1 材料
1.1.1 菌种和质粒
假丝酵母(菌株保藏号:CCTCC AY 2017001),中国典型培养物保藏中心;大肠杆菌EscherichiacoliDH5α、大肠杆菌EscherichiacoliBL21 (DE3)、pET-28a,本实验室保存。
1.1.2 培养基
LB培养基(g/L):蛋白胨10,酵母粉5,NaCl 10,pH 7.2;配制固体培养基需加入20的琼脂。
1.1.3 主要试剂
DNA及蛋白质Markar,北京全式金生物技术有限公司;酵母基因提取试剂盒,北京索莱宝科技有限公司;DNA胶回收试剂盒,天根生化科技(北京)有限公司;限制性核酸内切酶BamHⅠ、XhoⅠ,宝生物工程(大连)有限公司;蛋白胨、NaCl、酵母粉、氨基甲酸乙酯等常规试剂均为市售分析纯。
1.1.4 仪器与设备
UV-1800分光光度计,翱艺仪器(上海)有限公司;SCIENTZ-Ⅱ D超声波破碎仪,宁波新芝生物科技股份有限公司;5340R高速冷冻离心机,德国Eppendorf仪器公司。
1.2 实验方法
1.2.1cpUH基因克隆与pET-28a-cpUH的构建
根据GenBank公布的假丝酵母氨基甲酸乙酯水解酶(LC511748.1)基因序列设计特异性引物。
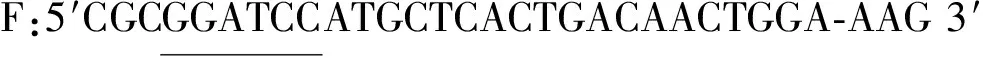

以假丝酵母基因组为模板,PCR扩增cpUH基因。PCR程序测定:94 ℃预变性3 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,72 ℃延伸10 min,其中变性、退火及延伸循环30次。纯化PCR产物,连接到pET-28a上构建重组表达质粒pET-28a-cpUH,并转化E.coliDH5α,通过双酶切鉴定重组子,阳性质粒送擎科生物公司测序。
1.2.2 重组cpUH的诱导表达
将pET-28a-cpUH质粒转化到E.coliBL21 (DE3)中,过夜培养并活化E.coliBL21/pET-28a-cpUH。以2%的接种量,将培养好的E.coliBL21/pET-28a-cpUH种子液接到新鲜LB培养基(含50 μg/mL Kana)。37 ℃、180 r/min振荡培养2~3 h,检测菌液OD600。在对数期(OD600为0.6~0.8)时,加入0.25 mmol/L IPTG,于25 ℃诱导培养8 h。
1.2.3 亲和色谱纯化cpUH蛋白
在4 ℃、7 000 r/min下收集培养好的重组菌E.coliBL21/pET-28a-cpUH菌液。用20 mmol/L PBS (pH 7.4) 洗涤菌体2 次后,重悬菌体并置于冰浴中进行超声破碎。将破碎后的菌液于4 ℃、7 000 r/min条件下离心30 min,收集上清液(即cpUH粗酶液)。纯化前先用镍柱平衡缓冲液(含250 mmol/L NaCl,5 mmol/L 咪唑的20 mmol/L、pH 7.4的PBS缓冲液)进行镍柱的平衡,然后使用洗脱缓冲液(含有10~250 mmol/L的咪唑)进行梯度洗脱,最后使用二喹啉甲酸(bicinchoninic acid,BCA)法测定蛋白浓度。
1.2.4 酶活力测定方法
1.2.4.1 酶活力测定步骤

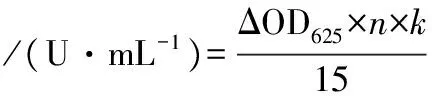
(1)
式中:ΔOD625,测定反应后与空白样品吸光度之差;n,酶活力测定液稀释倍数;k,标准曲线斜率的倒数;15,酶作用的时间,min。
1.2.4.2 标准曲线的绘制

1.2.5 cpUH的酶学性质
1.2.5.1 酶的最适反应温度和热稳定性
将经镍柱纯化得到的酶液与底物EC分别在25、30、35、40、45、50、55、60 ℃的温度下反应,以相对酶活力确定该酶的最适反应温度。将镍柱纯化后的酶液在上述不同温度条件下保温8 h,中间每隔2 h测定1次酶活力,以该酶在各温度的初始酶活力为100%,计算该酶的相对酶活力。
1.2.5.2 酶的最适反应pH及pH稳定性
将纯化后的酶液与底物EC在不同pH(3、4、5、5.5、6、6.5、7、7.5、8、8.5、9、10)的缓冲液中进行反应,反应结束后测定cpUH在不同pH条件下的酶活力,确定该酶的最适反应pH。将纯化后的酶液保存在不同pH(5、6、7、8、9)缓冲液中,在4 ℃冰箱中放置8 h,每隔2 h检测1次酶活力,以各pH的初始酶活力为100%,计算各时间段所对应的相对酶活力。
1.2.5.3 酶对NaCl 和乙醇的耐受性检测
配制不同NaCl浓度的缓冲液,将镍柱纯化得到的酶液保存于各缓冲液中,4 ℃保存2 h,测定相应条件下的酶活力。计算该酶在不同NaCl浓度条件下的酶活力,其中以NaCl浓度为0时所测酶活力为100%,确定NaCl浓度对其酶活力稳定性的影响。配制含有不同体积分数的乙醇缓冲液,将纯化得到的酶液保存于各缓冲液中,4 ℃保存4 h,测定相应条件下的酶活力。计算该酶在不同体积分数乙醇条件下所对应的酶活力,并以乙醇体积分数为0时所测酶活力为100%,确定乙醇体积分数对酶活力稳定性的影响。
1.2.5.4 金属离子、EDTA对酶活力的影响
将纯化得到的酶液与终浓度为1 mmol/L 的金属离子(Fe3+、Mn2+、Zn2+、Ca2+、Co2+、Mg2+、Cu2+)或EDTA的缓冲液混合,4 ℃保存30 min,测定酶活力。确定金属离子及EDTA对酶活力的影响。
1.2.5.5 酶的底物特异性检测
在最适温度和最适pH条件下,将纯化得到的酶液分别与质量浓度为30 g/L氨基甲酸甲酯、EC、氨基甲酸丁酯、乙酰胺、L-谷氨酰胺、苯甲酰胺反应,测定相应酶活力,以酶对EC的酶活力为100%。
1.2.5.6 动力学参数的确定
测定cpUH在不同EC浓度体系(5、10、20、80、200、500 mmol/L)中的反应速度,根据底物浓度与反应初速度之间的关系,利用Lineweaver-Burk双倒数法确定动力学参数Km与Vmax。
2 结果与分析
2.1 cpUH基因的克隆与表达
以假丝酵母基因组为模板,PCR扩增cpUH基因,约在1 650 bp处出现特异性条带(图1-a)。PCR产物连入pET-28a载体,经双酶切释放约1 650 bp的目的条带(图1-b),测序结果与GenBank公布序列一致,cpUH开放阅读框为1 656 bp,编码551个氨基酸残基,分子质量约为61.65 kDa。
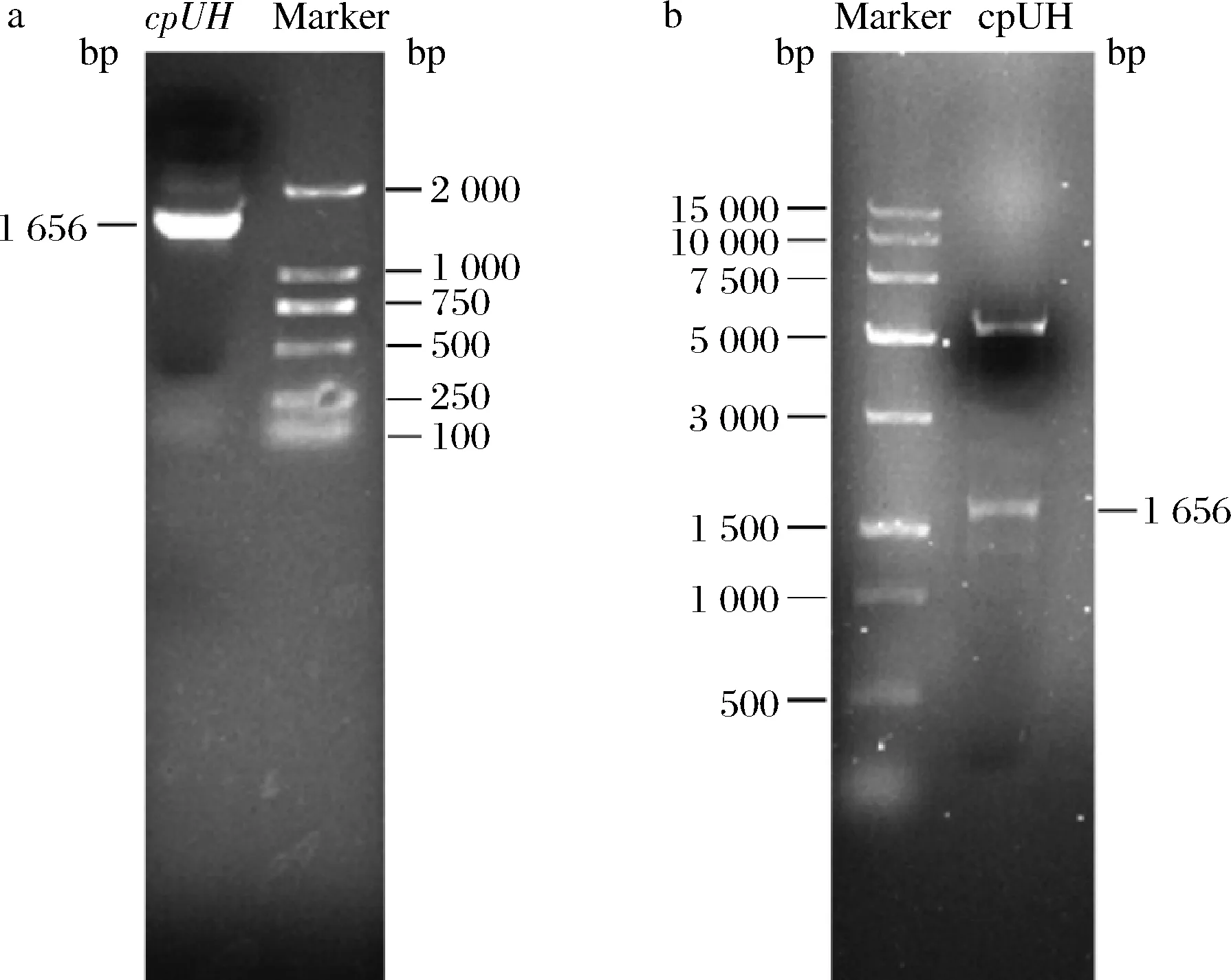
a-cpUH PCR产物;b-重组子(pET-28a-cpUH)酶切鉴定图1 假丝酵母cpUH的基因克隆与酶切鉴定Fig.1 Gene cloning and enzyme digestion identification of C.parapsilosis cpUH
pET-28a-cpUH转化至E.coliBL21(DE3),经0.25 mmol/L IPTG诱导表达后,SDS-PAGE电泳检测,在约60 kDa位置出现目的条带(图2)。
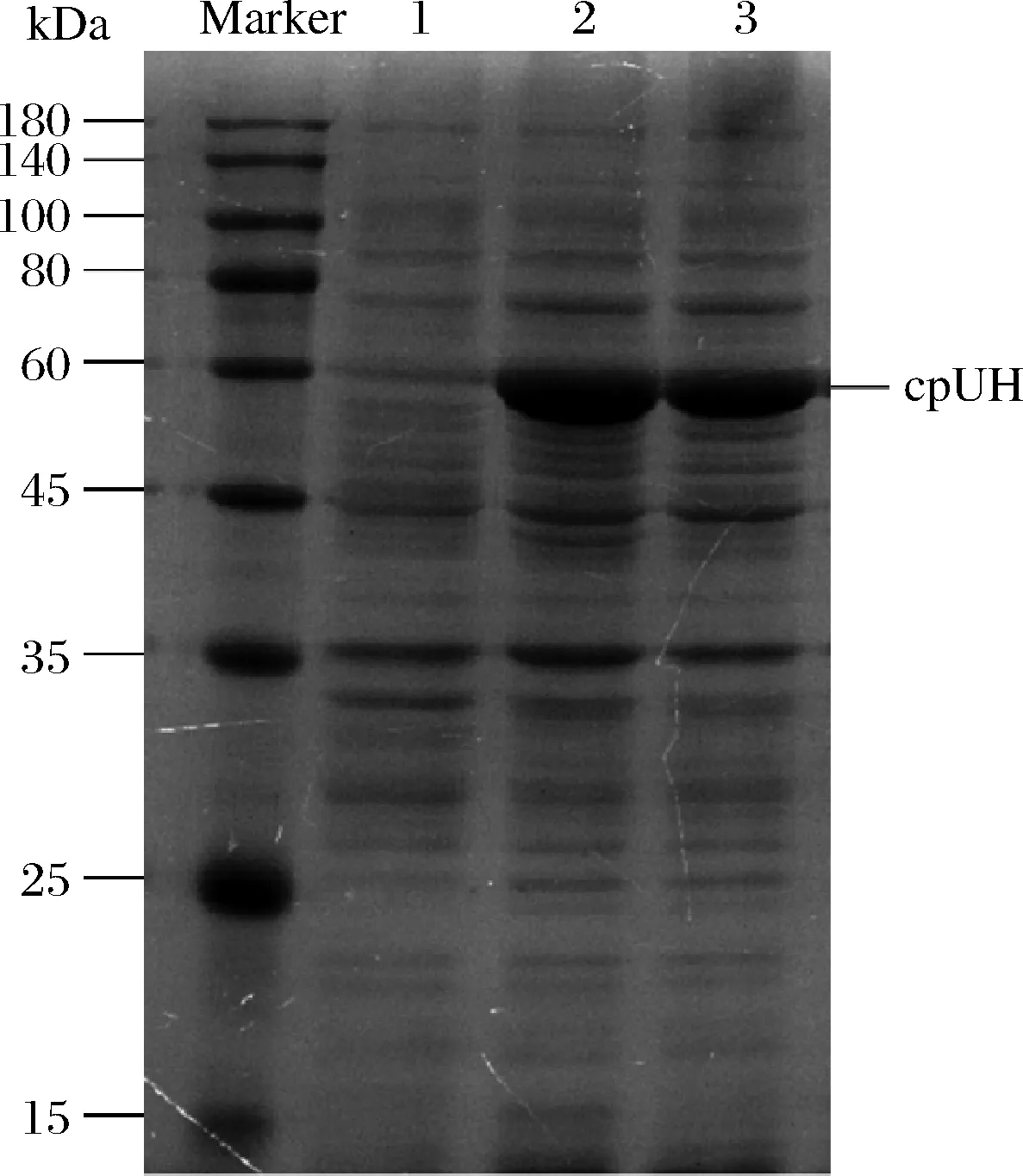
Marker-蛋白质分子质量标记; 1-含有质粒pET-28a的大肠杆菌的超声上清液; 2-IPTG诱导的携带质粒pET-28a-cpUH的大肠杆菌粗蛋白; 3-IPTG诱导含有质粒pET-28a-cpUH的大肠杆菌超声上清液图2 重组cpUH诱导表达的SDS-PAGE分析Fig.2 SDS-PAGE analysis of induced expression of recombinant cpUH
2.2 亲和色谱分离纯化重组cpUH
粗酶液经过Ni2+-NTA亲和色谱分离纯化获得电泳级cpUH,SDS-PAGE电泳检测(图3),约为60 kDa。经过纯化后,酶比活力为3.10 U/mg,纯化倍数约为28.58倍(表1)。
2.3 酶反应的最适温度及其稳定性
酶的最适反应温度如图4-a所示,cpUH在温度为25~60 ℃内,随着温度的上升,其酶活力呈现出先上升后下降的趋势。温度为40 ℃时,酶活力达到最高;温度>45 ℃时,酶活力急剧下降。
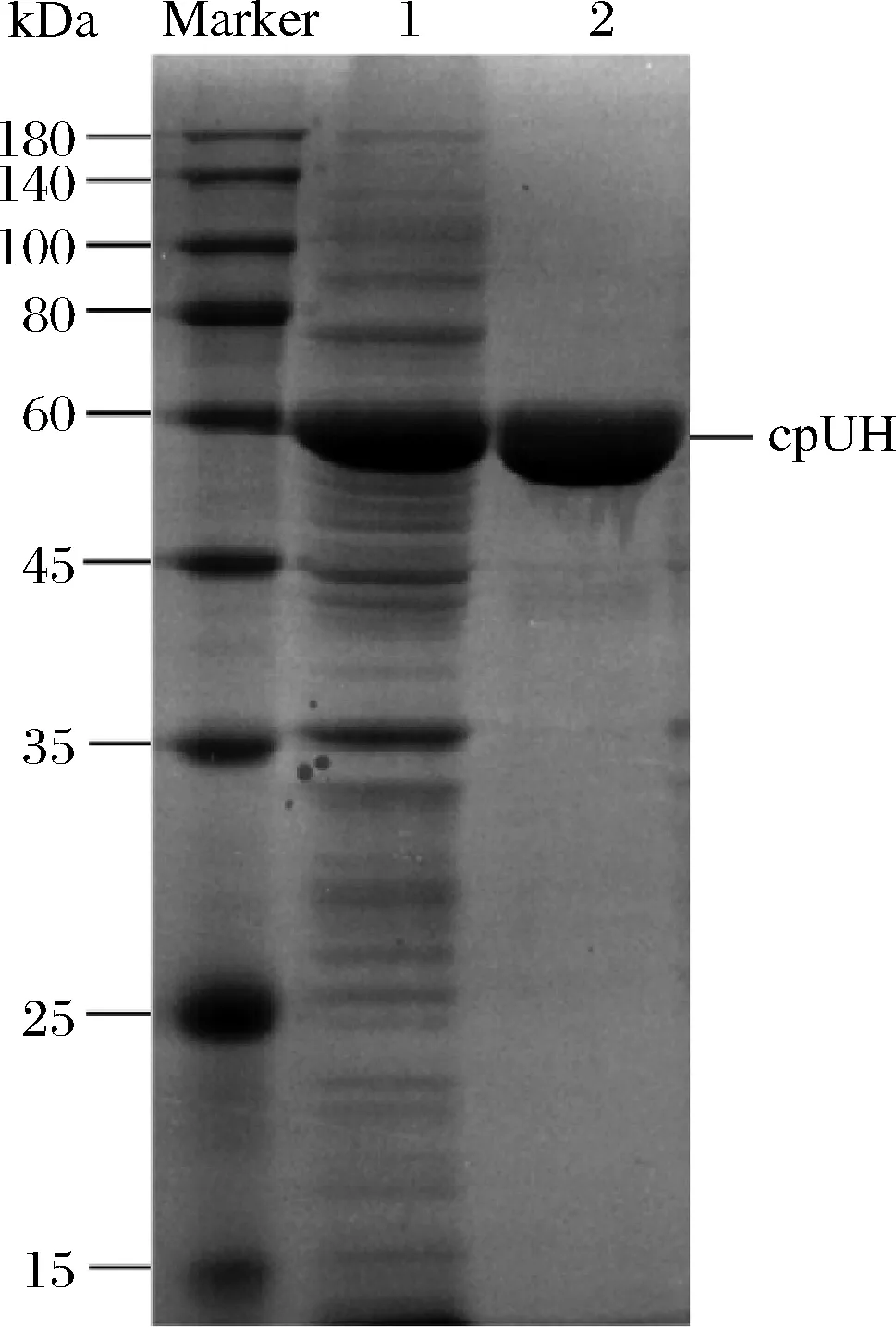
Marker-蛋白质分子质量标记; 1-IPTG诱导的携带质粒pET-28a-cpUH 的大肠杆菌粗蛋白; 2-通过Ni2+-NTA亲和层析纯化后的蛋白质图3 重组cpUH亲和纯化的SDS-PAGE分析Fig.3 SDS-PAGE analysis of affinity purification of recombinant cpUH
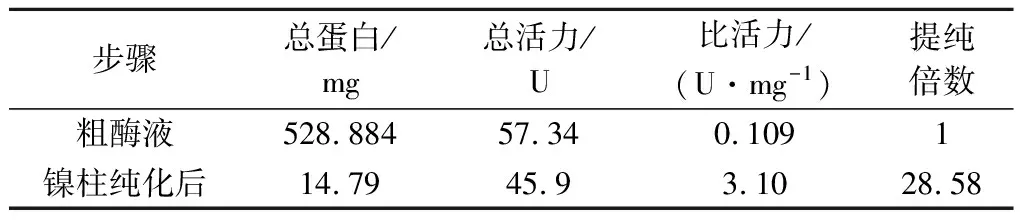
表1 Ni-NTA亲和色谱纯化重组cpUHTable 1 Purification of recombinant cpUH by Ni2+-NTA affinity chromatography
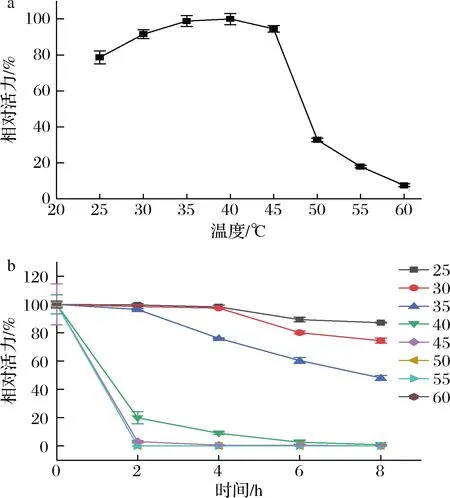
a-最适温度;b-温度稳定性图4 反应温度对cpUH的活力及稳定性影响Fig.4 Effect of reaction temperature on activity and stability of cpUH
cpUH在25~30 ℃能保持很好的稳定性,如图4-b所示,8 h后仍有70%以上的酶活力。35 ℃表现出较好的稳定性,保温8 h后仍保留48.08%的酶活力。但当温度>40 ℃后,cpUH的稳定性较差,8 h后都失去了活力。
2.4 酶反应的最适pH及其稳定性
酶的最适反应pH值如图5-a所示。pH 3~4时,酶活力为0;pH 5.0~7.5时,随着pH的升高,酶活力逐渐升高;pH=7.5时,酶活力达到最高,相对酶活力为100%;当pH>7.5时,酶活力下降;但pH=8.5时还保留90%左右的酶活力;当pH>8.5后,酶活力急剧下降;pH=10时,只保留了6%的酶活力。

a-最适pH;b-pH稳定性图5 pH对cpUH的活力及稳定性影响Fig.5 Effect of pH on activity and stability of cpUH
酶的pH稳定性是酶在实际应用中的一个重要指标。由图5-b可知,cpUH在pH 6.0~9.0都具有较好的稳定性,8 h以后仍能保持70%左右的酶活力,而cpUH在pH 5.0中稳定性较差,8 h后降到了0,失去酶活力。
2.5 酶对NaCl 和乙醇的耐受性
cpUH对NaCl和乙醇的耐受性分别如图6所示。该酶的酶活力随着NaCl质量分数和乙醇体积分数的增加,都呈现下降趋势。当NaCl质量分数为10%时,酶活力保留了50%左右,而当NaCl质量分数为20%时,该酶的残余酶活力为未经NaCl处理酶活力的10%左右。乙醇的添加也抑制了cpUH的活性,当乙醇体积分数为10%时,酶活力保持了60%左右,乙醇体积分数为20%时,残余酶活力为50%。该结果表明,cpUH对低质量分数的NaCl 和低体积分数乙醇具有一定耐受性,可为在酱油和低酒精度的黄酒中使用提供参考。
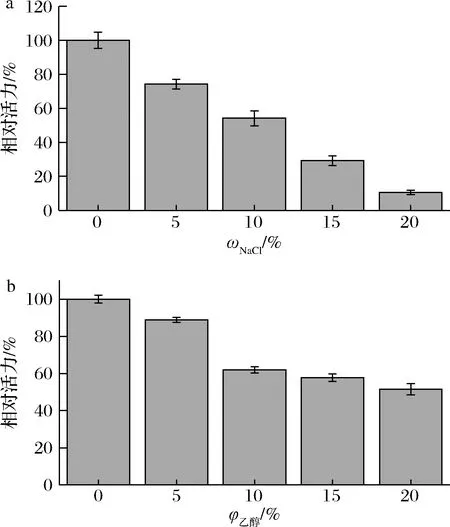
a-NaCl耐受性;b-乙醇耐受性图6 cpUH对NaCl和乙醇的耐受性Fig.6 Tolerance of cpUH to NaCl and ethanol
2.6 金属离子与EDTA对酶活力的影响
各种金属离子对cpUH酶活力均有不同程度的抑制,其中Fe3+、Mn2+、Ca2+和Mg2+抑制了15%~20%的酶活力,Co2+抑制了41%的酶活力,而Zn2+、Cu2+严重抑制酶活力,酶活力分别降至原来的11%和0.77%;金属螯合剂EDTA对酶活力无显著影响,如图7所示。
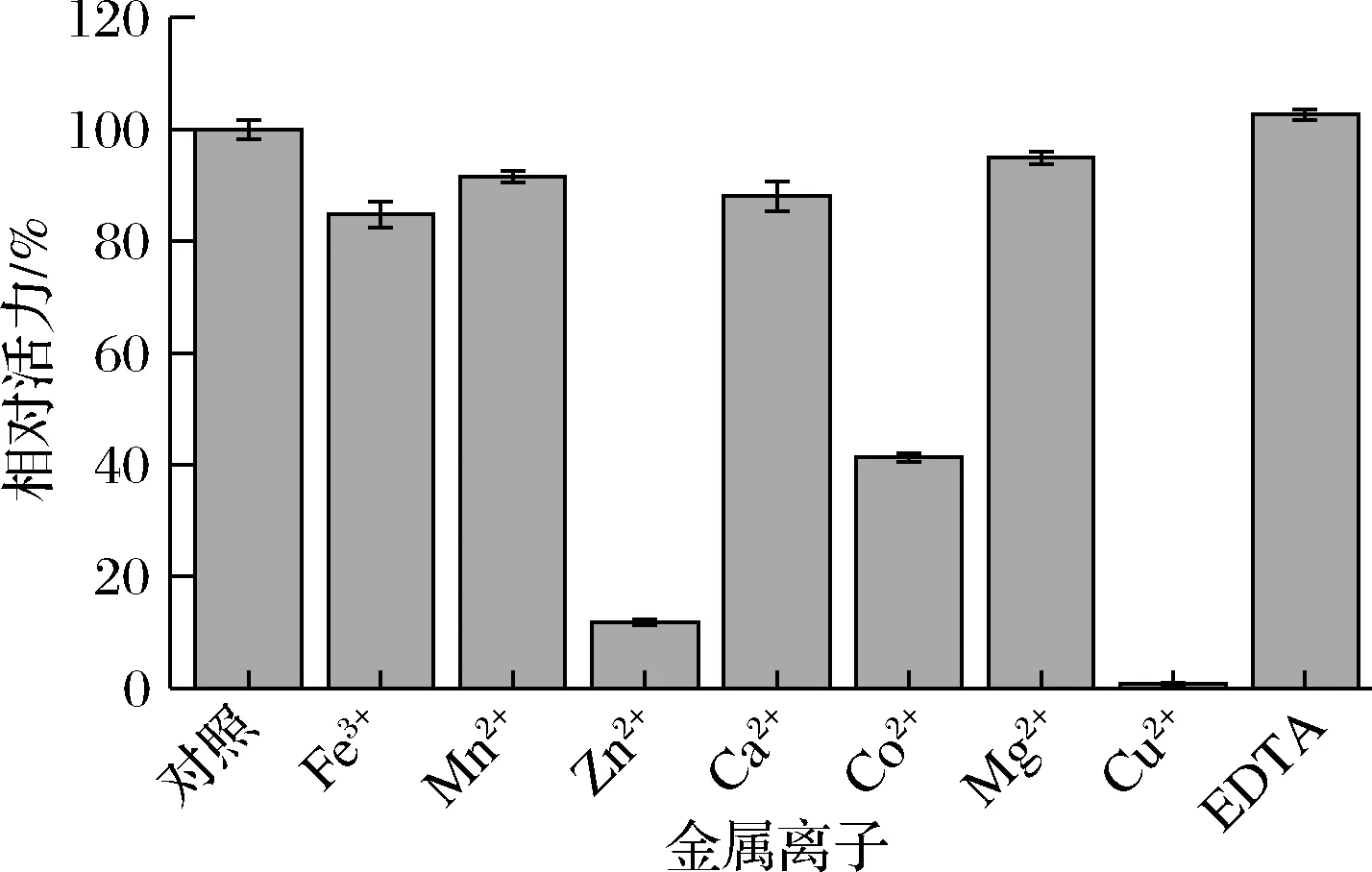
图7 金属离子与EDTA 对cpUH酶活力的影响Fig.7 Effects of metal ions and EDTA on the activity of cpUH
2.7 酶的底物特异性
为了考察cpUH对底物的特异性,本研究选择6种底物进行研究,结果如表2所示,测定了对3种氨基甲酸酯的酶活性。该酶对EC的活性最高,对氨基甲酸甲酯的活性为90.06%,对氨基甲酸正丁酯的活性为13.74%。相互比较了对3种酰胺化合物的酰胺酶活性。该酶对苯甲酰胺、L-谷氨酰胺和乙酰胺显示出几乎相同的活性。

表2 cpUH的底物特异性Table 2 Substrate specificity of cpUH
2.8 酶反应动力学
以EC为底物,测定不同底物浓度下该酶的酶促反应速率,并做出Lineweaver-Burk图,结果如图8所示。根据Lineweaver-Burk双倒数法得到方程:y=1.796 4x+0.299(R2=0.997 4),计算得出该UH的Km值为6.01 mmol/L,Vmax为3.34 μmol/min。
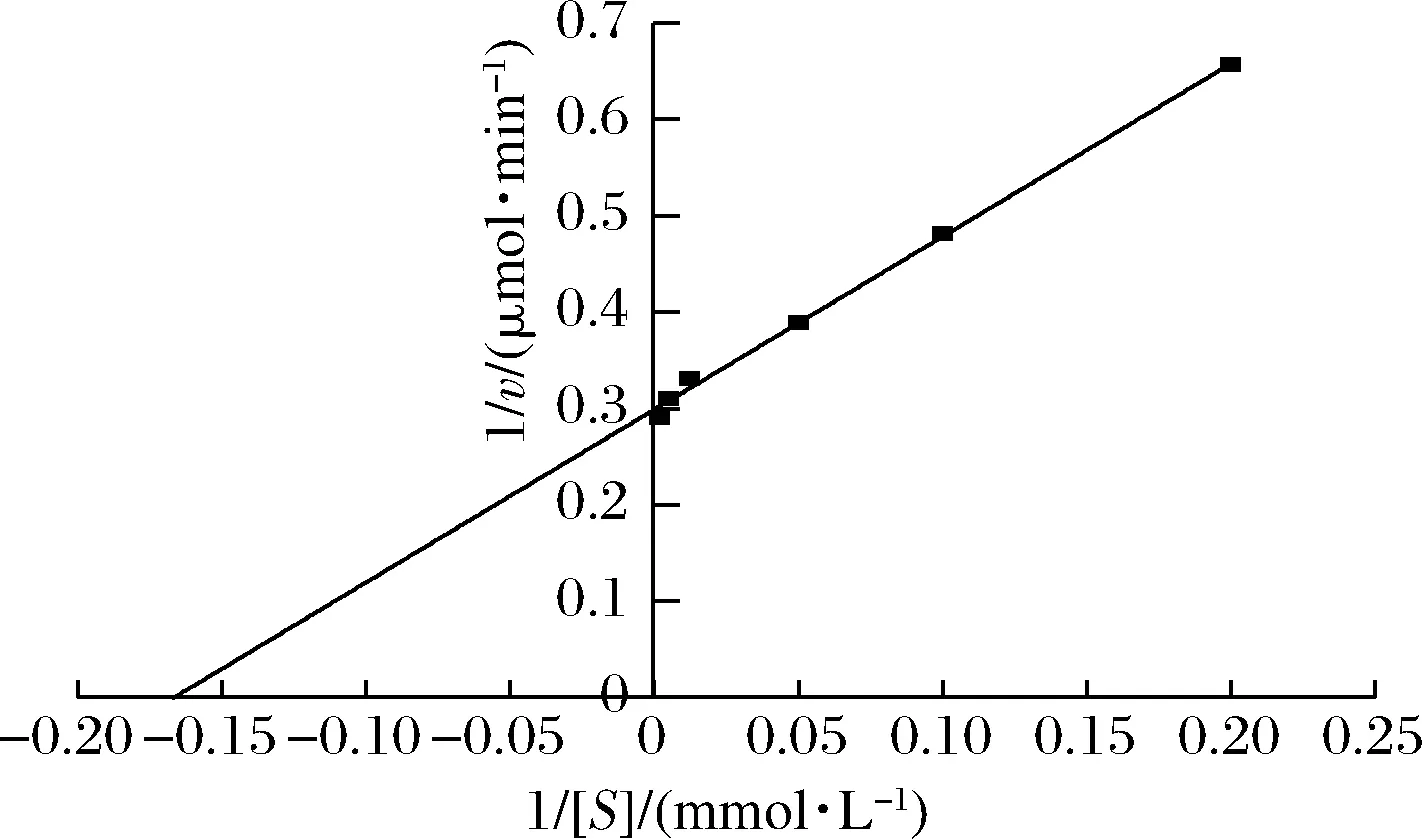
图8 假丝酵母cpUH催化氨基甲酸乙酯的Lineweaver-Burk图Fig.8 Lineweaver-Burk plots of ethyl carbamate catalyzed by C.parapsilosis cpUH
3 结论与讨论
本研究从假丝酵母中克隆了UH基因,并实现了其在大肠杆菌中的可溶性表达和酶学性质的考察,为后续的分子改造奠定了基础。假丝酵母的UH基因大小为1 656 bp,编码551个氨基酸;蛋白分子质量约为60 kDa。酶学性质研究表明,cpUH酶促反应的最适pH和温度分别为7.5和40 ℃。cpUH在25~30 ℃具有较高的温度稳定性。cpUH在pH 6.0~8.0具有较好的稳定性,8 h以后仍能保持70%左右的酶活力。不同的金属离子对UH影响不同,终浓度1 mmol/L的Fe3+、Mn2+、Zn2+、Ca2+、Co2+、Mg2+、Cu2+对cpUH的酶活力无激活作用,而Mn2+、Ca2+可以激活肺炎克雷伯氏菌的UH的酶活力[25],此外,EDTA对cpUH的酶活性无影响。底物特异性的考察表明,cpUH对EC的水解活性最强,氨基甲酸甲酯、氨基甲酸丁酯的水解活性依次减小,对乙酰胺、L-谷氨酰胺、苯甲酰胺具有较强的水解作用,而来自于赖氨酸芽孢杆菌的UH,其随着底物碳链长度的增加,酶活力减小,对苯甲酰胺和谷氨酰胺没有降解效果[21]。cpUH对盐和乙醇的耐受性研究发现,其具有良好的乙醇耐受性,4 ℃保温4 h后,在乙醇体积分数为20%时,其残余酶活力为50%左右,这可为其在低酒精度的黄酒中使用提供参考。此外,本文还研究了cpUH的酶反应动力学,发现其Km值为6.01 mmol/L,相比较于变幻青霉[26](Km为27.2 mmol/L)及赖氨酸芽孢杆菌[21](Km为37.2 mmol/L)对EC具有较强的亲和力。
