2019 新型冠状病毒肺炎凝血异常机制与中医血瘀证候
2022-02-21澧秦
周 澧秦 川
(中国医学科学院医学实验动物研究所, 北京协和医学院比较医学中心, 国家卫生健康委员会人类疾病比较医学重点实验室, 国家中医药管理局人类疾病动物模型三级实验室,北京 100021)
2020 年1 月30 日世界卫生组织宣布新型冠状病毒肺炎(COVID-19)为国际关注的突发公共卫生事件,之后在世界范围内大流行,成为百年一遇的全球性健康危机。 截至目前,全球新型冠状病毒(SARS-CoV-2)感染累积确诊人数已达2.3 亿,累计死亡人数超4 百万。 SARS-CoV-2 是一种高度传染性和致病性的冠状病毒,其主要致病机制是通过与血管紧张素转换酶2(ACE2)受体结合从而感染和破坏Ⅱ型肺泡上皮细胞而引起呼吸道症状。 进行性呼吸衰竭是COVID-19 致死的主要原因,然而增加的证据表明,凝血功能障碍和血栓形成是COVID-19 重症患者主要临床特征之一并与死亡风险密切相关。 由于炎症、缺氧、血管内皮损伤等因素所致凝血系统异常,加上高龄、基础疾病(如高血压病、肥胖症等)、卧床、留置深静脉导管等其他高危因素,使得COVID-19 患者易出现深静脉血栓、肺栓塞、心肌梗死和脑梗死等血栓性并发症[1]。 大量尸检结果显示COVID-19 病人肺内存在广泛的血栓形成并伴有内皮损伤、血管增生等微血管病变。COVID-19 病人的肺泡毛细血管血栓发生率是流感患者的9 倍(P<0.001)[2]。 凝血异常和血栓形成主要发生于重症COVID-19 患者,可引起肺栓塞、心梗、脑梗、休克、弥散性血管内凝血(disseminated intravascular coagulation,DIC)、多器官衰竭等严重并发症,与病情严重程度和致死率密切相关。 COVID-19 的中医病机为“湿、热、毒、瘀、虚”,凝血异常归属于血瘀的范畴。 本综述将围绕COVID-19 患者凝血异常发生机制进行探讨并结合中医血瘀理论进行分析,为中药用于新冠防治提供科学证据并对临床干预和科研探索提供帮助。
1 COVID-19 病人凝血异常的机制
D-二聚体水平升高是COVID-19 患者高凝状态最典型的表现,COVID-19 重症患者D-二聚体水平和纤维蛋白降解产物(fibrin degradation products,FDP)显著高于轻症患者,并与患者死亡率显著相关[1,3-5]。 凝血酶原时间(prothrombin time,PT)和活化部分凝血活酶时间(activated partial thromboplastin time,APTT)在COVID-19 患者中轻微延长或不变,但也有少部分患者PT 和APTT 缩短[1]。 血小板计数在大多数COVID-19 患者中处于正常水平,而重症患者血小板减少症发生率增加,并与疾病严重程度和致死率相关[6]。 COVID-19 患者的凝血异常与细菌性脓毒症所致凝血系统异常不同,后者的突出表现并非以D-二聚体水平升高为主,而是以血小板减少和PT 时间延长为重要特征,提示COVID-19 相关凝血异常的独有特征[7-8]。
目前认为新冠肺炎凝血功能紊乱可能与免疫炎症、内皮损伤和功能失调、血小板活化、ACE2 相关信号通路异常、组织缺氧等多因素相关。
1.1 免疫炎症
SARS-CoV-2 感染后可诱发宿主免疫反应,导致免疫细胞分泌大量促炎细胞因子,如IL-6、TNF-α、IL-1β、IL-8、GM-CSF 等,引发炎症细胞因子风暴,触发巨噬细胞和中性粒细胞及血管内皮细胞表达组织因子,进而引发微血管血栓形成。 与其他呼吸系统感染病毒相比,SARS-COV-2 显示出Ⅰ型和Ⅲ型干扰素信号通路激活缺陷和更高的IL-6 和趋化因子表达水平[9]。 尸检病理检查显示COVID-19 病人肺组织炎症细胞浸润主要以单核巨噬细胞主,而淋巴细胞和浆细胞浸润相对少见,提示单核细胞可能是炎症因子的主要来源[10]。 在SARS-CoV-2 感染过程中,干扰素信号缺陷导致抗病毒先天免疫应答异常而趋化因子表达持续升高,以单核细胞为主的非特异性免疫过度活化是COVID-19 炎症风暴的重要原因。 炎症和凝血系统之间具有紧密联系。 一方面,TNF-α 和白介素等炎症因子可以诱导血细胞和内皮细胞组织因子的表达,抑制TFPI 的活性,损伤内皮细胞,激活血小板,启动和增强凝血级联反应[11]。 另一方面,炎症因子还可促进血管壁白细胞粘附,影响微血管活性和微循环血流动力学,促进血栓形成。 另外,炎症因子还可激活中性粒细胞释放中性粒细胞胞外诱捕网(neutrophil extracellular traps,NETs)。 NETs 其独特的网状结构不仅可为血栓的形成提供支架,还可以通过黏附和激活血小板,激活凝血因子,抑制TFPI 的活性,损伤内皮细胞损伤,活化补体系统等多种机制促进血栓的形成[12]。 另外,病理染色显示在COVID-19 病人肺及肺外组织血管部位存在补体系统的激活,提示补体系统激活在内皮损伤和凝血异常中的潜在作用[13-16]。 除此之外,抗磷脂抗体和狼疮抗凝物增加等自身免疫反应异常也可能与COVID-19 凝血异常有关[17]。
1.2 内皮细胞损伤和功能失调
血栓形成3 要素包括凝血功能亢进、血管壁损伤和血流状态改变,其中血管内皮细胞损伤是血栓发生的关键因素之一。 病理检查显示,COVID-19 患者肺部存在广泛的血栓形成并伴有微血管内皮炎[2,18]。 除肺部血管外,皮肤、心脏、脑、肝、小肠和肾等脏器也有报道存在微血管内皮损伤和血栓[18-19]。 内皮细胞表面糖萼结构的损伤导致正常内皮细胞抗凝性质丢失是内皮损伤导致凝血激活的重要原因。 危重症COVID-19 病人血浆中硫酸软骨素、Syndecan-1 和透明质酸水平的升高及肝素酶活性增加提示内皮细胞表面糖萼降解和丢失[20-21]。Fernandez 等[22]研究显示COVID-19 病人血浆内皮损伤标记物sVACM1、vWF、硫酸乙酰肝素水平与疾病严重程度显著相关;同时与败血症休克病人相比血浆α2-抗纤溶酶和ADAMTS13 活性相对较高。 血管内皮表达ACE2 蛋白,一些研究结果显示SARSCoV-2 可直接感染内皮细胞导致内皮细胞损伤和激活[2,18,23]。 但是,目前尚存在一定争议,一些研究对内皮细胞ACE2 的表达水平、病毒感染效率及检测到的病毒颗粒的可靠性提出了质疑[24-26]。 炎症损伤等间接因素可能是COVID-19 病人血管内皮损伤和凝血增强的主要原因。 血管内皮损伤可影响NO、vWF、 组 织 型 纤 溶 酶 原 激 活 剂 (tissue-type plasminogen activator,tPA)、PAI1、TFPI、前列环素PGI2、血栓调节蛋白等相关因子的表达,导致血管收缩和通透性增加,组织因子释放和胶原暴露,促进血小板激活、粘附和聚集,最终引起凝血异常和血栓风险[27]。
1.3 血小板激活
Manne 等[28]研究显示COVID-19 住院病人血小板计数和平均血小板体积没有显著改变,但血小板转录组测序结果显示蛋白泛素化、抗原呈递和线粒体功能失调等相关的基因表达谱存在明显改变。同时,COVID-19 病人血小板和中性粒细胞、单核细胞和T 细胞的聚集均显著增加,P-选择素表达增加,血小板活性和聚集能力显著增强并可显著增加单核细胞组织因子的表达[28-29]。 Zhang 等[30]研究显示血小板表达ACE2 和TMPRSS2,SARS-CoV-2 病毒和S 蛋白可以直接作用于血小板,剂量依赖性的增强胶原、凝血酶或ADP 诱导的血小板聚集。 相反,Shen 等[31]研究显示血小板不表达 ACE2 和TMPRSS2,但SARS-CoV-2 可通过ACE2 非依赖的方式直接作用于血小板,增加P 选择素的转位和糖蛋白GPⅣ、血小板因子PF4 和趋化因子RANTES 的表达,并可低效感染体外培养的血小板和巨核细胞。 Zaid 等[32]研究显示血小板可能是 COVID-19病人炎症因子水平升高的来源之一,并发现血小板病毒RNA 检测率与病人年龄密切相关。 这些研究表明 SARS-CoV-2 可能通过 ACE2 或非 ACE2 依赖的方式与血小板发生作用,促进血小板活化聚集和炎症因子的释放,参与凝血异常和血栓形成。
1.4 ACE2 相关信号通路异常
ACE2 是SARS-CoV-2 入侵细胞的受体,同时也是RAS 的重要组成部分。 SARS-CoV-2 通过ACE2感染细胞后,可通过ADAM17 和TMPRSS2 对ACE2进行剪切,引起细胞表面ACE2 蛋白表达降低,可能导致 RAS 失衡引起机体损伤[33-34]。 Kuba 等[35]研究发现除完整病毒体外,S 蛋白本身即可引起ACE2表达的下调,并加重酸诱导的急性肺损伤而AT1 受体抑制剂氯沙坦可消除S 蛋白的效应。 Lei 等[36]研究显示气管内给与编码S 蛋白的假病毒可导致肺泡隔增厚和单核细胞浸润,伴随ACE2 和磷酸化ACE2蛋白表达下调。 Liu 等[37]研究发现COVID-19 病人血浆AngⅡ水平显著升高,并与疾病严重程度及预后相关。 AngⅡ不仅可引起肺毛细血管收缩和通透性增加,诱导内皮细胞和单核细胞组织因子和PAI1的表达影响凝血平衡,而且可作为重要的促炎细胞因子激活NF-κB 和 ADAM17 导致 IL-6 信号的超活化,加重炎症风暴和内皮损伤[38-39]。
除RAS 外,ACE2 还参与缓激肽信号通路调节,ACE2 可以降解des-Arg9 缓激肽生成无活性代谢产物,而抑制ACE2 可增强des-Arg9 缓激肽相关信号并加重LPS 诱导的肺损伤和炎症反应[40]。 COVID-19 患者ACE2 表达下调可能导致des-Arg9 缓激肽的蓄积,增强血管通透性和炎症反应从而促进肺损伤和凝血级联。 缓激肽具有血管舒张作用。 与常见ARDS 不同,研究显示COVID-19 患者常出现肺血管的扩张,可引起严重的肺通气/血流不匹配,并可能导致肺微血栓的循环播散,导致肺外器官微循环堵塞和系统性微血栓形成[41-43]。
1.5 低氧及其他
COVID-19 病人因肺部病变可出现不同程度缺氧症状,可促进凝血异常和血栓形成。 Pilli 等[44]研究显示低氧诱导的血栓风险与抗凝蛋白S 下调,抑制凝血因子IXa 活性有关。 Stoichitoiu 等[45]研究显示COVID-19 病人血浆抗凝蛋白S 活性显著降低,并与疾病严重程度及预后相关,其机制可能与缺氧及白介素6 相关炎症信号有关。 低氧还可引起内皮细胞损伤和活化,上调Toll 样受体TLR3 的表达,调节免疫炎症反应,增加中性粒细胞NETs 的释放,降低血栓调节蛋白的活性,增加PAI1 的表达及抑制纤溶系统等多种机制导致凝血紊乱[46-49]。 此外,COVID-19 病人发热、腹泻等症状造成体液丢失和血液浓缩以及卧床、活动减少、血管穿刺置管、机械通气治疗等临床特征均可导致血栓风险和凝血异常。
2 COVID-19 病人凝血异常与中医血瘀
2.1 COVID-19 病人中医病机
COVID-19 在中医中属于“疫病”范畴,其基本病机为:疫毒外侵,肺经受邪,正气亏虚,病机特点为“湿、热、毒、瘀、虚”,其传变规律符合中医温病学卫气营血的演变规律[50-51]。 其中COVID-19 病人凝血异常属于中医血瘀范畴,热毒引起的微循环障碍是其主要原因,贯穿于气分、营分、血分等不同阶段。 气分阶段主要是热毒袭肺过程,以发热、咳、喘为主要临床表现,热毒对应机体的免疫炎症应答过程,此阶段为微循环障碍早期,以白细胞黏附于血管壁及炎症因子释放为主;随着炎症细胞的浸润和炎症因子的释放,微血管通透性逐渐增加,血管活性发生改变,出现脉细、舌绛、神昏等表现进入营分阶段;热毒和免疫损伤持续,可导致微血管损伤加重和疫毒入血引起出血和凝血异常,热入血分,病变进入重症阶段[52]。
2.2 COVID-19 与活血化瘀
COVID-19 病人凝血异常可归属于中医血瘀范畴。 中医治疗血瘀证的药物根据作用程度可分为3大类:和血类药物,包括当归、丹皮、丹参、生地黄、赤芍、鸡血藤等以养血和血作用为主;活血类药物,包括川芎、蒲黄、红花、刘寄奴、五灵脂、郁金、三七、穿山甲、大黄、姜黄、益母草、泽兰、苏木、牛膝、延胡索、鬼箭羽、羽香、没药、蛴螬、王不留行、紫薇等以活血行血通瘀作用为主;破血类药物,包括水蛭、虻虫、三棱、莪术、血竭、桃仁、干膝、土鳖虫、蟅虫等以破血消癥攻坚作用为主。 对《新型冠状病毒诊疗方案》中推荐中医药方进行分析,发现临床治疗COVID-19 的中药方剂中涉及的活血化瘀类中药主要是和血活血类药物,包括赤芍(血必净、化湿败毒方、气营两燔方)、红花(血必净)、川芎(血必净)、丹参(血必净)、当归(血必净)、郁金(安宫牛黄丸、醒脑静)、生地黄(气营两燔方)、丹皮(气营两燔方)和大黄(化湿败毒方、莲花清瘟胶囊)等,主要用于病入营分血分的重症和危重症阶段。 其中,血必净注射液是活血化瘀法治疗COVID-19 的典型方药,以血府逐瘀汤为基础研制而成,由红花、赤芍、川芎、丹参、当归等活血化瘀药组成,对COVID-19 病人炎症风暴及凝血功能障碍具有遏制作用,可明显降低重症肺炎患者的病亡率[53-54]。 血必净具有拮抗内毒素、调节免疫反应、保护内皮细胞、改善微循环、纠正凝血功能紊乱等作用,对脓毒症等感染诱发的全身炎症反应综合征和多器官损伤具有良好疗效[55-56]。
赤芍具有活血祛瘀、清热凉血的功效,研究表明赤芍提取液可明显抑制内源、外源凝血系统,抑制凝血酶活性,具有良好的抗凝和抗血栓作用,其机制与其降低血粘度,延长大鼠凝血酶原时间、部分凝血活酶时间以及降低血纤维蛋白原浓度,抑制血小板聚集有关[57-58]。 丹参为活血化瘀代表药物,具有改善微循环,抑制血小板聚集,抑制凝血,促进纤溶,保护血管内皮,扩张血管和改善血液流变学等多种药理作用[59]。 红花黄色素是红花的主要活性成分之一,药理研究表明其可通过抑制血小板的聚集与释放发挥抗凝血和抑制血栓形成的作用[60]。阿魏酸是当归和川芎的有效成分之一,可抑制血小板血栓素和5-HT 的释放,抑制血小板聚集和活化,延长凝血酶原时间,抑制血栓形成[61]。 川芎嗪是川芎的主要成分之一,具有扩张血管,保护内皮细胞,抗血小板聚集和血栓形成等作用[62]。 除直接抗凝作用外,活血化瘀类中药还多具有抗炎、抗氧化应激等作用,可抑制白细胞黏附和血管内皮损伤,参与凝血相关机制的调节。 同时,与西医抗凝药相比,活血化瘀中药多具有多靶点和双向调节作用,如大黄、丹参、赤芍等都在抗凝的同时具有纤溶抑制作用,可有效防止过度纤溶反应和出血风险[63]。
2.3 清热凉血与活血化瘀
中医血瘀证可分为气虚血瘀证、血虚血瘀证、气滞血瘀证、寒凝血瘀证、痰浊血瘀证、热毒血瘀证等6 大类型,COVID-19 病人凝血异常可归为热毒血瘀证型,中医以清热解毒凉血活血为主要治法。 清解热毒是治疗和预防热毒血瘀证的根本,可阻断或减轻产生淤血的原因而间接的起到治疗血瘀的作用。 金花清感颗粒、连花清瘟颗粒、清肺排毒汤、化湿败毒方、宣肺败毒方以及喜炎平注射液、痰热清注射液和热毒宁注射液等COVID-19 治疗方药均具有清热解毒之功效,可能通过免疫调节减轻炎症风暴而改善或预防COVID-19 病人出现热毒血瘀证候。 伤寒论经典古方麻杏石甘汤,是金花清感颗粒、连花清瘟颗粒、清肺排毒汤、化湿败毒方、宣肺败毒方等COVID-19 治疗方药的主要底方之一,研究显示其可显著清除LPS 引起的肺微血管白细胞黏附,减轻小鼠肺组织炎症细胞浸润和肺微血管通透性的增加,提示减少炎症损伤和改善微循环是清热凉血方药的主要药理机制之一[64]。 网络药理学等研究显示多种COVID-19 治疗方药的活性成分还可能与ACE2 相互作用及具有潜在的直接抗病毒效应[65-69]。
此外除免疫炎症引起的热毒血瘀外,COVID-19病人还可损伤肺气,导致肺气亏虚,或痰液引流不畅,堵塞气道,致使肺气壅滞,而肺气不足则行血无力,可能出现气虚血瘀的表现。
在COVID-19 凝血障碍过程中,热毒血瘀是其主要表现,在病变早期进行清热解毒干预可有效调节免疫反应,减轻非特异性免疫损伤,阻断疾病向营分血分等重症阶段转化,而在重症和危重症阶段,应用血必净等活血化瘀类药物可有效改善微循环和凝血障碍,减轻全身炎症反应综合征和多器官功能衰竭,降低病亡率。 同时,除清热凉血解毒化瘀外,在治疗过程中尚须辨证施治清肺、化湿、扶正、补气固脱、养阴生津等治法对COVID-19 病人各种证候进行综合治疗以取得满意疗效。
目前,国内COVID-19 病例较少,除一些网络药理学的理论分析外,关于中医治疗COVID-19 凝血异常的实验研究存在欠缺。 SARS-CoV-2 感染的实验动物如恒河猴、K18-hACE2 转基因小鼠和老年仓鼠等可出现肺微血栓、D-二聚体水平升高和凝血异常等表现[70-72]。 利用实验动物模型研究探讨中医活血化瘀药物对COVID-19 凝血异常的预防和治疗作用,明确其作用机制是中医药现代化和推广的现实需要,值得进一步深入研究。
3 结论
COVID-19 病人尤其是重症COVID-19 病人出现明显的凝血异常和血栓风险是COVID-19 病人病情恶化、多器官衰竭和死亡的重要原因。 免疫炎症、缺氧、补体活化、血管紧张素系统失衡、内皮损伤和血小板活化等多种机制相互作用共同导致机体凝血和纤溶系统功能紊乱,见图1。 其中免疫炎症可能是COVID-19 病人或其他感染性疾病患者出现凝血异常的关键原因和中心环节,SARS-CoV-2 感染后独特的免疫特征产生的炎症因子和趋化因子与凝血系统的相互作用加上SARS-CoV-2 病毒或S蛋白对内皮损伤和ACE2 相关信号通路的直接影响以及缺氧、机械通气、静卧和活动减少等因素的共同作用最终导致了COVID-19 病人的凝血异常和血栓风险。 在中医诊治中,热毒血瘀是COVID-19 凝血异常的主要病机,在治疗过程中运用清热凉血解毒药物预防和阻断病程向热毒血瘀发展,在治疗早期积极干预,尽早加入活血化瘀药物,将有助于降低COVID-19 病人凝血异常和血栓风险,减少重症转化率及死亡率。 与西医相比,中医药治疗具有多靶点治疗优势,可能在免疫炎症、凝血系统和内皮保护等多方面发挥作用,进一步深入研究中医药防治COVID-19 凝血异常的药理机制,将有助于提高COVID-19 及凝血异常的临床疗效并加速中医药的发展和推广。
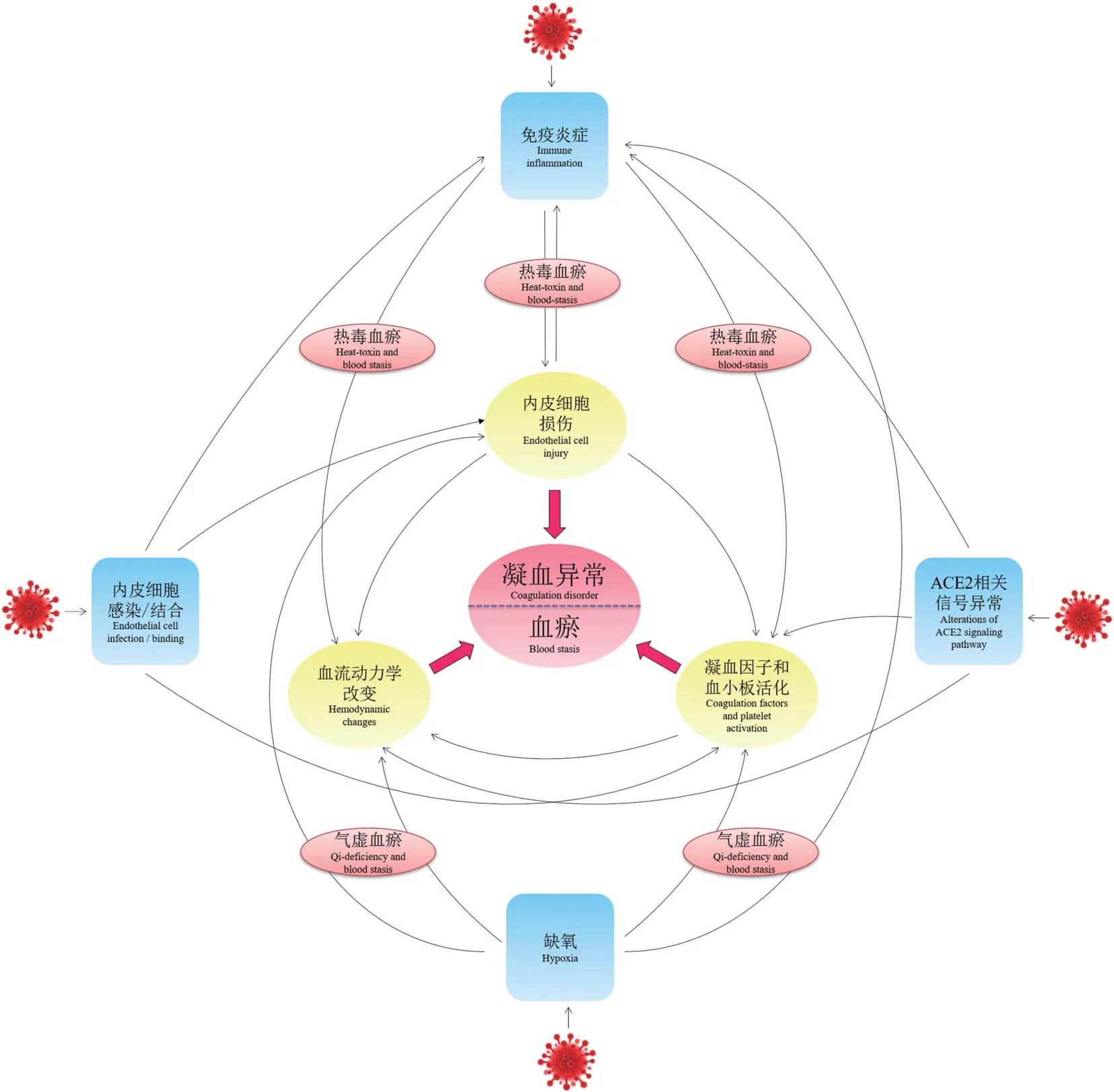
图1 COVID-19 凝血异常机制Figure 1 Mechanism of coagulation dysfunction in COVID-19
