沉默TRPM2-AS对耐奥沙利铂的结直肠癌细胞增殖和凋亡的影响及机制研究*
2022-02-19吴丹心杜金凤
王 丹,吴丹心,杜金凤
(湖北省十堰市太和医院肿瘤科 442000)
结直肠癌发病率和病死率呈增长趋势,在全部恶性肿瘤中分别位居第3位和第5位[1]。 化疗是结直肠癌的常用治疗方法,但目前结直肠癌细胞易对化疗药物如奥沙利铂(L-OHP)产生耐药性,常导致化疗失败[2]。因此,探究影响结直肠癌耐药性的分子机制对逆转结直肠癌细胞耐药性进而提高治疗疗效、改善患者预后具有重大意义。瞬时受体电位通道M2反义RNA(TRPM2-AS)是一种长链非编码RNA(lncRNA),其在结直肠癌细胞中表达上调,可通过与TAF15直接相互作用增强结直肠癌细胞的增殖能力[3],但其对耐L-OHP的结直肠癌细胞恶性表型的影响及机制尚未可知。Starbase靶基因在线预测软件显示,TRPM2-AS可能靶向结合miR-22-3p。上调miR-22-3p可明显阻碍结直肠癌细胞增殖,且促进细胞凋亡[4]。本研究通过构建耐L-OHP的结直肠癌细胞HCT-8/L-OHP,旨在观察TRPM2-AS对HCT-8/L-OHP增殖和凋亡的影响及其能否靶向miR-22-3p发挥作用,以期为逆转结直肠癌对L-OHP的耐药性提供新的分子靶点。
1 材料与方法
1.1 主要试剂和仪器
结直肠癌细胞系HCT-8购自中国科学院上海细胞库;RNA抽提试剂盒、逆转录试剂盒和PCR试剂盒购自大连宝生物工程有限公司;LipofectamineTM2000试剂盒购自美国Invitrogen公司;RPMI 1640培养液、细胞计数试剂盒-8(CCK-8)、Annexin V-FITC/PI细胞凋亡试剂盒和双荧光素酶活性检测试剂盒购自北京索莱宝科技有限公司;胎牛血清(FBS)购自浙江天杭生物科技股份有限公司;PCR引物、TRPM2-AS小干扰RNA(si-TRPM2-AS)、乱序无意义阴性序列(si-NC)、miR-22-3p 模拟物(mimics)、模拟对照序列(miR-NC)、miR-22-3p抑制剂(anti-miR-22-3p)由上海吉玛制药技术有限公司合成;兔抗人活化的半胱天冬酶-3(cleaved-caspases-3)、甘油醛-3-磷酸脱氢酶(GAPDH)抗体购自美国Santa Cruz公司。
1.2 方法
1.2.1构建HCT-8/L-OHP细胞
参照文献[5]方法,复苏HCT-8细胞,用含10% FBS的RPMI 1640培养液置于培养箱中培养。将对数期HCT-8细胞接种至6孔板中,1.0×105/孔,用含2 μmol/L L-OHP培养液培养48 h,弃培养液,常规培养液培养12 h,传代。再次用含2 μmol/L L-OHP培养液培养48 h,弃培养液,常规培养液培养12 h,传代。重复上述步骤,1个浓度反复3~4次,逐步将L-OHP浓度提高至20 μmol/L,最终获得能耐受20 μmol/L L-OHP的细胞株,并将其维持培养在含10 μmol/L L-OHP的完全培养液中,得到能够在含10 μmol/L L-OHP的完全培养液中稳定生长的人结直肠癌耐药细胞株HCT-8/L-OHP。
1.2.2RT-qPCR法检测TRPM2-AS和miR-22-3p表达
将HCT-8和HCT-8/L-OHP细胞接种至6孔板中,1.0×105/孔,于培养箱中培养24 h后,弃培养液,磷酸盐缓冲液清洗细胞2次,RNA抽提试剂提取细胞中总RNA。经逆转录生成cDNA后,行PCR扩增。扩增程序:95 ℃ 5 min;95 ℃ 10 s,60 ℃ 30 s,72 ℃ 30 s,共35个循环。引物序列:TRPM2-AS上游引物5′-CGTGACCAGGTTCAGACACA-3′,下游引物5′-TGGGCAGTTTGGTTCTGGTT-3′;GAPDH上游引物5′-TGTTCGTCATGGGTGTGAAC-3′,下游引物5′-ATGGCATGGACTGTGGTCAT-3′;miR-22-3p上游引物5′-AAGCTGCCAGTTGAA GAACTGTA-3′,下游引物5′-GCTGTCAACGATA CGCTACGTAAC-3′;U6上游引物5′-CTCGCTTCGGCAGCACA-3′,下游引物5′-AACG CTTCACGAATTTGCGT-3′。分别以GAPDH、U6为内参,2-ΔΔCt法计算细胞中TRPM2-AS、miR-22-3p相对表达量。
1.2.3HCT-8/L-OHP细胞转染
将HCT-8/L-OHP细胞接种至6孔板中,1.0×105/孔。培养12 h后,采用LipofectamineTM2000脂质体法,分别转染si-NC(si-NC组)、si-TRPM2-AS(si-TRPM2-AS组)、miR-NC(miR-NC组)、miR-22-3p mimics(miR-22-3p组)、anti-miR-22-3p(anti-miR-22-3p组)、共转染si-TRPM2-AS与anti-miR-22-3p(si-TRPM2-AS+anti-miR-22-3p组)。转染24 h后,换为含10% FBS的RPMI 1640培养液。再培养24 h后,RT-qPCR法检测细胞中TRPM2-AS或miR-22-3p表达验证转染效果,方法同1.2.2,并收集细胞备用。同时设置对照组(con组),细胞不进行任何转染操作,常规培养液培养。
1.2.4CCK-8法检测细胞增殖
将各组细胞接种至96孔板中,2.5×104/孔,分别培养24 h、48 h和72 h后,在各孔中加10 μL CCK-8。孵育2 h后,酶标仪(λ=450 nm)检测光密度(OD)值。
1.2.5克隆形成实验
将各组细胞接种至6孔板中,1.0×104/孔,每2天更换1次新鲜培养液。培养14 d后弃培养液。4%多聚甲醛固定30 min,结晶紫染色15 min。PBS清洗,显微镜观察,统计超过50个细胞的克隆。
1.2.6流式细胞术检测细胞凋亡
将各组细胞接种至6孔板中,1.0×105/孔,培养48 h后,收集细胞。将各组细胞PBS清洗2次,1 000 r/min离心5 min后,弃上清液。加500 μL Binding Buffer重悬细胞,加10 μL Annexin V-FITC,室温避光孵育10 min。再加5 μL PI,混合均匀,室温避光孵育5 min后,流式细胞仪检测各组细胞凋亡情况。
1.2.7Western blot检测细胞中cleaved-caspase3蛋白表达
将各组细胞接种至6孔板中,1.0×105/孔,培养48 h后,收集细胞,用RIPA裂解液提取细胞中总蛋白。经BCA法检测蛋白含量后,对其定量。然后行10% SDS-PAGE电泳,经转膜、封闭后,分别用cleaved-caspase3(1∶1 000)、GAPDH(1∶1 000)一抗孵育液在4 ℃冰箱中孵育过夜。洗膜后,再用山羊抗兔二抗在37 ℃摇床中孵育1 h。再次洗膜后,加化学发光试剂,避光显影后,用凝胶成像系统曝光拍照,Image J软件分析cleaved-caspase3相对于GAPDH的表达量。
1.2.8双荧光素酶报告基因实验
利用Starbase网站对TRPM2-AS和miR-22-3p的结合位点进行预测,同时利用基因定点突变技术将其结合位点突变,分别构建含有结合位点、突变位点的野生型荧光素酶报告基因载体 (Wt-TRPM2-AS)与突变型载体(Mut-TRPM2-AS),该过程由上海吉玛制药技术有限公司完成。将HCT-8/L-OHP细胞接种至6孔板中(1.0×105个/孔),采用LipofectamineTM2000脂质体法,分别共转染miR-22-3p mimics与Wt-TRPM2-AS、miR-NC与Wt-TRPM2-AS,转染12 h后,换为含10 % FBS的RPMI 1640培养液。再培养24 h,收集细胞并裂解。经3 500 r/min离心5 min后,取上清液,检测荧光素酶活性,结果以萤火虫荧光强度与海肾荧光强度的比值表示。
1.3 统计学处理
2 结 果
2.1 HCT-8/L-OHP细胞中TRPM2-AS和miR-22-3p表达
HCT-8/L-OHP细胞中TRPM2-AS表达明显高于HCT-8细胞(P<0.05),而miR-22-3p表达明显低于HCT-8细胞(P<0.05)。
2.2 沉默TRPM2-AS对HCT-8/L-OHP细胞增殖和凋亡的影响
si-TRPM2-AS组细胞中TRPM2-AS表达明显低于si-NC组及con组(P<0.05),沉默TRPM2-AS的HCT-8/L-OHP细胞构建成功。con组、si-NC组和si-TRPM2-AS组细胞中miR-22-3p表达、OD48 h/72 h值、克隆形成数、细胞凋亡率及cleaved-caspase3蛋白表达比较差异均有统计学意义(P<0.05)。与con组和si-NC组比较,si-TRPM2-AS组细胞中OD48 h/72 h值、克隆形成数降低(P<0.05),而miR-22-3p表达、细胞凋亡率、cleaved-caspase3蛋白表达升高(P<0.05),见图1。
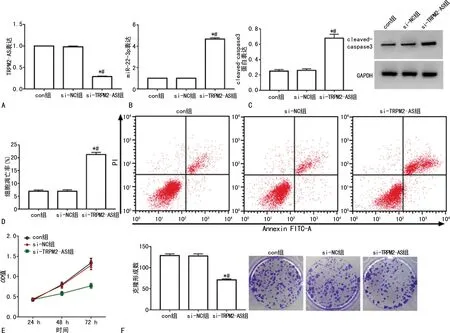
A:si-TRPM2-AS转染效果验证;B:各组细胞miR-22-3p表达;C:各组细胞cleaved-caspase3蛋白表达;D:各组细胞凋亡情况;E:各组细胞增殖活性;F:各组细胞克隆形成情况;*:P<0.05,与con组比较;#:P<0.05,与si-NC组比较。图1 沉默TRPM2-AS后HCT-8/L-OHP细胞增殖和凋亡情况
2.3 过表达miR-22-3p对HCT-8/L-OHP细胞增殖和凋亡的影响
miR-22-3p组细胞中miR-22-3p表达明显高于miR-NC组及con组(P<0.05),过表达miR-22-3p的HCT-8/L-OHP细胞构建成功。con组、miR-NC组和miR-22-3p组细胞OD48 h/72 h值、克隆形成数、细胞凋亡率及cleaved-caspase3蛋白表达比较差异有统计学意义(P<0.05)。与con组和miR-NC组比较,miR-22-3p组细胞OD48 h/72 h值和克隆形成数降低(P<0.05),而细胞凋亡率及cleaved-caspase3蛋白表达升高(P<0.05),见图2。

A:miR-22-3p mimics转染效果验证;B:各组细胞增殖活性;C:各组cleaved-caspase3蛋白表达;D:各组细胞凋亡情况;E:各组细胞克隆形成情况;*:P<0.05,与con组比较;#:P<0.05,与miR-NC组比较。图2 过表达miR-22-3p对HCT-8/L-OHP细胞增殖和凋亡的影响
2.4 TRPM2-AS和miR-22-3p靶向关系验证
Starbase靶基因在线预测软件显示,TRPM2-AS和miR-22-3p的核苷酸序列存在连续结合位点,见图3A。双荧光素酶报告基因实验结果显示,miR-22-3p与Wt-TRPM2-AS共转染后HCT-8/L-OHP细胞荧光素酶活性明显降低(P<0.05),而与Mut-TRPM2-AS共转染后HCT-8/L-OHP细胞荧光素酶活性无明显变化(P>0.05),TRPM2-AS可与miR-22-3p靶向结合,见图3B。

A:TRPM2-AS和miR-22-3p的互补序列;B:荧光素酶活性检测结果。图3 TRPM2-AS靶向结合miR-22-3p
2.5 抑制miR-22-3p逆转沉默TRPM2-AS对HCT-8/L-OHP细胞增殖和凋亡的影响
anti-miR-22-3p组细胞中miR-22-3p表达明显低于con组(P<0.05),抑制miR-22-3p表达的HCT-8/L-OHP细胞构建成功。与con组比较,anti-miR-22-3p组细胞OD48 h/72 h值和克隆形成数升高(P<0.05),而细胞凋亡率及cleaved-caspase3蛋白表达降低(P<0.05)。与si-TRPM2-AS组比较,si-TRPM2-AS+anti-miR-22-3p组细胞OD48 h/72 h值和克隆形成数升高(P<0.05),而细胞凋亡率及cleaved-caspase3蛋白表达降低(P<0.05),见图4。
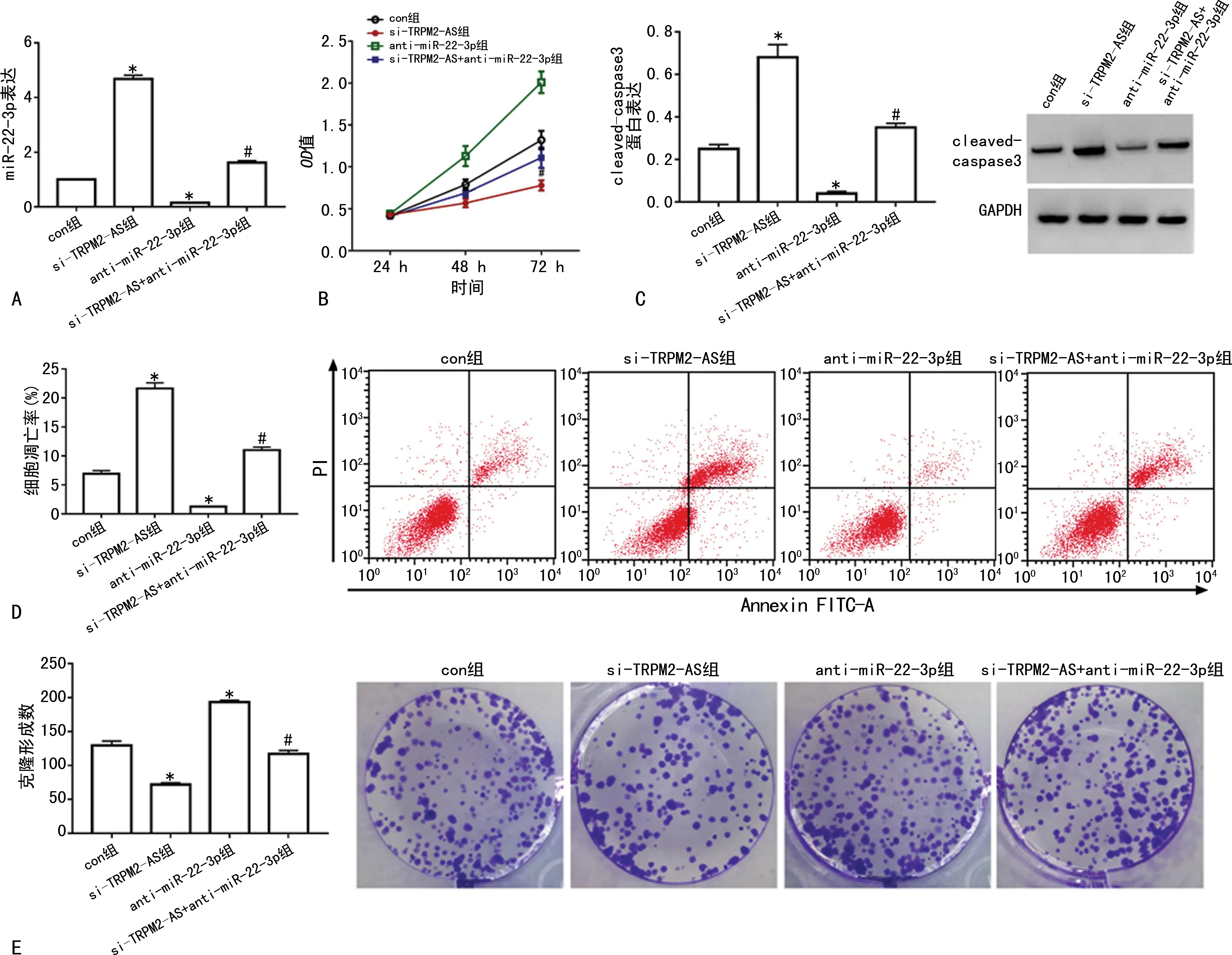
A:anti-miR-22-3p转染效果验证;B:各组细胞增殖活性;C:各组cleaved-caspase3蛋白表达;D:各组细胞凋亡情况;E:各组细胞克隆形成情况;*:P<0.05,与con组比较;#:P<0.05,与si-TRPM2-AS组比较。图4 抑制miR-22-3p逆转沉默TRPM2-AS对HCT-8/L-OHP细胞增殖和凋亡的影响
3 讨 论
化疗是结直肠癌临床治疗的常用方法,但由于肿瘤细胞耐药性的产生降低了化疗疗效,最终导致化疗失败。L-OHP是结直肠癌化疗的一线药物,降低结直肠癌细胞对L-OHP的化疗抗性对改善患者预后具有重要意义。lncRNA在真核生物中广泛存在,参与调控肿瘤细胞化疗抗性。研究表明,lncRNA MIR600HG、lncRNA PVT1-214等多种lncRNA参与调控结直肠癌细胞L-OHP耐药性,为逆转结直肠癌细胞L-OHP耐药性提供了分子靶点[6-7]。
瞬时受体电位通道M2(TRPM2)是瞬时受体电位通道M型的一个亚型,在神经细胞、心肌细胞、免疫细胞等细胞中广泛表达。研究显示,TRPM2是细胞内氧化应激感受器,参与调控活性氧生成、炎症因子的产生及巨噬细胞功能[8]。TRPM2-AS是TRPM2的反义RNA,属于lncRNA家族成员,其对肿瘤的发展进程具有重要调控作用。研究显示,TRPM2-AS可促进胃癌[9]、肝癌[10]、神经胶质瘤[11]、乳腺癌[12]、非小细胞肺癌[13]等肿瘤细胞的恶性表型,进而促进肿瘤的发展进程。此外,TRPM2-AS在肺癌顺铂耐药细胞A549/DDP中表达升高,敲低其表达可增强A549/DDP细胞对顺铂敏感性,并诱导细胞凋亡,为肺癌提供了新的治疗靶点[14]。然而,还未见TRPM2-AS影响结直肠癌细胞对L-OHP耐药性的相关报道。
本研究主要探究了TRPM2-AS对耐L-OHP的结直肠癌细胞增殖和凋亡的影响,结果显示,TRPM2-AS在耐L-OHP的结直肠癌细胞中呈高表达,沉默其表达阻碍了耐L-OHP的结直肠癌细胞的增殖能力,同时加剧其细胞凋亡,提示TRPM2-AS可作为逆转结直肠癌对L-OHP耐药性的分子靶点。caspase级联反应在细胞凋亡中发挥重要调控作用,其中caspase3是caspase级联反应的关键调控分子,其在受到上游凋亡信号刺激后被活化,生成cleaved-caspase3,进而执行细胞凋亡[15-16]。本研究结果显示,沉默TRPM2-AS促进了耐L-OHP的结直肠癌细胞中cleaved-caspase3蛋白表达,提示TRPM2-AS可能通过直接或间接调控caspase级联反应来影响耐L-OHP结直肠癌细胞凋亡。
为进一步探究TRPM2-AS影响耐L-OHP结直肠癌细胞增殖和凋亡的分子机制,本研究证实了TRPM2-AS可靶向结合miR-22-3p,且沉默TRPM2-AS促进细胞中miR-22-3p表达,说明TRPM2-AS靶向负调控miR-22-3p。研究显示,miR-22-3p可分别通过抑制YWHAZ、NFIB和YAP1的表达来减弱结直肠癌、胃癌、非小细胞肺癌细胞的恶性表型,对肿瘤发展起抑制作用[17-19];miR-22-3p在耐L-OHP的胃癌组织和细胞系中均呈低表达,上调miR-22-3p可降低胃癌细胞L-OHP的耐药性,miR-22-3p可作为逆转胃癌对L-OHP耐药性的分子靶点[20]。本研究结果显示,耐L-OHP结直肠癌细胞中miR-22-3p表达降低,过表达miR-22-3p降低了细胞的增殖能力,并加剧了其凋亡,而抑制miR-22-3p具有相反作用,这提示miR-22-3p也参与调控结直肠癌细胞对L-OHP的耐药性,其也可能成为逆转结直肠癌对L-OHP耐药性的分子靶点。本研究还显示,抑制miR-22-3p逆转了沉默TRPM2-AS对L-OHP结直肠癌细胞增殖和凋亡的影响,进一步提示TRPM2-AS可能通过靶向负调控miR-22-3p来调控耐L-OHP结直肠癌细胞增殖和凋亡。
综上所述,TRPM2-AS在耐L-OHP的结直肠癌细胞中表达升高,而miR-22-3p表达降低;沉默TRPM2-AS可阻碍耐L-OHP的结直肠癌细胞增殖,并促进细胞凋亡,其作用机制可能与靶向结合并负调控miR-22-3p有关,TRPM2-AS/miR-22-3p轴可能为逆转结直肠癌对L-OHP的耐药性提供了分子靶点。但本研究尚存在不足之处,尚需对miR-22-3p下游靶基因及信号通路进行探究,且需要进一步在体内验证TRPM2-AS/miR-22-3p轴对结直肠癌L-OHP耐药性的影响。
