生发中心B细胞应答异常引起的自身免疫性疾病研究进展
2022-02-18陈雅雯蔡少丽
陈雅雯,蔡少丽
(福建师范大学南方生物医学研究中心 福建省天然免疫生物学重点实验室,福建 福州 350117)
生发中心(germinal center,GC)是抗原(antigen,Ag)激活的B细胞进行克隆扩增、免疫球蛋白基因超突变和亲和力选择的主要位点,是在T细胞依赖性抗体应答过程中于外周淋巴组织内形成的一个促使B淋巴细胞产生特异性抗体的特殊结构。GC主要由B细胞组成,其中也有部分抗原特异性T细胞,为B细胞分化提供辅助。GC B细胞的选择包括: B 细胞进一步克隆扩增、免疫球蛋白(immunoglobulin,Ig)基因可变区的体细胞高频突变(somatic hypermutation,SHM)、高亲和力B细胞克隆的阳性选择以及无关或自身反应性B细胞克隆的阴性选择[1],Ig类型转换以及分化为可分泌特异性抗体的记忆B细胞和浆细胞,从而参与体液免疫的过程。这些选择受转录因子、表观遗传修饰因子和信号通路的复杂网络调控,且信号通路与GC B细胞转运机制起协同作用[2]。调节B淋巴细胞成熟和稳定的基本机制——凋亡在生发中心B细胞的生长分化中极为重要,当凋亡调控系统出现异常,存活下来的自身反应性B细胞会产生无法被自然清除的自身反应性抗体,进而与自身抗原反应引起自身免疫性疾病,进一步导致免疫系统的异常。
1 生发中心B细胞的应答过程
在外周淋巴组织的T细胞区,抗原提呈细胞(antigen presenting cell,APC)/并指状细胞(interdigitating dendritic cell,IDC)将摄取的抗原(antigen,Ag)加工后,通过主要组织相容性复合物(major histocompatibility complex,MHC)Ⅱ类分子将Ag提呈给T细胞,通过CD80-CD28膜分子将共刺激信号传导给T细胞使其活化。活化T细胞成功识别B细胞受体(B-cell receptor,BCR)提呈的加工后Ag,通过CD40-CD40L传导B细胞活化信号。活化后的B细胞能与活化T细胞一起进入初级淋巴滤泡中起始生发中心反应[3],也能在滤泡间区继续增殖进而终末分化为产生IgM和IgG两种较低亲和力抗体(antibodys,Abs)的短期浆细胞。
进入初级淋巴滤泡中的再循环B细胞在大量滤泡树突状细胞形成的网络系统中穿行,在生发中心的暗区(dark zone,DZ)迅速增殖,分化为中心母细胞(centroblasts,CBs)并发生IgV区基因体细胞高频突变(SHM)[4],在FDC提供的生长因子作用下,凋亡受抑制。随着时间的推移,形成数量巨大、具有不同亲和力BCR的B细胞克隆,即中央细胞(centrocytes,CCs),它们向GC的亮区(light zone,LZ)迁移,先后与在亲和力选择过程中介导关键作用[5]的FDC和T滤泡辅助细胞(T follicular helper,Tfh)[6]进行Ag识别和结合,完成亲和力成熟和Ig同类型转换。接收Tfh信号的表达高亲和力Abs CCs能进一步增殖分化为长寿命存储单元记忆B细胞和抗体分泌型浆细胞[7],也能回到DZ启动新一轮的GC应答[8](图1)。
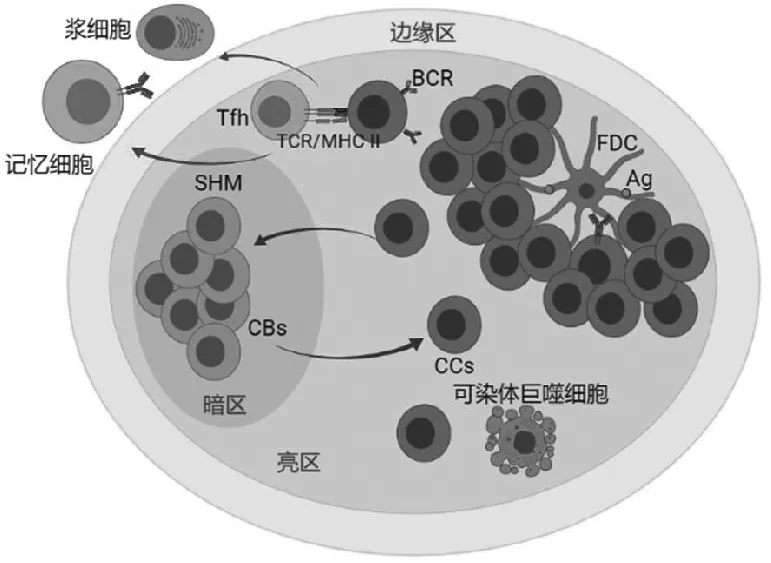
图1 生发中心B细胞的应答过程
经过SHM,CCs会形成高亲和力、低亲和力以及自身反应性突变株。高亲和力B细胞与FDC结合后能免于被溶酶体破裂而发生凋亡,其余B细胞因无法与FDC作用而发生凋亡,继而被可染体巨噬细胞(tingible body macrophages,TBMs)清除[9]。GC独特的生理功能就是使功能性B细胞存活,使无关或自身反应性B细胞凋亡,以维持B淋巴细胞的动态稳定,防止因自身反应性B细胞的存活而引起自身免疫性疾病的情况发生。
2 靶向异常的应答治疗自身免疫性疾病
自身免疫性疾病(autoimmune Disease,AID)反映了免疫耐受的崩溃[10]。正常情况下的免疫反应对自身组织不产生攻击反应[11],但是如果自身抗体过量产生或异常就有可能会对机体产生伤害,导致自身免疫性疾病的发生。
生发中心B细胞的应答会产生数量多、特异性强的各种B细胞克隆,该过程能起到维持B细胞动态稳定的作用。当GC B细胞应答异常时,可能会使自身反应性B细胞免于凋亡而存活,进而产生自身抗体,引起自身免疫性疾病。Fas-FasL和CD40-CD40L参与调控GC B细胞凋亡的过程,在维持GC稳态、防止自身反应性B细胞的存活上起重要作用。探究靶向Fas-FasL和CD40-CD40L调控过程异常的方法,对防止GC B细胞应答异常以及预防和治疗因其引起的包括关节炎在内的自身免疫性疾病具有参考价值。
2.1 Fas/FasL 在关节炎症中的治疗潜力
Fas(CD95 )是含有死亡结构域的肿瘤坏死因子受体超家族(tumor necrosis factor receptor superfamily,TNFRSF)中的一员,能生理性调控凋亡及在免疫系统疾病和淋巴瘤中起重要作用[12]。FasL(CD95L)是生发中心中T细胞分泌的细胞因子之一,同属于肿瘤坏死因子超家族,T细胞可通过它诱导GC B细胞发生凋亡。Fas-FasL系统是外源性凋亡途径的触发因素[13],该系统异常将会导致正常的凋亡受抑制[14]。Fas和FasL结合后激活死亡受体,死亡受体和FasL相关死亡结构域(Fas-associated death domain,FADD)互相作用后能募集连接体蛋白,随后连接体蛋白上的死亡效应结构域与凋亡起始酶procaspase-8上的死亡结构域结合,从而形成能使蛋白酶水解并把procaspase-8活化为caspase-8的死亡诱导信号复合物(death inducing signalling complex,DISC),触发下游效应的caspase-3活化来诱导凋亡发生。
生发中心B细胞在随机性的体细胞高频突变后不可避免地会产生自身反应性B细胞,若这些细胞逃脱耐受机制,将会形成自身反应性浆细胞和记忆细胞,产生自身反应性抗体,导致自身免疫性疾病的发生。研究发现,Fas缺陷型小鼠身患自身免疫性综合征是因其不能清除自身反应性B细胞,由此可得,Fas/FasL基因缺陷,可能会导致GC B细胞的阴性选择发生异常。另一研究[15]表明,去除自身反应性GC B细胞不是必须要依靠Fas的表达,但Fas的表达是防止非抗原依赖性的自身反应性B细胞发展和持续存在,继而分化为浆细胞导致免疫系统出现异常,是引起自身免疫性疾病发生的必要条件。Fas-Fas 配体(FasL)途径在维持对自身抗原的免疫耐受中起关键作用。可溶性FasL(sFasL)是膜结合F a s L(m F a s L)被基质金属蛋白酶(m a t r i x metalloproteinase,MMP)水解切割产生的,mFasL对于触发Fas诱导的凋亡至关重要[16],而sFasL调节非凋亡过程,但以剂量依赖性方式刺激类风湿性关节炎(Rheumatoid arthritis,RA)患者成纤维样滑膜细胞(fibroblast-like synovial cells,FLSCs)中的凋亡[17]。有研究[18]表明,肿瘤坏死因子受体超家族(TNFRSF)10B(死亡受体DR5)是促进炎症的mFasL和sFasL非Fas依赖性膜结合受体,FasL-DR5和Fas-FasL相互作用诱导细胞凋亡和坏死,而sFasL-DR5相互作用可能依赖于NF-κB信号通路,通过CX3X1-CX3CR1增加关节炎症。但当施用FasL或CX3CR1的抗体阻断其作用,则减弱了小鼠自身抗体诱发的关节炎(autoantibody-induced arthritis,AIA),说明sFasL-DR5相互作用和CX3CL1-CX3CR1可能是控制炎症的治疗靶点。加之sTRAIL可竞争性结合DR5,且sFasL-DR5和sTRAIL-DR5相互作用可诱导FLSCs凋亡,研究DR5与FasL、sFasL、sTRAIL的结合作用大小及先后顺序和具体的作用机制,弄清其作用时期是在FLSCs的诱导期还是效应期能更好地确定治疗靶点,研发靶向药物,可能可以规避以往使用的非甾体类控制炎症药物具有的引起脏器功能损坏的风险[19,20]。
目前市面上没有治疗RA的特效药,吴宁的研究[21]证实天然重要苗药“四大血”(SX)中的活性成分能有效结合包括Fas和FasL在内的调控凋亡的分子,能在毒副作用小的前提下较好地起到抑制FLSCs增生、缓解关节炎症的作用,但其作用的具体机制仍不清楚,因此还未应用于临床。
通过Fas-FasL途径研究分子抑制剂来控制炎症的发展以达到延缓和治疗自身免疫性疾病的效果,然而进一步研究该途径的作用机制会发现在调控非抗原依赖性自身反应性B细胞凋亡上,Fas的表达才是更为主要的。这些B细胞不仅能逃脱免疫耐受存活下来,还能直接分化为浆细胞,产生自身抗体(多为IgG)引起自身免疫性疾病。不仅如此,在发展后期,IgG抗体可转变为IgE抗体,可能还会引起过敏性疾病,促进系统系红斑狼疮(systemic lupus erythematosus,SLE)的发展。
深入探究Fas在防止非抗原依赖性自身反应性B细胞存活和增殖的表达机制,是否与在某些情况下能抑制GC反应的T滤泡调节细胞相关,控制施加Fas或作用机理相同的分子激活剂来确定治疗靶点,在治疗关节炎症等自身免疫性疾病及预防过敏性疾病的发生中具有一定的参考价值。
2.2 靶向阻断CD40/CD40L防止炎症发生
生发中心要具有功能性,必须得在生发中心T细胞的协助下才能产生IgM、IgG、IgA和IgE抗体,同样为T细胞分泌细胞因子之一的CD40L[22]可参与调控抗体产生种类的过程。与Fas-FasL在GC的作用相反,CD40L是阻止B细胞凋亡的分子,其依赖生发中心T细胞来识别滤泡树突状细胞呈递的抗原,通过CD40配体[23]来激发CD40分子,使B细胞得以继续存活[24,25]。CD40信号分子可通过转录因子NF-κB介导表达靶基因FADD样白细胞介素-1β(interleukin-1β,IL-1β)转化酶抑制蛋白(Fas-associated death domain like interleukin-1 betaconvert ingenzyma inhibitory protein,FLIP)来维持FLIP的稳态,抑制caspase-8激活,使DISC失活,即下调Fas作用以使B细胞与FDC的结合作用增强来起到抗凋亡的作用[26]。CD40-CD40L通路是免疫系统细胞之间通讯的支柱[27],CD40的表达是GC形成和功能所必需的[28],在生发中心B细胞分化的早期阶段,若没有CD40L的刺激,GC B细胞将会自发凋亡[29]。膜分子CD40与CD40L的结合能促进阳性选择抗原特异性B细胞,也能起到稳定溶酶体的作用,防止溶酶体酶对GC B细胞的破坏。
以前对于K/BxN小鼠的研究表明,关节炎的发展取决于B细胞CD40的表达。在对治疗自发性关节炎小鼠实验的研究[30]发现,在关节炎发病前进行抗CD40L抗体治疗,能明显降低关节炎的发展,表明抗CD40L抗体可以预防或延迟关节炎的发展。这因为关节炎是由特异性靶标GPI(glucose-6-phosphate isomerase)的抗体引起的,所以可以通过阻断CD40信号来防止致病性抗葡萄糖-6-磷酸异构酶(GPI)抗体的形成,但抗CD40L抗体并不能治疗已经形成的关节炎。抗CD40L的单抗能与抗体IgM共同刺激使B细胞大量扩增,CD40L阻断可能通过促进其外周缺失阻止了新的自身反应性B细胞的出现[31],所以该治疗方式只适用于延缓炎症及病情发展。通过抑制自身抗体新形成,或通过与有效的抗炎剂联合使用,可对关节炎疾病产生长期抑制作用。此研究实验的小鼠疾病模型类似于人类的类风湿性关节炎(rheumatoid arthritis,RA),对RA的预防与阻断炎症进程的治疗具有参考价值。
CD40-CD40L 是B细胞活化的关键共刺激途径,是一个有吸引力的免疫治疗靶点[47],其阻断可抑制自身免疫性疾病中的致病性B细胞反应。研究[32]表明KPL-404(一种人源化的IgG4抗CD40单克隆抗体)能靶向结合CD40,达到抑制干燥综合征(sjogren's syndrome,SjS)和系统性红斑狼疮(SLE)中B细胞反应的治疗效果。该研究通过成像流式细胞术检测对比KPL-404对来自健康供体(healthy donor,HD)以及自身免疫疾病患者的外周血单个核细胞(peripheral blood mononuclear cell,PBMC)的体外作用。用抗CD3/CD28交联剂免疫刺激细胞,诱导CD40-CD40L介导的B细胞反应,将检测的抗CD40 Ab细胞内化与G28-5[33](一种部分拮抗性抗CD40抗体)的作用进行比较。结果表明,KPL-404在体外不仅能与不同亚群B细胞上的CD40高亲和结合,而且不产生任何激动活性,比G28-5的抗性特异性强且只需要1-10 μg/mL就能有效阻断CD40-CD40L介导的HD的B细胞活化。
单独用KPL-404处理不会促进细胞因子产生并能抑制某些炎症细胞因子的产生,而且不影响它们抗IgM反应或细胞因子产生,结果显示出对B细胞和总PBMC的纯拮抗作用。KPL-404能抑制健康对照和自身免疫性患者PBMC培养物中CD40-CD40L介导的B细胞活化,可阻断致病性B细胞反应,在有效防止自身免疫性疾病发生的研究上做出了贡献。但施用KPL-404是否能在抑制自身反应性B细胞产生的同时增强其凋亡,或与其他分子抑制剂交联使用是否能到达更好的效果,以便后期应用于临床试验,这是值得进一步研究的问题。
CD154(CD40 配体,TNFSF5)是一种可以传递共刺激信号的T细胞分子,CD40-CD154的上调表达发生在不同自身免疫性疾病的免疫效应细胞和非免疫细胞中,其复杂的免疫反应会促进关节炎症和骨损伤。在胶原诱导性关节炎(collagen induced arthritis,CIA)动物中。阻断CD40-CD154的相互作用可观察到治疗效果。以前的治疗方式是用合成消炎药来抑制炎症反应、控制疾病进展并预防自身免疫性关节炎患者的关节损伤[34],但因其是非特异性药物,有一群关节炎患者对这些治疗并没有反应,依然遭受持续和不可逆的关节破坏。通过实验研究[35]可得,抑制CD40-CD154可减弱CD154介导的T细胞共刺激,并抑制CD40介导的对B细胞和抗原呈递细胞的激活信号,达到抑制致病性B细胞形成的效果。T细胞激活在自身免疫性关节炎的发病机制中起主要作用,有效抑制T细胞的激活是免疫调节治疗非常重要和有效的途径[36,37],CD40-CD154作为治疗自身免疫性关节炎的潜在靶点,对后期的药物研发具有重要意义。
目前,已经开发了几种靶向CD40-CD154的生物产品,正在进行相关临床试验。Tn3(一种小蛋白质支架)是其中一种能与CD154特异性结合的药物,被命名为VIB4920。通过临床前分析结果可得出VIB4920能有效抑制B细胞的活化和分化,且在体外不引起血小板聚集。使用VIB4920治疗显著降低了类风湿性关节炎疾病活动度,超过50%接受两次更高剂量治疗的患者在第12周达到了低疾病活动度或临床缓解[38]。患者对该药物表现出良好的耐受性,并且在整个试验过程中没有具体的安全性问题。虽然该阻断剂的治疗效果显著,但其疗效和安全性的临床评估只涉及有限的患者数量,考虑到在检查阻断CD40-CD154信号通路治疗自身免疫性疾病的长期安全性方面,还需要更多的临床验证。
Fas-FasL 与CD40-CD40L都能通过NF-κB信号通路来发挥作用。基于这两个分子的作用在研发治疗关节炎症等自身免疫性疾病的过程中,应考虑药物分子在NF-κB信号通路中是否会导致其他细胞因子的激活或炎症分子的产生。若同时使用Fas激活剂和CD40阻断剂,是否能使治疗效果及可长期使用性达到最优值。除此之外,参与亲和力成熟选择的FDC和影响Ag摄取能力的Lis1因子的作用在预防自身免疫性疾病发生的过程中也具有值得探讨的价值。
3 结语与展望
生发中心反应支持了强大的抗体反应[39],当此过程出现差错,如自身反应性B细胞克隆的存活、产生自身抗体后与自身抗原结合起免疫反应,会导致自身免疫性疾病的产生。研究[40]发现GC DZ的B细胞群可分为暗区增殖(dark zone proliferation,DZp)群和暗区分化(dark zone differentiation,DZd)群,DZp可协助去除凋亡细胞及有丝分裂前未被阳性选择的LZ B细胞,可作为一个免疫检查点,在适宜药物或分子的靶向疗法下以维持凋亡和有丝分裂的稳定,在疫苗设计和调节自身免疫性疾病的适应性体液免疫中具有很大的参考价值。
掌握GC B细胞的应答过程及凋亡调控机制对清除自体反应性B细胞以及促进B细胞亲和力成熟至关重要。阻断刺激性免疫检查点或激活抑制性免疫检查点已被用于改善自身免疫性和炎性疾病的免疫反应,增强GC反应是疫苗开发的首要目标[39],深入了解参与GC反应的相关机制和通路以及目前对治疗免疫性疾病的抗体和药物研究进展,对研究和治疗一些自身免疫性疾病提供了依据和建议,具有深远的重大意义。
