BDNF与病理性疼痛的关系
2022-02-18林晓芳
林晓芳
(福建师范大学生命科学学院,福建 福州 350117)
病理性疼痛包括组织损伤所致的炎症性疼痛和神经损伤所致的神经病理性疼痛(neuropathic pain,NP),多为慢性疼痛[1]。炎症性疼痛与周围组织损伤或炎症相关,如关节炎疼痛[1]。神经病理性疼痛是由神经系统损伤或功能障碍引起的一种病理性疼痛,包括幻肢疼痛、乳房切除后神经性疼痛、人体免疫缺损病毒(human immunodeficiency virus,HIV)相关感觉神经病变、糖尿病神经病变、坐骨神经痛、带状疱疹后神经痛和三叉神经痛等[2]。
病理性疼痛既可以发生于外周神经系统(如初级感觉痛觉感受器),称为外周敏化,也可以发生于中枢神经系统(如背角和大脑神经元),称为中枢敏化[1]。病理性疼痛与伤害性通路的可塑性有关,在受损组织愈合后,疼痛仍会延长。通常情况下,止痛药的组合不足以实现慢性疼痛的选择性缓解,还会产生更多的副作用[3],例如,阿片类药物在短期内可有效缓解疼痛,但因疼痛不能治愈长期使用或滥用药物会带来很大的成瘾风险。因此,在探索病理性疼痛的治疗过程中发现新的药物或靶点是很重要的。
脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)是神经营养因子家族中的成员,它们主要在脑和神经组织表达,对中枢神经系统功能的发育和恢复具有重要作用[4]。近年来有研究发现,BDNF在病理性疼痛的发展和维持中起关键的作用,促进NP的发生,而在炎症性疼痛模型大鼠的中枢神经元大脑中起神经元保护作用。BDNF在这两者之间的差异性有助于对病理性疼痛的研究,发现BNDF在病理性疼痛中的作用,及其病理性疼痛的治疗靶点。
1 脑源性神经营养因子(BDNF)
BDNF 是中枢神经系统(central nervous system,CNS)功能的基本神经营养因子,最初是从猪脑中提取纯化出来,并被发现在感觉神经元的生存和分化中起支持作用。从进化的角度来看,BDNF基因的结构在哺乳动物中具有高度保守性,例如人类BDNF基因存在两个不同的3′非翻译区(3′ untranslated regions,3′UTRs),这一特点导致了BDNF的mRNA在成熟加工的过程中可以定位于不同细胞区域。另一个特点是BDNF基因由9个外显子(I-IX,VH和VIIIH)组成以及具有不同的替代剪接位点和替代启动子,因此在转录中可以形成多种转录本,从而产生不同的N端及长度的蛋白[5]。这一过程是极其复杂的和精密的,主要是受非编码RNA调控的,称为BDNF反义转录本(BDNFAS)[5]。值得注意的是,在人脑体内发现BDNFAS以类似于siRNA的作用方式直接调控BDNF mRNA 转录和蛋白质翻译,从而抑制BDNF基因的表达。
BDNF 转录翻译出的蛋白并不具有功能,它需要进一步成熟加工才能形成功能的蛋白(如图1所示),这一特点与其他的神经营养素是一样。BDNF首先形成前体BDNF(pre-pro-BDNF),pre-pro-BDNF被迅速切割成前蛋白(pro-BDNF)[6],pro-BDNF进一步切割形成成熟BDNF(mature BDNF),有一点值得我们注意的是,pro-BDNF和mature BDNF都可以聚集成囊泡并分泌到胞外,发挥不同的作用[7]。研究发现BDNF两种形式之间的平衡似乎在大脑发育的不同阶段起着至关重要的调节作用,pro-BDNF和mature BDNF都可以和肿瘤坏死因子受体家族中75NTR受体结合,从而引起多种生物效应,例如神经元的死亡、生长锥回缩、修剪轴突过程[8]。而对于pro-BDNF与75NTR受体结合能力要强于mature BDNF,虽然从蛋白质的相互作用结构上已经进行阐明[6],但是对于生物效应还是值得我们研究的。mature BDNF可以二聚体形式作用于TrkB受体[9],激活多种信号通路,例如PI3K/Akt通路[10]、NF-κB通路[11]、mTOR通路[12]等,从而调节神经系统多种生物活性,例如神经元存活、突触效率和可塑性、脊柱生长和成熟等。
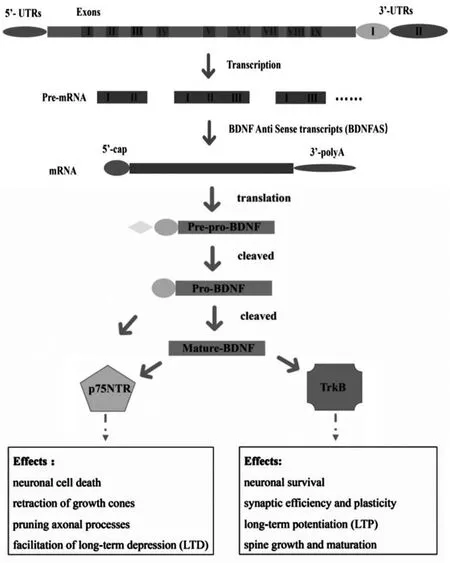
图1 BDNF的加工过程
BDNF 基因转录出pre-mRNA,经BDNFAS调控,形成成熟的mRNA,后翻译成pre-pro-BDNF,pr e-p ro-B D NF 被迅速切割成前蛋白(p r o-BDNF),pro-BDNF进一步切割形成成熟BDNF(mature BDNF)。pro-BDNF和mature BDNF作用于下游不同受体,从而调控神经系统不同的生理功能。
2 BDNF 与病理性疼痛
2.1 BDNF 在外周神经系统的作用
在坐骨神经慢性压迫性损伤(chronic constriction injury,CCI)模型中,BDNF在背根神经节(dorsal root ganglion,DRG)神经元中的表达水平显著升高,且呈时间依赖性。同时,BDNF的过表达也增加了DRG神经元嘌呤能离子通道型受体7(purinergic ligand-gated ion channel 7 receptor,P2X7受体)的表达,说明P2X7受体是由BDNF特异性诱导的。BDNF和P2X7受体在CCI DRG神经元中共表达,BDNF激活P2X7受体基因启动子,促进神经病理性疼痛,而DRG内微量注射BDNF siRNA可阻断CCI诱导BDNF的表达,减弱机械,热和冷刺激反应增强。这预示在转录上抑制P2X7受体基因可能会阻断CCI诱导的DRG BDNF的增加,从而发挥抗伤害效应[13]。
在DRG中,甲基化-CpG-结合蛋白2(Methyl-CpG-binding protein 2,MeCP2)作为激活剂对BDNF的精确调控起着重要的作用。Manners等人发现,慢性神经性疼痛(坐骨神经分支损伤模型)诱导DRG中的MeCP2上调,导致BDNF表达增加,引起疼痛。在MeCP2 158A小鼠或MeCP2基因缺失小鼠DRG中的MeCP2下调可降低BDNF的表达,机械敏感性降低,可能有助于改变疼痛敏感性[14],所以DRG中的BDNF的改变可能是导致痛觉过敏的原因之一。
近年来发现BDNF及其高亲和力功能性受体TrkB受体不仅与肿瘤恶化和神经系统发育有关,还与神经病理性疼痛的发展有密切联系。正常老鼠鞘内注射BDNF可产生和坐骨神经慢性压迫损伤(chronic constriction injury to the sciatic nerve,CCI-SN)一样程度的机械性痛觉过敏或热痛觉超敏,且均会引起DRG中TrkB受体的活化。使用环曲菌素B可阻断TrkB受体过表达,进而起到逆转CCI-SN和鞘内注射BDNF诱导的痛觉过敏的目的[15],说明BDNF在神病理性疼痛中的作用可能由TrkB受体介导的。
BDNF 引起突触后抑制是神经病理性疼痛的重要机制。BDNF对神经损伤后突触前γ-氨基丁酸(γ-Aminobutyric Acid,GABA)能有抑制作用。在机体正常的时候,脊髓突触前和突触后处于抑制状态,当神经受损时,突触前和突触后的抑制被阻断了,导致慢性疼痛的发展。据报道,神经损伤后,DRG神经元被激活后,释放BDNF与伤害特异性投射神经元上的TrkB受体结合,引起神经元钾-氯协同转运蛋白-2(Potassium-Chloride Cotransporter-2,KCC2)的下调,破坏cl-稳态,导致EGABA的去极化位移。这种转变减弱了GABAAR介导的突触后抑制。外源BDNF模拟GABAAR功能和神经病理性疼痛综合征的改变,阻断BDNF及其受体TrkB信号逆转了神经损伤后GABAAR功能的改变和伤害性阈值的降低[16]。
2.2 BDNF 在中枢系统的作用
2.2.1 脊髓
在周围神经损伤之后,脊髓背角ATP激活小胶质细胞表达的嘌呤能离子通道型受体4(purinergic ligand-gated ion channel 4 receptor,P2X4受体),导致BDNF的释放,BDNF通过TrkB受体改变神经元的兴奋性,从而诱导痛觉异常的发生。同时,ATP刺激小胶质细胞向脊髓神经元发出信号,导致其跨膜阴离子梯度改变。阻断BDNF和TrkB受体之间的信号传递可以逆转离子神经损伤和ATP刺激小胶质细胞后的痛觉过敏[17-20]。
构建脊神经结扎(spinal nerve ligation,SNL)之后,脊髓BDNF参与了SNL大鼠背角广动力域(wide dynamic range,WDR)神经元的持久超兴奋性的形成以及痛觉过敏的发生。SNL动物鞘内注射TrkB-Fc(清除内源性BDNF)后可以显著抑制SNL诱导的机械缩足阈值(paw withdrawal threshold,PWT)的下降和BDNF诱导的WDR神经元C纤维反应增加。BDNF通过Src同源2结构域的磷酸酶2(Srchomology-2 domain-containing phosphatase 2,SHP2)磷酸化激活GluN2B-NMDA受体,促进脊髓背角C纤维诱发电位长时程增强(long-term potentiation,LTP)和神经病理性疼痛的发展。用有效的SHP2蛋白酪氨酸磷酸酶抑制剂NSC-87877阻断脊髓背角SHP2磷酸化或鞘内注射siRNA抑制脊髓SHP2siRNA,不仅可以阻止DBNF介导的GluN2B-NMDA受体激活、脊髓长时程增强诱导和痛觉过敏的诱导,而且还可以减少SNL诱导的GluN2B-NMDA受体上调和脊髓LTP阻断,最终缓解SNL大鼠的痛觉过敏。这暗示BDNF通过激活GluN2B-NMDA受体在C纤维突触诱导脊髓LTP可能是脊髓背角BDNF增加在损伤后神经病理性疼痛发生中发挥作用的潜在机制[21,22]。
PSNL 也可诱导机械痛觉过敏,并伴有脊髓BDNF免疫组化含量增加。水浴和温水浸泡处理的模型动物脊髓中,BDNF免疫含量下降,促进坐骨神经的功能性感觉运动恢复[23]。小胶质细胞来源的BDNF是一种关键的小胶质细胞-神经元信号分子,他控制脊髓内异常的伤害性信息处理。在坐骨神经分支损伤(spared nerve injury,SNI)疼痛模型中,脊髓小胶质细胞被激活,Iba1、BDNF、磷酯酰肌醇-3-激酶(Phosphoinositide 3-kinase,PI3K)和磷酸化的细胞外信号调节激酶(extracellular signal regulation kinases,ERKs)的表达增加,导致神经病理性疼痛。DRG上应用PRF可抑制SNI大鼠小胶质细胞的激活,减少脊髓Iba1、BDNF、PI3K和p-ERK的释放,减轻神经病理性疼痛。增强的BDNF可诱导伤害性超敏反应,促进脊髓小胶质细胞的前馈机会,功能抑制BDNF信号逆转SNI大鼠的痛觉异常[19]。从以上疼痛模型BDNF的变化现象暗示BNDF的表达可能与病理性疼痛有着密切的联系。
BDNF 的表观遗传学修饰与病理性疼痛相关。BDNF表观遗传学修饰通过miR-30a-3p/EP300或P300/CBP来介导CCI大鼠的NP。在CCI大鼠脊髓背角中,EP300表达上升,增强对BNDF启动子上乙酰化组蛋白H3和H4,上调BDNF的表观遗传学。CCI大鼠鞘内注射miR-30a-3p抑制剂或LV-EP300可增强CCI大鼠脊髓背角中EP300和BDNF共定位,促进NP的进展。而P300/CBP的乙酰化活性对BDNF基因启动子也具有募集作用,介导BDNF的表达,引起机械痛觉过敏和机械痛觉过敏。应用姜黄素抑制P300/CBP乙酰化活性和BDNF的表达,从而减轻神经病理性疼痛。BDNF乙酰化组蛋白H3和H4水平降低,PWT和热缩足潜伏期(paw withdrawal latency,PWL)上升,NP得到缓解[24,25]。证明BDNF组蛋白乙酰化水平的上升促进神经病理性疼痛的发展。
2.2.2 大脑
BDNF 是中枢神经营养因子,在中枢神经系统内调节疼痛处理。BDNF的表观遗传修饰不仅能在脊髓层面发挥作用,也可在大脑皮层中起作用。在CCI和SNI诱导的神经病理性疼痛小鼠大脑皮层神经元中,JMJD2A(JMJD2A是一种JmjC组蛋白去甲基化酶,催化组蛋白H3中的二甲基化和三甲基化Lys9和Lys36去甲基化)的mRNA和蛋白明显升高,与BDNF启动子结合,依赖其去甲基酶活性使BDNF启动子上H3K9me3和H3K36me3去甲基化,促进BDNF的表达,从而发生神经病理性疼痛。JMJD2A在神经病理性疼痛中的上调是通过5-HT介导来增强BDNF启动子上的组蛋白去甲基化,使CCI和SNI模型小鼠出现机械超敏和热痛觉过敏[26],因此,JMJD2A通过表观遗传调控BDNF的表达促进神经病理性疼痛的超敏反应。BDNF的表观遗传修饰是与BNDF启动子上组蛋白的乙酰化、甲基化有关,可能通过其启动子上的蛋白的修饰参与病理性疼痛的发生。
3 BDNF 与炎症性疼痛
完全弗氏佐剂(complete freunds adjuvant,CFA)和肿瘤坏死因子-α(tumor necrosis factor-α,TNFα)都能诱导机械性痛觉过敏,TNF-α处理培养DRG神经元后,BDNF和TrkB受体的mRNA水平升高,48 h后BDNF和TrkB受体逐渐增加,而CFA处理的DRG神经元中,BDNF和TrkB受体蛋白是在72 h后升高[27]。这可能是转录调控只发生在早期阶段,而翻译调控持续时间更长,所以,CFA和TNF-α诱导疼痛的时间是在蛋白增加后的时间节点。
在炎症状态下,神经元P2RX4可能控制BDNF从痛觉神经中枢末端向脊髓背角释放,介导疼痛产生。当大鼠外周注射CFA时,DRG神经元表达P2RX4,诱导BDNF表达上升,从而促进慢性炎症性疼痛时的高兴奋性。在脊髓背角,P2RX4基因缺陷小鼠脊髓背角中,BDNF依赖的信号通路下调都受到了损害,疼痛减缓[28]。
CFA 诱发的炎性痛模型大鼠中,海马体的小胶质细胞被激活,增加pro-BDNF/BDNF的比值,疼痛加剧,而二甲胺四环素注射液和米诺环素可抑制CFA诱导的海马体小胶质细胞的活化,降低pro-BDNF/BDNF的比值。这可能是炎症模型大鼠胞外和胞内的pro-BDNF降解成BDNF的速度减慢、pro-BDNF表达增加或BDNF表达减少引发的[29]。BDNF在大脑不同区域也有着相同的作用,BDNF在CFA炎性痛大鼠下边缘皮层表达下降,在前边缘皮层无明显变化。将BDNF输注到双侧腹下皮层可激活神经元活动,减轻炎性痛,加速恢复[30],说明BDNF可能在CFA诱导的炎性痛中枢神经系统中起到神经保护作用,缓解疼痛。
3 小结与展望
综上所述,BDNF具有双重作用。在DRG和脊髓中BDNF通过P2X7受体和NMDA受体等诱导疼痛的发展,而在高级中枢海马体、皮层具有神经保护作用,减轻疼痛。BDNF在神经病理性疼痛的研究相比炎症性疼痛多,可以通过各个靶点研发新型药物来治疗神经病理性疼痛,但是,BDNF在炎症性疼痛中的研究相对较少,需要更深入地挖掘其中的奥秘。BDNF在高级中枢大部分是起着镇痛作用,只有少部分引起疼痛,如BDNF的表观遗传修饰在大脑皮层可以引起神经病理性疼痛的发展。神经病性疼痛模型大脑研究偏少,研究者可以从神经病疼痛大脑方面进行研究,寻找出对病理性疼痛有效的治疗靶点。
