鲍鱼内脏脂质增强免疫功能的初步研究*
2022-02-18萧建斌陈思远陈由强苏经迁
萧建斌,陈思远,陈由强,苏经迁
(1.福建师范大学生命科学学院 福建师范大学南方海洋研究院,福建 福州 350117;2.福建师范大学南方生物医学研究中心 福建省天然免疫生物学重点实验室,福建 福州 350013)
鲍鱼属于软体动物门,腹足纲,单壳贝类,又名“鳆鱼”,位列中国“四大海味”之首[1]。鲍鱼富含人体所需的蛋白质、维生素和无机盐等,口感极佳,故具有很高食用价值,从古至今都作为名贵海产品深受人们喜爱[2]。在中医上认为,鲍鱼有润肺养胃、滋阴补阳、养肝固肾的功效[3]。随着鲍鱼人工养殖技术的发展和应用,鲍鱼开始逐渐步入寻常百姓家庭,鲍鱼的深加工也开始飞速发展[4]。目前,鲍鱼的深加工主要以鲍鱼肌肉为主,大量的鲍鱼内脏未被充分利用,造成严重的资源浪费[5]。因此,对鲍鱼内脏进一步开发利用势在必行。
鲍鱼内脏脂质(Lipid of abalone viscera,LAV)是由鲍鱼内脏提取得到的混合脂质,含量约为鲍鱼内脏4%,是食品、医药和化工等行业的重要原材料之一[6]。LAV中含有大量的脂肪酸ω-3、ω-6和ω-9,其中脂肪酸ω-3型多不饱和脂肪酸,在降胆固醇和降血脂方面均具有良好功效[7]。对鲍鱼内脏的研究表明,其富含的多糖、多肽和矿物质等多种营养物质具有抗肿瘤、增强免疫力和抗氧化等功能[8,9]。但是关于LAV增强免疫功能的生理活性还尚不清楚,因此本试验以C57BL/6小鼠为研究对象,探究LAV对小鼠的免疫调节作用,为鲍鱼内脏加工再利用和保健功能的开发提供理论依据。
1 材料与方法
1.1 实验材料
C57BL/6 小鼠,雌雄各半,体重18~25 g,所有小鼠均喂养于福建师范大学南方医学中心动物实验房。LAV由福建省水产研究所提供。
1.2 药品与试剂
浓缩精制鱼油购买于冰岛LYSI公司;刀豆蛋白(ConA)购买于美国Sigma公司;绵羊红细胞(SRBC)、RPMI 1640培养基、Hank's液、0.5%MTT溶液购买于北京索莱宝科技有限公司;胎牛血清(FBS)购买于美国Gibco公司;豚鼠血清购买于北京博尔西科技有限公司;二硝基氟苯(DNFB)购买于上海麦克林生化科技有限公司。其余药品均为国产分析纯。
1.3 实验仪器
IC1000 细胞计数仪,上海睿钰生物科技有限公司;Infinite 200全自动酶标仪,瑞士TECAN公司;MCO-170AICDL-PC二氧化碳培养箱,日本松下公司;Avanti J-26S XP高速冷冻离心机,美国贝克曼公司。
2 方法
2.1 动物分组
小鼠灌胃前,进行称重,按照平均重量将小鼠分成空白对照组(C)、阳性药物组(PC)、LAV低剂量组(LD)、LAV中剂量组(MD)、LAV高剂量组(HD),每组6只,雌雄各半。LD、MD和HD组分别用LAV(用量分别为17、33、66 mg/kg)进行灌胃,PC组用浓缩精制鱼油(33 mg/kg)进行灌胃,C组给予同等剂量的玉米油进行灌胃。药品均用玉米油配制,每天灌胃给药1次,每只小鼠灌胃剂量为0.1 mL,自由饮食。
2.2 脾淋巴细胞增殖能力的测定
在末次给药12 h后,无菌取出各组小鼠脾脏,于盛有无菌 Hank's液的平皿中将小鼠脾脏研碎,参考王璐等[10]的方法制成细胞悬液,计数细胞,用无菌RPMI 1640培养液将细胞浓度调整为1×107个/mL。将细胞悬液各取1 mL放入24孔培养板中,设置3个复孔,分别加入ConA液(终浓度为5 μg/mL),每组再设置3孔作为空白对照。将培养板置于37 ℃的CO2培养箱中培养72 h,培养结束前6 h,从每孔中精密吸取上清液0.7 mL,弃掉,同时每孔加0.7 mL不含牛血清的RPMI 1640培养液和100 μL 0.5%MTT溶液,继续培养至结束。从每孔中吸取0.8 mL溶液,弃掉,同时向每孔中加入1.0 mL的DMSO,混匀,使紫色结晶物完全溶解后,分装到96 孔培养板中,利用全自动酶标仪,测定OD570的值,按照公式计算淋巴细胞增殖能力。
计算公式:

式中:A——淋巴细胞增殖能力;
OD1——ConA孔中OD值;
OD2——对照孔的OD值。
2.2 DNFB 诱导小鼠DTH的测定
采用姚满林等[11]的方法。小鼠腹部脱毛,用50 μL 1%DNFB溶液均匀涂抹致敏。第2天同剂量重复致敏,5 d后,用DNFB溶液10 μL均匀涂抹于小鼠左耳(两面)进行攻击,24 h后,用颈椎脱臼的方法处死小鼠,剪下左右耳壳,用打孔器取下直径8 mm的耳片,称重。用左右耳重量之差表示DTH的程度。
2.3 抗体生成细胞水平的测定
参考赵庆枫等[12]的方法。自首次灌胃处理后的第55天开始,每组实验鼠注射0.2 mL 2%SRBC,连续腹腔注射5 d,1次/d。末次注射12 h后,无菌取出脾脏,制成细胞悬液,进行细胞计数,稀释处理后,细胞终浓度调整为3×107个/mL。在新的离心管中,加入0.1 mL脾脏细胞悬液,0.3 mL 10%豚鼠血清和0.3 mL 10%SRBC混悬液,混合均匀。以不加细胞悬液做空白对照,37 ℃保温l h,通过冰浴终止反应,离心,取上清液转移至96孔板,每孔100 μL,使用酶标仪测定OD540值,以OD值表示抗体细胞生成水平。
2.4 血清溶血素水平的测定
参考朱艳等[13]的方法。在灌胃处理的第55天,每组实验鼠腹腔注射0.2 mL 4%SRBC悬液,连续腹腔注射5 d,1次/d。在末次灌胃处理1 h后,眼球取血置于离心管内,放置约2 h,将凝固血与管壁剥离,使血清充分析出,2000 r/min离心10 min,收集血清。取10μL血清以生理盐水稀释200倍。在200 μL稀释后的血清中分别加0.2 mL 4%SRBC和0.2 mL 10%豚鼠血清,混合均匀,同时设置不加血清即200μL生理盐水的空白组进行对照。将4%SRBC随实验组共同温浴,测定OD数值作为SRBC半数溶血OD值。37 ℃孵育30 min,0 ℃冰浴下终止反应,3000 r/min离心10 min,吸取200 μL上清,分装至96孔板中,酶标仪测定OD540值,溶血素的水平以半数溶血值(HC50)表示,按下式计算HC50:

2.5 腹腔巨噬细胞吞噬能力的测定
参考张思哲等[14]的方法。自首次灌胃处理后的第30天,用颈椎脱臼的方法处死小鼠,无菌条件下酒精浸泡3 min,每鼠腹腔无菌注射2 mL含2%FBS的PBS,收集腹水于无菌离心管中,1000 r/min 离心5 min,弃上清液,用RPMI 1640完全培养液吹打细胞使其成为单细胞悬液,计数后将细胞浓度调整为1×106个/mL。将巨噬细胞接种于96孔板(200 μL/孔),于37 ℃、5% CO2培养箱中培养3 h,每孔弃100 μL培养液后,各加入100 μL 0.072%中性红溶液,继续培养30 min,弃去中性红溶液,用PBS清洗3次以除去未被吞噬的中性红,之后每孔加入100 μl 细胞裂解液,振荡混匀,用酶标仪测定540 nm处的吸光值,吞噬能力以OD值表示。
2.6 统计学分析
两组间比较用t检验,由Graphpad prism 7.0和Adobe Illustrator软件绘图。P<0.05表示差异有统计学意义(*,P<0.05;**,P<0.01;***, P<0.001)。
3 实验结果与分析
3.1 LAV 对脾淋巴细胞增殖能力的影响
淋巴细胞具有免疫识别功能,在免疫应答中起到关键作用,可通过特异性抗原途径来诱导活化,也可以通过ConA等刺激物的途径来诱导活化[15]。结果如图1所示,C组的淋巴细胞增殖能力为0.205,PC组的淋巴细胞增殖能力为0.363,相对于C组提高了77%(P<0.05)。LD、MD和HD的增殖能力分别为0.246、0.334、0.460,与C组相比,分别提高了20%(P>0.05)、63%(P<0.05)和124%(P<0.01),3个剂量组呈一定的剂量依赖性,说明口服LAV对提高小鼠的脾淋巴细胞增殖能力具有促进作用。

图1 LAV对小鼠脾脏淋巴细胞增殖能力的影响
3.2 LAV 对DNFB诱导小鼠DTH的影响
耳肿胀是迟发型变态反应中的一种,可用于检测体内细胞免疫功能[16]。结果如图2所示,C组的平均DTH程度为17.9 mg,PC组的DTH程度平均为24.4 mg,与C组相比增加了22.6%(P<0.05)。LD组、MD组和HD组的DTH程度平均为20.6 mg、21.9 mg和23.7 mg,与C组相比DTH程度分别增加了15.1%(P<0.05)、22.3%(P >0.05)和32.4%(P<0.05)。

图2 LAV对DNFB诱导小鼠DTH的影响
3.3 LAV 对小鼠抗体生成细胞水平的影响
抗体生成细胞是淋巴系细胞,包含B细胞和T细胞,其中B细胞是抗体生成细胞前体,在细胞膜表面具有以单一特异性抗体作为抗原受体,一旦与抗原结合就直接或借助于T细胞进行增殖分化,因而通过测定抗体细胞生成水平可表示体液免疫的水平[17]。结果如图3所示,PC组的抗体生成细胞水平与C组相比上调了23.3%(P<0.05),在实验组中,LD组与C组的抗体生成细胞水平没有显著变化(P>0.05),MD和HD组的抗体生成细胞水平与C组相比分别上调13.5%(P<0.05)和17.9%(P<0.05)。实验结果说明,中、高剂量的LAV能显著提高抗体生成细胞水平,对小鼠的体液免疫产生有益作用。
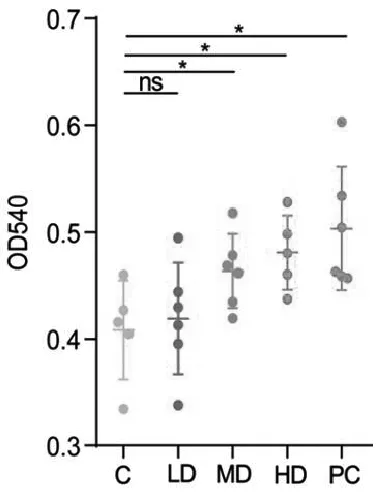
图3 LAV对小鼠抗体生成细胞水平的影响
3.4 LAV 对小鼠血清溶血素的影响
利用SRBC刺激小鼠进行免疫应答,从而产生特异性抗体,通过检测红细胞溶血过程中血红蛋白的量可以反映抗体产生的水平[18]。如图4所示,C组的溶血素表达水平为680,HD组的HC50为749,相比C组提高了10.1%(P<0.01)。LD组和MD组的HC50为741和752,分别升高了9.0%(P<0.05)和10.6%(P<0.01)。

图4 LAV对小鼠血清溶血素的影响
3.5 LAV 对小鼠腹腔巨噬细胞吞噬能力的影响
腹腔巨噬细胞吞噬能力可反映体内单核巨噬细胞的免疫功能,在一定程度上反应小鼠非特异性免疫水平[19]。由图5可知,PC组小鼠腹腔巨噬细胞的吞噬能力相对C组提高了29.98%(P<0.01)。与C组相比,LAV的LD、MD和HD三个剂量组均可改善小鼠腹腔巨噬细胞的吞噬能力,且MD和HD组的效果更佳,吞噬能力分别提高了19.4%(P<0.05)和16.9%(P<0.01)。
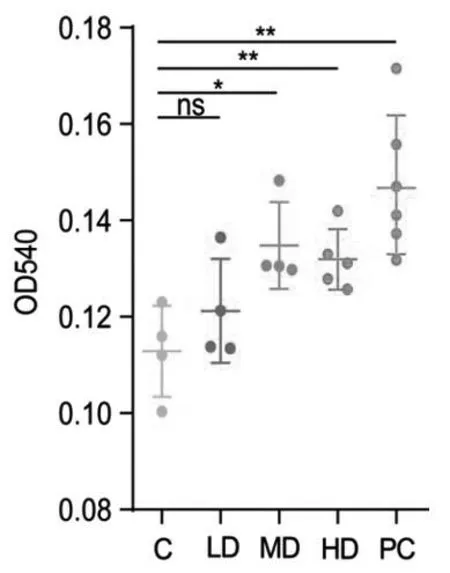
图5 LAV对小鼠腹腔巨噬细胞吞噬能力的影响
4 讨论
细胞免疫和体液免疫构成机体的特异性免疫系统,并分别通过T细胞和B细胞发挥作用[20]。在非特异性免疫中,腹腔巨噬细胞可以抵抗或者清除外来异物或抗原,并可以通过吞噬指数反映其吞噬能力[21],因此本文从体液免疫、细胞免疫及非特异性免疫功能等方面评价LAV对小鼠免疫功能的调节作用。结果表明LAV能够通过增强小鼠细胞免疫、体液免疫,改善小鼠巨噬细胞吞噬活性等途径从而增强小鼠机体免疫机能,但是具体的免疫作用机制有待进一步研究。
综上所述,LAV具有突出的免疫调节作用,高剂量的LAV的效果与市场上的鱼油类似,本研究为鲍加工过程中所产生副产物的多元化开发和全值化利用提供了初步的理论依据。
