安徽合肥地区单采血小板捐献者血样的HPA基因分型
2022-02-17赵阳胡晓玉王超陈美梅赵娜娜於娟吕蓉
赵阳 胡晓玉 王超 陈美梅 赵娜娜 於娟 吕蓉
在临床中很多种疾病会导致血小板数量减少,当血小板数量降至一定数值时,如不能够及时输注血小板,可能会出现颅内、内脏出血等,危及患者生命。目前在临床治疗中只进行ABO血型系统的血小板配合性输注,常会遇到患者多次输注血小板后出现血小板输注无效的棘手问题。引起血小板输注无效的原因有免疫性因素和非免疫性因素,其中免疫性因素主要包括人类白细胞抗原(human leukocyte antigen,HLA)的抗体、血小板同种抗原(human platelet antigen,HPA)的抗体、CD36抗体等。在血小板输注过程中,如果血小板同种抗原不相匹配,受血者机体产生血小板同种抗体,会引发同种免疫性血小板减少症、输血后紫癜(NAITP)、血小板输注无效(PTR)、新生儿同种免疫性血小板减少性紫癜(NAITP)等[1]。据文献报道大约2%~11%长期输注血小板患者会产生抗-HPA[2]。不同人群HPA基因型别有一定的差异。通过HPA基因分型检测可以实现同种型别的个体进行血小板输注,从而有效减少同种血小板抗体的产生。因此,对本地区单采血小板捐献者血样进行HPA基因分型检测,并探讨检测方法的建立,建立适合本地区库容的血小板捐献者资料库,实现HPA基因型的同型输注或配合性输注,减少患者输注血小板产生抗体的发生,提高血小板输注的效果有重要的意义[3]。
材料与方法
1 样本来源
1.1 无偿捐献单采血小板人群:随机抽取2020年4月1日~2020年12月1 日自愿无偿参加安徽省血液中心单采血小板捐献者1 181名。年龄:18~55周岁。男性:944名;女性:237名。献血次数3次或3次以上献血者:483名;首次献血者:451名。A型献血者;364名;B型献血者:297名;O型献血者:410名;AB型献血者:110名。此项实验已获伦理委员会审批,且均已签署知情同意书。
1.2 验证方法选取的标本:在1 118名无偿捐献者中随机抽取22人血样,此22份样本中包含了利用多重荧光PCR法HPA分型检测结果为低频抗原的样本,使用SBT方法进行HPA分型检测。
2 试剂与仪器
2.1 试剂:磁珠法血液DNA提取试剂盒(批号:MD5111-02,Magen);人类血小板特异性抗原HPA1-6/10/15/21基因分型检测试剂盒(多重荧光PCR法)(批号:202101B/202201,伟禾生物);HPA基因测序试剂盒(PCR-SBT法)(批号:K202011006,秀鹏生物)。
2.2 仪器:离心机(日本久保田);KingFisherFlex全自动磁珠提取纯化系统(Thermo公司);浓度测定仪(eppendorf);7500荧光定量PCR仪(ABI公司);3730基因测序仪(ABI公司)。
3 方法
3.1 提取样本DNA:采用磁珠法提取单采血小板捐献者抗凝血样DNA,将200 μL血样和相应的试剂加入到深孔板和浅孔板中,按照要求运行全自动磁珠提取纯化系统。实验结束后将浅孔板中DNA转移到对应编号的EP管中。取10 μLDNA样本使用浓度测定仪检测DNA浓度,DNA浓度为30~50 ng/mL,A260/A280值为1.6~2.0,DNA冻存于-20℃备用。
3.2 多重荧光PCR法HPA分型检测:从冰箱中取出HPA主反应液和灭菌水,平衡至室温(20~25℃)混匀后备用。每一个样本需同时进行6管独立的实时荧光PCR反应。按每个反应孔HPA主反应液3 μL、HPA酶混合液0.4 μL、灭菌水12.6 μL配置混合母液,每个反应孔中加入16 μL混合母液;每个反应孔中加入2 μL对应样本符合浓度要求的DNA,每块反应板中H7-H12反应孔加入试剂盒自带的阳性对照样本2 μL,吹打混匀后,贴上光学封膜,短暂离心后,放入荧光定量PCR仪中;根据设定好的循环参数,运行7500荧光定量PCR仪;实验结束后,取出反应板,读取数据。
3.3 多重荧光PCR法HPA分型检测结果分析
3.3.1 ABI7500荧光定量PCR仪:根据HPA亚型探针荧光标识表,扩增曲线正常且Ct<32,判断相应的HPA亚型为阳性;无扩增曲线升起或Ct≥32,判断相应的HPA亚型为阴性;扩增曲线异常,重新检测。
3.3.2 软件分析:将ABI7500荧光定量PCR仪的原始结果文件输出为Excel文件,并将其导入判读软件中,软件直接分析出待检样本HPA基因型别。
3.4 PCR-SBT法HPA基因测序
3.4.1 扩增反应:从冰箱中取出HPA扩增引物板及按比例稀释后的dNTP-Buffer溶液,每人份取上述稀释液80 μL置于干净EP管中,加入8 μL DNA进行配制,振荡混匀数秒;每人份每孔加入10 μL上述混合液于扩增引物板中,封板膜覆上扩增引物板,短暂离心后使用PCR仪进行PCR 反应。
3.4.2 扩增产物检测及纯化:取5 μL PCR扩增产物,使用2%琼脂糖凝胶,140-150V电泳10分钟,进行产物电泳验证;每孔检测到特异性扩增产物后,在剩余的5 μL扩增产物中加入0.5 μL ExoSAP,盖好封板膜,震荡混匀后短暂离心至管底,使用PCR仪进行ExoSAP纯化反应。
3.4.3 测序产物纯化:在测序引物板中每孔加入BigDye Buffer稀释液后短暂离心,每孔加入1 μL ExoSAP纯化产物。封覆板膜,震荡混匀后,短暂离心,使用PCR仪进行PCR反应。反应结束向引物板每孔的测序产物中加入2 μL PPT Buffer,短暂离心后,向每管加入40 μL无水乙醇,充分震荡至少1 min,室温避光静置15 min,离心倒置后,再重复一次。室温避光放置引物板直至酒精挥发干净,向每孔中加入10 μLHi-Di Formamide溶解DNA。盖好封板膜,短暂离心,于PCR扩增仪中进行测序产物变性反应。反应完成后上测序仪进行数据收集。
4 统计学处理 将实验数据使用SPSS软件进行统计学分析,计算公式如下,基因频率=阳性数(aa或ab或bb)/总人数,a基因频率=(aa+ab/2)/总人数,b基因频率=(bb+ab/2)/总人数,利用χ2检验是否符合Hardy-Weinberg平衡。
结 果
1 多重荧光方法HPA分型检测,样本检测的荧光曲线在ABI7500荧光定量PCR仪上显示如图1所示;将ABI7500荧光定量PCR仪的原始结果文件导入判读软件后,分析出HPA基因型别,判读结果示例如图2所示;安徽合肥地区1181份单采血小板捐献者血样多重荧光PCR法HPA1-6,10,15,21基因型分布及频率如表1中所示,其中HPA-10未检出b等位基因,HPA1-6,15,21系统中a等位基因频率均高于b等位基因频率。HPA-3和HPA-15的杂合度较高。

表1 安徽合肥地区单采血小板捐献者HPA1-6,10,15,21基因型分布及频率
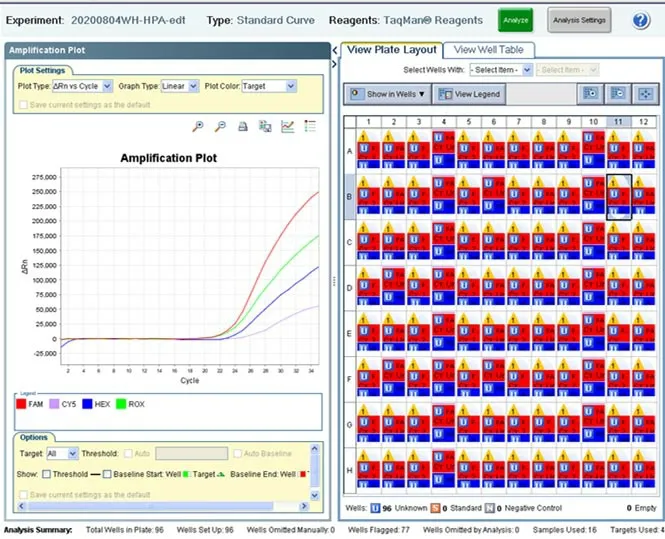
图1 ABI7500荧光定量PCR仪荧光曲线示例

图2 检测数据软件判读示例
2 选取的22名捐献者血样使用SBT方法进行HPA分型检测,以便于对多重荧光PCR法HPA分型结果的验证;其中部分HPA分型检测结果如图3所示,将22例样本使用多重荧光PCR法与SBT方法检测的HPA1-6,10,15,21基因型结果进行了对比,22份样本使用SBT方法检测的HPA1-6,10,15,21基因型结果与使用多重荧光PCR方法检测的结果相同,其中包含了HPA-1ab、HPA-4ab、HPA-5ab、HPA-6ab、HPA-21ab等低频抗原样本,两种方法检测的22份样本结果完全一致。
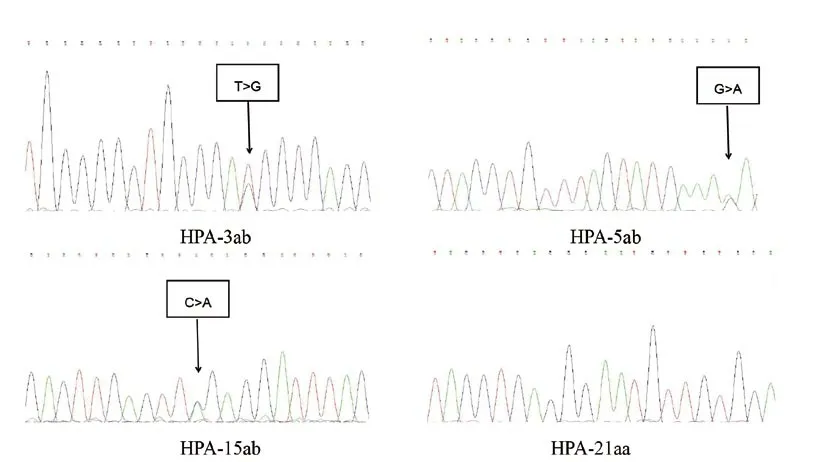
图3 部分HPA基因分型检测结果示例
3 安徽合肥地区1 181份单采血小板捐献者HPA基因频率与文献中国内其他地区人群的HPA基因频率比较如表2中所示,其中HPA-21基因型检测的较少,未进行比较。

表2 安徽合肥地区单采血小板捐献者HPA基因频率与国内其他地区比较
讨 论
人类血小板抗原(Humman Platelet Antigen,HPA)是位于血小板膜糖蛋白上的抗原表位,是血小板本身固有的抗原,它由血小板特有的抗原决定簇组成。目前已发现35种HPA抗原[9],按发现时间顺序命名为HPA-1到HPA-29;其中HPA-1、HPA-2、HPA-3、HPA-4、HPA-5 和HPA-15是双等位基因抗原系统[10],其他23种抗原是单个低频抗原。在共显性双等位基因的遗传系统中,a表示基因频率大于50%的等位基因,b表示基因频率小于50%的另一等位基因,字母w表示两个对偶HPA抗原只检测到一种相应的抗体[11]。
目前多种HPA基因分型的方法中使用较多的有序列特异引物聚合酶链式反应(PCR-SSP)和直接测序分型(SBT)方法[6]。PCR-SSP方法检测成本相对低,仪器设备要求低;但需要电泳步骤,操作繁琐,相对耗时;结果无法自动获得,带有主观性,准确度有待提高。直接测序分型(SBT)方法准确度高,是HPA基因分型的金标准,但检测成本和仪器设备要求较高,操作步骤繁琐。本研究中安徽合肥地区1181例单采血小板捐献者血样的HPA基因分型检测采用的是多重荧光PCR方法。其检测原理是采用实时荧光PCR结合Taqman探针技术对HPA基因进行定性分型检测。Taqman荧光PCR法其引物设计方法相似,同时增加若干条亚型特异性探针。在PCR扩增过程中,当探针完整时,不发出荧光信号。引物延伸时,与模板结合的探针被Taq酶(5'→3'外切核酸酶活性)切断,报告基团与淬灭基团分离,产生荧光信号,荧光定量PCR仪根据检测到的荧光信号自动绘制出实时扩增曲线,从而实现对基因的分型检测。在同一PCR反应体系里加上二对或以上引物和相应的两条或多条探针,同时扩增出两个或者两个以上核酸片段,鉴定两种或两种以上的基因型存在与否。使用了FAM(520 nm)、HEX(560 nm)、ROX(610 nm)、CY5(670 nm)四种荧光标记的探针,分布于同一反应孔,一个反应即可检测4种HPA基因型别。如反应孔1,FAM荧光探针标识HPA-1a基因型,HEX荧光探针标识HPA-2a基因型,ROX荧光探针标识HPA-3a基因型,反应孔2,FAM荧光探针标识HPA-1b基因型,HEX荧光探针标识HPA-2b基因型,ROX荧光探针标识HPA-3b基因型,每孔CY5荧光探针标识内标,其他反应孔同理,因此可以实现每孔多重反应,尽可能的缩短了实验操作时间。相对于以往的HPA分型检测使用较多的PCR-SSP方法,操作简便,不需要电泳步骤,实验时间较短,适合血液中心大批量、快速检测血小板捐献者血样HPA基因型,同时软件分析得出检测结果,减少人为判定的主观性,保证结果客观有效。
本实验室为进一步验证多重荧光PCR方法检测结果的准确性,选取22份样本DNA使用SBT的方法进行验证。22份样本中包含了低频抗原样本。通过两种方法检测结果来看,一致性较好。从而验证了多重荧光PCR方法检测结果的准确性。
本实验中检测的1 181份单采血小板捐献者血样的HPA1-6,10,15,21频率结果如表1,其中HPA-2、HPA-3、HPA-15最具有多态性,与国内外文献中报道较一致[12]。HPA基因型多态性主要是由于相应血小板膜糖蛋白结构基因中的单核苷酸多态性引起[9],从而导致相应位置的单个氨基酸变异[12]。HPA-3位于GPⅡb上,其单核苷酸多态性是由于编码GPⅡb的cDNA上第2 621位T→G取代,导致GPⅡb第843位异亮氨酸由丝氨酸所替代。HPA-15是双等位共显性遗传系统,相应的抗原由CD109蛋白携带。编码HPA-15a和15b抗原的等位基因,是由CD109cDNA编码区2108位C→A单核苷酸取代而产生,导致CD109蛋白的第682位丝氨酸由络氨酸所替代。本地区的HPA基因频率与国内一些其他地区的HPA基因频率比较情况如表2中所示,从表中内容可以发现,本地区血小板捐献者人群的HPA基因型分布有着本地区的特点。据文献报道HPA-4ab的基因频率较低[13],本实验中发现了3例HPA-4ab的单采血小板捐献者,通过查阅文献[5-6],比较得出本地区人群的HPA-4ab基因频率高于河源、黑龙江、长沙等地区,但低于北京、山东等地区[4,7],考虑与不同地区的人群分布有关,HPA-4ab基因频率与国内其他地区有一定的差异,有着本地区的HPA基因型分布特点。本次实验检测了HPA-21的基因型别,HPA-21位于GPⅢa上,其单核苷酸多态性是由于编码GPⅢa的cDNA上第1 960位G突变为A取代,导致氨基酸改变,本地区基因频率分别为21aa:0.985 2,21ab:0.0148 3,未检测出HPA-21bb样本。为国内人群的HPA-21基因型分布提供一定的参考数据。从表2中可以看出本次实验中得出的HPA-1ab、HPA-2ab、HPA-6ab等基因频率与文献报道[3]的安徽地区的基因频率有一定的差异性。分析原因,本实验采用多重荧光PCR方法检测样本,是否与使用SSP-PCR方法检测HPA-1ab、HPA-2ab、HPA-6ab等低频基因型样本,检测结果存在一定的差异性,两种检测方法结果的差异性有待探讨。
随着血液精准输注的观念深入人心,为保障患者的输血安全,最大提高患者输注血液的疗效,现今血液的配合性输注不仅局限于ABO血型相配合,特别是一些血液病患者或需多次输注血液制品的患者,与供者的HLA、HPA型别的配合性输注,已被广泛认可[11]。据报道[12],导致PTR和NAITP的发生主要由血小板特异性抗原HPA-1a、HPA-1b、HPA-4a、HPA-3a、HPA-3b、HPA-2b等引起;新生儿同种免疫性血小板减少性紫癜(NAITP)主要由HPA-4a、HPA-3a等抗原造成。因此为患者找到配合性型别的血小板捐献者,输注HPA基因型配合性的的血小板制品使患者的治疗有效率得到显著提升[14]。根据以上实验结果分析,本地区单采血小板人群的HPA的基因分布频率有着本区域的特点。本血液中心设立在安徽省省会城市,全省的单采血小板采集量和供应量均居全省首位,因此建立合适库容的血小板捐献者资料库,为患者提供HLA和HPA基因型配合的血小板血液制品有着重要的意义。
利益冲突所有作者均声明不存在利益冲突
