血小板模式识别受体在固有免疫应答与血栓形成中的作用研究进展
2022-02-17周敏胡大春
周敏 胡大春
固有免疫应答又称非特异性免疫应答,病原体通过组织屏障后,位于免疫细胞胞膜的模式识别受体,识别病原体的配体后,吞噬病原体,而位于胞质的模式识别受体和病原体配体结合后,共同启动信号转导,激活促炎基因转录,释放细胞因子促进炎症反应,清除病原体。既往认为血小板主要参与机体止血与血栓形成,近年来发现,它也是桥接固有免疫应答和血栓形成的重要成分。血小板在参与固有免疫应答过程中,增加了血栓形成的风险,其机制与血小板模式识别受体的激活及其信号转导密切相关。血小板模式识别受体有三类:位于胞膜的C型凝集素受体、位于胞膜或内体膜的Toll样受体以及位于胞质的NOD样受体,均可参与病原体的清除。在血小板参与固有免疫应答中,病原体还通过血小板模式识别受体、G蛋白耦联受体等,激活血小板释放胞内颗粒物,与免疫细胞相互作用,促进对病原体的清除;与此同时可能导致炎症损伤和血栓形成,造成对机体的双重打击,其中血小板膜受体激活可能发挥重要作用[1]。现就此方面的研究新进展综述如下。
1 血小板模式识别受体参与固有免疫应答和血栓形成
1.1 血小板C型凝集素受体:C型凝集素受体是在Ca2+参与下,与病原体表面糖类结合的胞膜受体,而血小板C型凝集素受体能与病毒的糖蛋白相互作用,激活抗病毒免疫应答[2]。登革热病毒通过C型凝集素受体2(C-type lectin like receptor-2,CLEC-2)激活血小板,使其释放细胞外囊泡,进一步激活中性粒细胞和巨噬细胞上的CLEC-5A和Toll样受体2,诱导中性粒细胞胞外杀菌网络(neutrophil extracellular traps,NETs)和促炎细胞因子的释放,引起细胞因子风暴和全身炎症反应[3]。
此外,CLEC-2也是一种跨膜蛋白,可被配体平足蛋白(podoplanin,PDPN)激活,PDPN表达于肾祖细胞、淋巴管内皮细胞、Ⅰ型肺泡细胞等,可与血小板CLEC-2结合,在胚胎淋巴管和静脉之间的分隔区域,衔接蛋白SLP-76触发免疫受体酪氨酸活化基序(immunorecepter tyrosine-based activation motif,ITAM)的酪氨酸磷酸酶SHP1/2的活化,激活酪氨酸激酶(spleen tyrosine kinase,Syk)和磷脂酶Cγ2(phospholipase Cγ2,PLCγ-2),诱导血小板活化、粘附、聚集(图1),使淋巴液和血液分离,促进淋巴管的生长发育,构建固有免疫应答基础[4-5]。
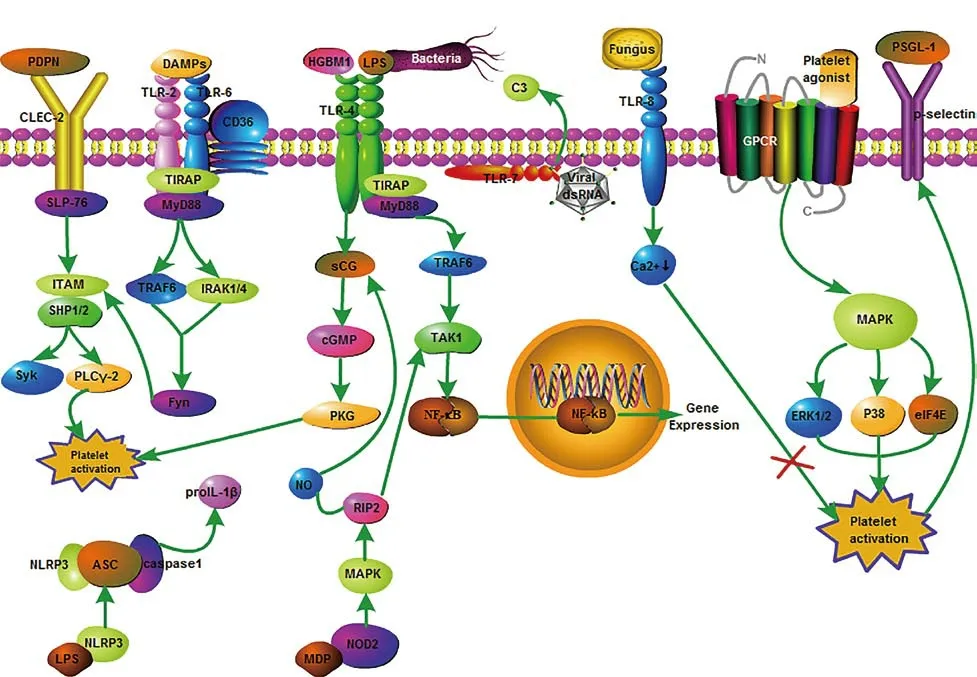
图1 血小板模式识别受体及其他膜受体信号转导通路
在急性呼吸窘迫综合征小鼠模型中,气管滴入脂多糖(lipopolysaccharide,LPS)启动血小板CLEC-2/PDPN信号转导,血小板募集结合中性粒细胞到肺泡中,可能通过调节角蛋白趋化因子(keratinocyte chemoattractant,KC)和巨噬细胞炎症蛋白2(macrophage-inflammatory protein2,MIP-2)清除病原体,预防急性肺损伤引起的急性呼吸窘迫综合征[6]。同时,位于炎症区域上的PDPN表达上调,与血小板CLEC-2结合,促进血小板活化、聚集,血栓形成[7]。在炎症反应中,血小板糖蛋白GPVI通过类似CLEC-2的信号转导途径,活化血小板,使血小板迅速粘附在中性粒细胞介导的血管损伤部位,减少出血,血小板糖蛋白GPVI和CLEC-2虽享用共同的信号转导途径,但在炎症反应中二者因其配体不同,具有不同的严格调控机制[8]。血小板CLCE-2在固有免疫应答和血栓形成中有着密切联系,并在炎症反应中可协助机体降低器官损伤风险。
1.2 血小板Toll样受体:Toll样受体(toll like receptor,TLR)能识别病原微生物细胞上的病原相关分子模式(pathogen-associated molecular patterns,PAMPs)和在应激状态或病理条件下,机体死亡细胞和损伤组织产生的损伤相关分子模式(damage associated molecular patterns,DAMPs),TLR与其配体结合后,以异源或同源二聚体的形式启动信号转导,参与机体固有免疫应答[9-10]。血小板表达多种TLR,以下主要介绍血小板TLR-2、TLR-4、TLR-6、TLR-7、TLR-8的激活及其信号通路研究进展。
2009年,ZHANG[11]等研究发现,LPS通过血小板TLR-4激活髓样分化因子88(myeloi ddifferentiation factor88,MyD88)和环磷酸鸟苷(cyclic guanosinc monophosphate,cGMP)/蛋白激酶G(protein kinases G,PKG)两个信号转导途径,提示脂多糖激活血小板TLR-4具有双重作用:TLR-4/MyD88途径介导其下游信号核因子-κB(nuclear factor-k-gene binding,NF-κB)的活性,激活的NF-κB转移至细胞核内,与相关DNA序列结合,启动相关基因转录(图1),靶基因产物如白细胞介素-1(interleukin-1,IL-1)、IL-6、肿瘤坏死因子(tumor necrosis factor,TNF)等参与调节炎症反应和免疫应答;TLR-4/cGMP/PKG信号转导途径刺激血小板颗粒分泌,则诱导血小板活化、聚集、止血和血栓形成(图1)。但血小板中NF-κB活化作用参与固有免疫应答精确信号通路尚不明确。最近的研究表明,LPS通过血小板TLR-4是间接活化血小板,超纯LPS化学型不能直接调节血小板活化,在病理情况下,可能是可溶性血小板激动剂的释放并诱导血小板活化,使TLR-4在血小板表面增加,激活NF-κB[12]。此外,有研究表明[13],肺炎克雷伯菌不会诱导经典血小板活化,但会增加血小板线粒体呼吸链功能,因此,不同菌株、不同纯度的LPS对活化血小板的影响可能不同。
高迁移率族蛋白B1(high mobility group box 1 protein,HMGB1)是内源性DAMPs分子,在无菌性炎症反应中,血小板衍生的HMGB1诱导TLR-4和MyD88依赖的鸟苷酸环化酶(guanylate cyclase,sGC)向血小板质膜移位(图1),促进血小板活化,激活血小板中cGMP依赖性蛋白激酶I(cGMP-dependent protein kinases I,cGKI),促进血栓形成[14]。但cGMP激活途径有双相作用,cGMP浓度水平低且快速增加可诱导血小板活化;在健康脉管系统中,高水平且持续增加的cGMP,使循环中的血小板保持失活状态[15]。此外,血小板衍生的HMGB1也能通过TLR4/MyD88/ NF-κB途径(图1),刺激巨噬细胞释放TNF等,促进炎症反应[16],提示血小板在炎症反应和血栓形成中有密切联系。
脂质代谢障碍和炎症反应被认为参与动脉粥样硬化病理机制,BISWAS等[17]研究表明,在高脂血症中积累的氧化磷脂oxPCCD36与血小板表面CD36结合,诱导形成CD36/TLR-2/ TLR-6复合物,启动信号转导,借助含Toll白介素1受体(toll-interleukin-1 receptor,TIR)结构域的衔接蛋白(tollinterleukin 1 receptor,TIR)domain containing adaptor protein,TIRAP)与MyD88结合,激活下游信号白介素1受体相关激酶(IL-1 receptor associated kinase,IRAK)1/4和泛素连接酶TNF受体相关因子6(TNF receptor associated factor 6,TRAF6),并通过Src家族激酶(Src Family Kinase,SFK)中的Fyn激活ITAM结构域的磷酸化,使Syk激活,介导PLCγ-2诱导血小板活化(图1),增加炎症反应和动脉粥样硬化血栓形成风险。
TLR-7主要介导机体对单链RNA病毒核酸的固有免疫应答,当流感病毒侵入机体,流感病毒被血小板吞噬内化,位于血小板胞内体膜上TLR-7识别并介导血小板释放补体C3(图1),激活补体途径,C3进而介导中性粒细胞DNA的释放,促进血栓形成,提示流感病毒感染可能会导致心肌梗死事件发生,但尚不明确补体系统和血小板TLR-7相互作用的具体机制[18]。
几丁质是真菌细胞壁的主要成分,几丁质寡聚体可直接与TLR-2结合,激活机体免疫应答和炎症反应[19]。但LEROY[20]等人,从白色念珠菌中纯化几丁质预处理血小板后发现,几丁质减少了血小板细胞内Ca2+内流和P-选择素的表达(图1),进而降低了经由TLR-8介导的血小板活化,并调节血小板和中性粒细胞的相互作用,导致白色念珠菌从宿主防御中逃逸。
在临床诊疗中,TLR抑制剂有利于阻断血小板在感染免疫应答中的负性作用,TLR的纳米抑制剂还可通过抑制TLR的信号转导,控制过度的炎症反应,降低动脉粥样硬化等心血管事件的进展[21]。
总之,PAMPs、DAMPs通过血小板TLR激活血小板,介导NF-κB和cGMP等信号转导,既能参与固有免疫应答和炎症反应,也可触发止血和血栓形成。抑制TLRs介导的血小板活化途径,也有助于预防急性心肌梗死患者的复发[22]。
1.3 血小板NOD样受体:一些病原体侵入机体,被免疫细胞吞噬后,可进入细胞质。位于血小板胞质内的NOD样受体(NOD-like receptor,NLR)有两类,分别是核苷酸结合寡聚域2(nucleotide-binding oligomerization-2,NOD2)和核苷酸结合寡聚化结构域样受体蛋白3(nucleotidebinding oligomerization domain-like receptor protein 3,NLRP3)炎症小体。NOD2可识别革兰阳性菌和革兰阴性菌的胞壁酰二肽(muramyl dipeptide,MDP)。有研究发现[23],败血症患者的血小板NOD2被MDP激活,使其构型改变,导致蛋白激酶MAPK下游途径苏氨酸激酶的受体相互作用蛋白2(receptor-interacting protrin2,RIP2)磷酸化,诱导血小板活化、聚集。此外,该研究还表明MDP激活血小板NOD2,导致RIP2依赖型NO生成,启动了RIP2/NO/sGC/cGMP信号转导(图1),进一步提示在炎症反应中MDP诱导血小板聚集和血栓形成。NOD2还能通过RIP2/转化生长因子激酶1(transforming growth factor activated kinase-1,TAK1)/ NF-κB途径,促进促炎基因转录表达(图1)。在心房颤动患者中发现,血小板NOD2受体激活,既能增强血小板反应性,又能促进血小板炎性因子释放,促进炎症反应和血栓形成[24]。
NOD样受体的NLRP家族中研究最多的是NLRP3炎症小体,CORNELIUS[25]等研究发现,在盲肠结扎穿刺导致败血症的大鼠模型中,LPS激活血小板的NLRP3炎症小体,使NLRP3、凋亡相关斑点样蛋白ASC和胱天蛋白激酶1(Caspase-1)形成复合物,催化Caspase-1活性,增加血小板的促炎细胞因子IL-1β的分泌(图1),导致败血症中肺部和肾脏的损伤。在进一步的研究中发现,使用NLRP3炎症小体抑制剂MCC950不仅减弱了血小板NLRP3炎症小体的活化,而且还减弱了LPS诱导的血小板活化,可作为败血症中多器官功能障碍和损伤的潜在治疗靶标[26]。
此外,炎症反应在心血管疾病的病理生理过程中发挥作用,活化的NLRP3炎症小体通过Caspase-1介导IL-1β和IL-18等炎性因子的释放,参与动脉粥样硬化的病理机制[27]。NLRP3炎症小体具有调节血小板整联蛋白αⅡbβ3由内而外的信号转导,凝血酶与G蛋白耦联受体结合,诱导血小板内活性氧的产生,并激活血小板NLRP3炎症小体,进而诱导IL-1β的分泌,IL-1β和IL-1β受体结合,导致酪氨酸激酶c-Src和Sky磷酸化,调节血小板的扩散和凝块回缩,在缺乏NLRP3炎症小体的小鼠模型中观察到动脉血栓形成减少[28]。在后肢缺血的小鼠模型中,通过血小板TLR-4/NLRP3炎症小体信号转导途径,上调血小板聚集,增加微血栓形成和干扰再灌注治疗[29]。在急性冠脉综合征患者中发现,血小板NLRP3炎症小体表达水平高于健康对照组和稳定型心绞痛组,并且血小板NLRP3炎症小体可作为经皮冠状动脉介入治疗预后的独立危险因素[30]。在治疗方面,既往有心肌梗死病史且超敏C反应蛋白大于2 mg/L的患者,使用抗炎治疗能降低心力衰竭的发病率和病死率[31]。
2 血小板其他膜受体参与固有免疫应答和血栓形成
2.1 G蛋白耦联受体:除了血小板模式识别受体外,其他血小板膜受体也参与机体固有免疫应答和血栓形成机制。G蛋白耦联受体(G Protein-Coupled Receptors,GPCR)家族中的甲酰肽受体(Formyl peptide receptors,FPRS)与细菌的一种趋化因子,N-甲酰-甲硫氨酰-亮氨酰-苯丙氨酰(N-formyl-methionyl-leucyl-phenylalanine,fMLF)结合,可激活免疫细胞胞内信号传导,参与炎症反应,有研究显示[32],fMLF与血小板中的FPR1结合,可激活血小板,诱导血小板中α颗粒分泌和P-选择素的暴露,促进炎症反应和血栓形成。
从受损细胞或活化血小板胞内颗粒内容物中释放的可溶性血小板激动剂,也能通过GPCR激活血小板。凝血酶的蛋白酶激活受体(protease activated receptors,PARS)、血栓烷A2的血栓烷A2受体、二磷酸腺苷(adenosine diphosphate,ADP)的嘌呤能受体P2Y12和P2Y1,可耦联到血小板表面表达的异源三聚体G蛋白,使细胞内Ca2+升高,诱导整联蛋白αⅡbβ3由内而外地信号转导,进一步促进血小板粘附、聚集、形成血栓。在血管损伤或炎症部位,通过血小板可溶性激动剂对促进血栓形成具有重要意义。有报道显示[33],新型冠状病毒患者血栓形成风险增加,主要以肺栓塞为主。严重急性呼吸系统综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)结合血管内皮细胞表达的血管紧张素转化酶2(angiotensin-coverting enzyme 2,ACE2),并将血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)转换为Ang1-7,激活血管紧张素Ⅱ受体(AT2)。AT2是GRCP中的一类,可能受GPCR激酶的负性调节,但MANNE等[34]研究表明SARS-CoV-2感染过程中的血小板不表达ACE2 mRNA,与健康组相比,GPCR激动剂增强新型冠状病毒肺炎患者血小板MAPK下游信号转导,ERK1/2、P38和真核起始因子4E(eukaryotic initiation factor 4E,eIF4E)磷酸化使血小板活化聚集增加(图1)。PAR1拮抗剂可作为预防新型冠状病毒肺炎患者相关血栓形成潜在治疗靶标[35]。此外,MORAES等人[36]研究表明,法尼醇受体(farnesoid X receptor,FXR)存在于人类血小板上,其配体GW4064能够抑制由胶原蛋白或PAR诱导的血小板活化,调节粘附受体和整联蛋白的信号转导,使纤维蛋白原合成和血小板聚集减少,是预防血栓形成动脉粥样硬化疾病的潜在靶标。
GPCR激酶(GPCR kinases,GRKs)是血小板活化和血栓形成的关键负性调控因子[37]。CHAUDHARY等[38]研究发现,与野生型小鼠相比,GPCR激动剂如2-MeSADP、U46619、AYPGKF诱导GRK6基因敲除小鼠的血小板聚集、活化和内容物分泌增强,GRK6基因敲除小鼠增强了ADP激动剂诱导的蛋白激酶Akt磷酸化和PAR4激动剂诱导的细胞外调节相关激酶ERK、蛋白激酶C磷酸化,而在三氯化铁损伤颈动脉的GRK6基因敲除小鼠中发现血栓形成增加,抑制GPCR的信号转导或使用GRK在炎症反应中减少血小板活化和血栓形成,降低免疫功能亢进造成的组织器官损伤风险。
2.2 P-选择素:P-选择素是血小板的颗粒膜受体。活化血小板释放的内容物,激活其表面粘附分子并附着在内皮细胞上,通过P-选择素(P-selectin)与P-选择素糖蛋白配体I(p-selectin glycoprotein ligand,PSGL-I)相互作用(图1),可招募白细胞并诱导释放中性粒细胞囊泡到胞外,促进对病原体的清除[39]。活化血小板还能刺激中性粒细胞释放NETs继续杀灭病原体和引发促凝和血栓的形成。在败血症小鼠模型中,MCDONALD等人[40]观察到体内NETs有大量的血小板聚集并激活凝血酶和形成纤维蛋白凝块,促进血栓形成和炎症反应。血小板TLR-4还可能参与血小板与中性粒细胞的相互作用,在克罗恩氏炎症性肠病缓解期患者中,血小板通过TLR-4与中性粒细胞相互作用能力比活动期患者强,二者相互作用促进中性粒细胞抗菌肽分泌,增强宿主防御能力[41]。单核细胞也表达PSGL-1,氧化型低密度脂蛋白诱导血小板与单核细胞的相互作用,促进单核细胞外渗和泡沫细胞的形成,增加动脉粥样斑块的形成[42]。在肝脏损伤小鼠模型中[43],血小板也能通过TLR-4与单核细胞形成聚集体,增强TNF-α的分泌,促进炎症反应。与健康对照组相比,心血管疾病患者中血小板和单核细胞相互作用,促进机体炎症反应,而升高的循环血小板-单核细胞聚集体,可作为心血管疾病诊断的生物标志物[44]。血小板与淋巴细胞相互作用的相关研究不多,血小板表达免疫蛋白酶体和主要组织相容性复合体(major histocompatibility complex I,MHC)I类,蛋白酶体释放的肽片段和I类MHC结合,这可能使血小板激活特异性细胞毒性T淋巴细胞表位,调节适应性免疫应答[45]。通过血小板膜上的TLR-4和P-选择素等,活化血小板与免疫细胞相互作用,不仅参与固有免疫应答,还能调节适应性免疫应答,并在慢性炎症反应中增加血栓形成风险。
3 结语 综上所述,血小板膜上受体除了介导传统的生理止血和血栓形成外,还通过多种信号通路调控固有免疫应答和炎症反应中的血栓形成,其中血小板模式识别受体发挥重要作用,如血小板TLR、NLR等多个受体,参与NF-κB信号转导,促进促炎因子基因表达;和cGMP信号转导,诱导血小板活化,共同激活机体固有免疫应答和过度炎症反应中血栓形成。同时,血小板通过GPCR等活化后,膜上暴露的P-选择素和TLR-4等还介导血小板与粒细胞相互作用,进一步诱导血小板释放颗粒内容物和粒细胞释放炎性因子,共同促进机体固有免疫应答和炎症反应中血栓形成。此外,抗血小板治疗可控制过度炎症反应,减缓血栓形成导致的动脉粥样硬化等疾病进展。虽然在基础研究中已阐明血小板模式识别受体等参与固有免疫应答和血栓形成的双重作用,但血小板在固有免疫应答中的动态作用和精细调控机制仍未明确,也缺乏相关临床研究。在临床诊疗实践中,血小板活化与血小板形态相关,观察血小板相关参数如血小板平均体积,血小板分布宽度等变化,有助于深入研究血小板参与机体固有免疫应答和血栓形成中血小板的功能变化,血小板相关参数是否能作为一种新型感染指标与粒细胞相关参数协助临床诊断感染性疾病及其诱发的血栓形成,可能是未来临床精准诊疗相关疾病的新方向。
利益冲突所有作者均声明不存在利益冲突
