猪繁殖与呼吸综合征抗病指示性状的分子标记筛查及检测
2022-02-17吴清清刘雯悦王媛官凯锋张庆德刘榜周翔
吴清清,刘雯悦,王媛,官凯锋,张庆德,刘榜,4,5,周翔,5
1.华中农业大学动物科学技术学院,武汉 430070; 2.农业动物遗传育种与繁殖教育部重点实验室,武汉 430070; 3.华中农业大学实验动物中心,武汉 430070; 4.生猪健康养殖省部共建协同创新中心,武汉 430070;5.湖北省地方猪品种改良工程技术研究中心,武汉 430070
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)俗称蓝耳病,是严重危害全球养猪业的传染病之一,以母猪繁殖障碍和各年龄段猪呼吸道疾病为主要特征[1],每年给我国生猪养殖带来巨大经济损失[2]。猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)通过抑制天然免疫、延迟中和抗体产生等多种途径抑制机体的免疫应答,导致病毒持续性感染,进而引起严重的继发细菌感染,给其他传染病带来可乘之机[3]。由于PRRSV基因组具有易变性和免疫逃避能力,导致疫苗免疫效果不佳。通过抗病育种在遗传水平增强宿主对PRRS的抗病力,是猪遗传改良工作的重点[4]。近年来在猪PRRS抗病遗传研究上取得了一些研究成果,如Boddicker等[5]对大白、长白杂交猪进行PRRSV人工感染试验,通过猪基因芯片数据在4号染色体上发现1个影响血液病毒载量和体质量增长的关键SNP 位点WUR10000125;Serão等[6-7]在猪7号染色体MHC区域发现3个SNPs可显著影响PRRSV感染后的抗体水平。
血液指标具有非常重要的免疫应答指示作用[8]。在PRRSV感染早期,PRRSV对宿主免疫应答具有抑制作用,宿主外周血中的白细胞数、单核细胞数、淋巴细胞数、淋巴细胞百分比均显著下降[9]。在PRRSV感染后期,机体通过激活免疫应答清除病毒,各血液参数指标逐渐恢复至正常水平[10-11]。前期研究发现,中国地方品种通城猪和国外品种大白猪感染PRRSV后血液淋巴细胞数目均下降,但通城猪血液淋巴细胞百分比显著高于大白猪,说明通城猪具有更强的免疫应答[12]。随后以大白猪×通城猪高代横交群体为研究对象,通过PRRSV人工感染获取感染不同时间点的血液指标,根据PRRSV感染后第14天的个体存活情况将群体划分为易感组和抗病组,结果显示易感个体感染后第7天的淋巴细胞百分比极显著低于抗病个体,且淋巴细胞百分比与血清中病毒载量显著负相关,因此,血液中的淋巴细胞百分比可以作为PRRS抗病性的指示性状[13]。通过检测与血液淋巴细胞百分比显著关联的分子标记可在疾病发生前筛选抗病个体,为猪抗病育种提供新的分子标记。
本研究基于猪全基因组SNP芯片分型数据,与PRRSV感染前(第 0 天)和感染后第 4、7、11、14、21天淋巴细胞百分比进行关联分析,筛选与淋巴细胞百分比显著相关的抗病基因和分子标记,同时建立抗病性状相关分子标记的Tetra-primer ARMS-PCR快速检测方法,旨在为猪抗病指示性状标记辅助选择提供新的 SNP 分子标记和检测方法。
1 材料与方法
1.1 样品采集及表型性状检测
试验动物为通城县云志生态养殖场的通城猪与大白猪杂交所构建的高代(F7~F9代)横交群体的10周龄健康断奶仔猪,平均体质量15 kg,共159头,分4批次进行PRRSV人工感染试验。感染试验前通过前腔静脉采血检测猪PRRSV、圆环病毒和伪狂犬病毒抗原和抗体,所有仔猪抗原抗体均为阴性。经过7 d预饲期后,对159头健康仔猪按照1 mL/5 kg的剂量(滴鼻接种1 mL,余量病毒进行肌肉注射)接种HP-PRRSV病毒(PRRSV-WUH3毒株,病毒滴度为 105.0TCID50/mL)进行PRRSV人工感染试验。在PRRSV感染前(第0天)和感染后第4、7、11、14、21天采用猪前腔静脉采血的方法采集抗凝血(EDTA-K)和促凝血。使用南京迈瑞公司 BC-2800Vet 兽用全自动血液细胞分析仪对抗凝血进行血常规指标淋巴细胞百分比检测[13]。促凝血用于血清分离,提取血清中病毒RNA,反转录成cDNA,通过绝对定量PCR方法构建标准曲线,计算血清中病毒载量,具体测定方法参见文献[14]。其中,有72头试验猪(2批次)PRRSV人工感染试验的血常规数据和病毒载量数据分别来自研究团队中王媛等[13]和高国丽等[14]的报道。
1.2 主要试剂
2×TaqMasterMix购自深圳艾伟迪生物科技有限公司;Biowest DNA电泳琼脂糖、Prime Script RT reagent Kit With gDNA Eraser反转录试剂盒、DL2000 DNA Marker购自TaKaRa公司;抗凝管购自山东奥塞特医疗器械公司;病毒基因组DNA/RNA提取试剂盒购自Tiangen公司;氯化钠、氯仿、异丙醇、无水乙醇购自国药集团化学试剂有限公司。
1.3 基因分型和质量控制
利用抗凝血样品分离白细胞,采用氯仿苯酚法提取白细胞样品DNA,通过Thermo Scientific公司的Nanodrop 2000核酸测定仪检测DNA浓度和纯度。将质检合格的 DNA 样品送至北京康普森生物技术有限公司利用“中芯一号” SNP 芯片进行基因分型。通过 PLINK v1.09 软件对基因型数据进行质量控制,剔除检出率小于95%、个体基因型缺失率大于0.1、最小等位基因频率小于0.01以及哈代温伯格平衡P<1×10-6的SNPs,保留37 124个SNPs进行后续分析。
1.4 抗病相关分子标记筛选及统计分析
根据试验影响因素和淋巴细胞百分比进行逐步回归分析,以批次效应、性别效应、初始体质量作为模型协变量,可使模型AIC值最小,利用R语言的GLM软件包中一般线性模型(general linear model,GLM)对质控后的SNPs数据与淋巴细胞百分比使用模型(1)进行关联分析。
Yihkl=μ+Gi+Bh+Sk+Wl+eihkl
(1)
式中,Yihkl代表性状测定值,μ代表群体均数,Gi代表基因型效应(其中i=1,2,3),Bh代表批次效应(其中h=1,2,3,4),Sk代表性别效应(其中k=1,2),Wl代表试验感染0 d初始体质量,eihkl代表随机误差。
双基因聚合性状关联分析采用模型(2)进行:
Yijhkl=μ+Gi+Gj+Gi×Gj+Bh+Sk+Wl+eijhkl
(2)
式中,Yijhkl代表性状测定值,μ代表群体均数,Gi代表第1个基因的基因型效应(其中i=1,2,3),Gj代表第2个基因的基因型效应(其中j=1,2,3),Gi×Gj为基因型间的互作效应,Bh代表批次效应(其中h=1,2,3,4),Sk代表性别效应(其中k=1,2),Wl代表试验感染0 d初始体质量,eijhkl代表随机误差。
筛选在PRRSV感染前(第0天)和感染后(第4、7、11、14、21天)6个时间点中至少有2个时间点的淋巴细胞百分比和基因型的一般线性模型显著关联(模型和基因型效应均显著)的SNPs位点。利用UCSC数据库对芯片位点在猪参考基因组Sscrofa 11.1对应位置进行转换,并对SNPs位点所在基因及基因位置进行注释,考虑SNPs所在基因的功能和不同基因型间的多重比较显著性,筛选与抗病、免疫性状相关的候选基因及分子标记。
统计候选SNPs在159头PRRSV人工感染个体的基因型分布情况,利用Kruskal-Wallis检验方法进行多重比较分析。数据用“最小二乘均值±标准差”表示,显著差异判断标准为:P<0.10表示差异边缘显著,P<0.05表示差异显著,P<0.01表示差异极显著。加性效应:A=(AA-BB)/2;显性效应:D=AB-(AA+BB)/2;AA为淋巴细胞百分比均值大的纯合基因型,BB为淋巴细胞百分比均值小的纯合基因型,AB为杂合基因型。
1.5 引物设计及合成
根据候选SNP位点侧翼500 bp序列信息,利用Tetra-primer ARMS-PCR引物在线设计程序(http://cedar.genetics.soton.ac.uk/public_html/primer1.html)进行ARMS-PCR引物设计,共设计2组引物,产物片段大小控制在150~600 bp[15]。针对每个SNP位点设计2条3′末端分别与SNP 2个等位基因碱基配对且延伸方向相反的内引物和2条方向相反的外引物,同时在内引物3′端第3位碱基引入错配以增加扩增特异性(表1)。引物由北京擎科新业生物技术有限公司合成。

表1 ARMS-PCR引物信息 Table 1 Tetra-primer ARMS-PCR
1.6 Tetra-primer ARMS-PCR扩增
PCR反应体系20 μL:2×TaqMaster Mix 10.0 μL,2条外引物(10 μmol/L)各0.2 μL,2条内引物(10 μmol/L)各0.8 μL,DNA模板2.0 μL(30 ng/μL),ddH2O 6.0 μL。PCR反应程序为:95 ℃预变性3 min,95 ℃变性30 s,退火30 s,72 ℃延伸36 s,共30个循环;72 ℃ 5 min,4 ℃保存。Tetra-primer ARMS-PCR产物经2%琼脂糖凝胶电泳检测,凝胶成像系统观察电泳结果并保存,根据扩增片段的大小和条带数目区分不同基因型。
2 结果与分析
2.1 与淋巴细胞百分比显著关联的分子标记筛选
淋巴细胞百分比在PRRSV感染后第4天极显著降低,并降到最低值,第4~21天逐渐回升,存活个体恢复正常水平,而死亡个体在死亡前维持较低水平。通过模型(1)对159个个体高质量SNP芯片数据与PRRSV感染前(第0天)和感染后(第4、7、11、14、21天)6个时间点的外周血淋巴细胞百分比进行基因型和性状的关联分析,共筛选得到3个抗病相关候选SNPs位点(rs81257542、rs334594334、rs329240026),其中rs334594334和rs329240026位点完全连锁(表2)。rs81257542位点位于基因DDX17的第3内含子,rs334594334、rs329240026位点分别位于基因BTG1的第6、7内含子。
2.2 DDX17和BTG1单基因SNP多态性与淋巴细胞百分比的关联分析
由于rs334594334和rs329240026位点完全连锁,以rs334594334(BTG1)作为标签SNP。 rs81257542(DDX17)、rs334594334(BTG1)位点多态性和PRRSV感染前(第0天)及感染后(第4、7、11、14、21天)6个时间点的淋巴细胞百分比关联分析结果见表3和表4。在感染后第7天和第11天,rs81257542位点不同基因型对应的淋巴细胞百分比具有显著差异(P<0.05),基因型AA的表型值显著低于基因型CA和CC个体,且3种基因型在不同时间点的淋巴细胞百分比的最小二乘均值均呈现基因型AA

表2 SNP位点基本信息 Table 2 Information of SNP loci

表3 DDX17基因rs81257542位点多态性与淋巴细胞百分比的关联分析 Table 3 Association analysis of rs81257542 polymorphisms in DDX17 gene with lymphocyte percentage

表4 BTG1基因rs334594334位点多态性与淋巴细胞百分比的关联分析 Table 4 Association analysis of rs334594334 polymorphisms in BTG1 gene with lymphocyte percentage
2.3 DDX17和BTG1双基因聚合后与淋巴细胞百分比的关联分析
通过双基因聚合性状关联分析(模型(2)),DDX17和BTG1双基因聚合基因型与PRRSV感染前(第0天)和感染后(4、7、11、14、21 d)6个时间点的淋巴细胞百分比关联分析结果见表5。单基因模型结果显示,C为DDX17的优势等位基因,A为BTG1的优势等位基因。根据优势等位基因数目,含3个及以上优势等位基因的基因型为优势合并基因型,包括CC-AA、CC-TA和CA-AA,共计63头;含3个及以上劣势等位基因的基因型为劣势合并基因型,包括AA-TT、AA-TA和CA-TT,共计39头。在感染后第7天,双基因聚合基因型与淋巴细胞百分比显著关联(P<0.05),其中含4个优势等位基因的CC-AA基因型对应的淋巴细胞百分比最小二乘均值最高(44.11%),且与其他7种基因型均差异显著(P<0.05),CC-AA在其他时间点对应的淋巴细胞百分比也相对较高。劣势合并基因型AA-TT和AA-TA对应的淋巴细胞百分比最小二乘均值最低,分别为31.83%和29.34%。
2.4 影响淋巴细胞百分比的SNPs与病毒载量关联分析
利用本文显著关联的SNPs与PRRSV感染后各时间点(4、7、11、14、21 d)的病毒载量数据通过模型(1)进行关联分析,结果见表6和表7。rs81257542位点的不同基因型在PRRSV感染后第4天和第7天对应病毒载量均呈现AA>CA>CC的趋势,该位点等位基因C对病毒载量具有负的加性效应,与淋巴细胞百分比趋势相反,感染后第7天不同基因型对血清中病毒载量具有显著的基因型效应(P<0.05,表6)。rs334594334位点的不同基因型在PRRSV感染后第4天和第7天对应病毒载量均保持TT>TA>AA的趋势,该位点等位基因A对病毒载量具有负的加性效应,与淋巴细胞百分比趋势相反(表7)。对于感染后第4天和第7天2个时间点,2个位点的3种不同基因型对应的病毒载量表型值呈现的趋势与淋巴细胞百分比趋势相反。
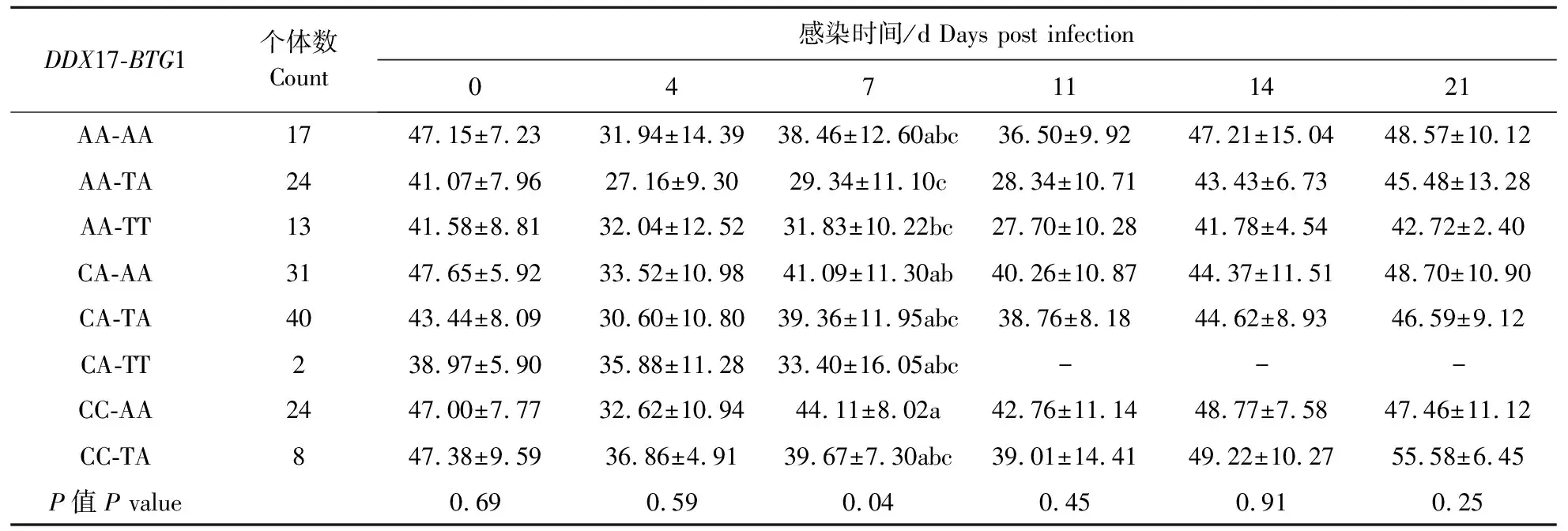
表5 DDX17和BTG1双基因聚合基因型与淋巴细胞百分比的关联分析 Table 5 Association analysis of DDX17-BTG1 genotypes with lymphocyte percentage
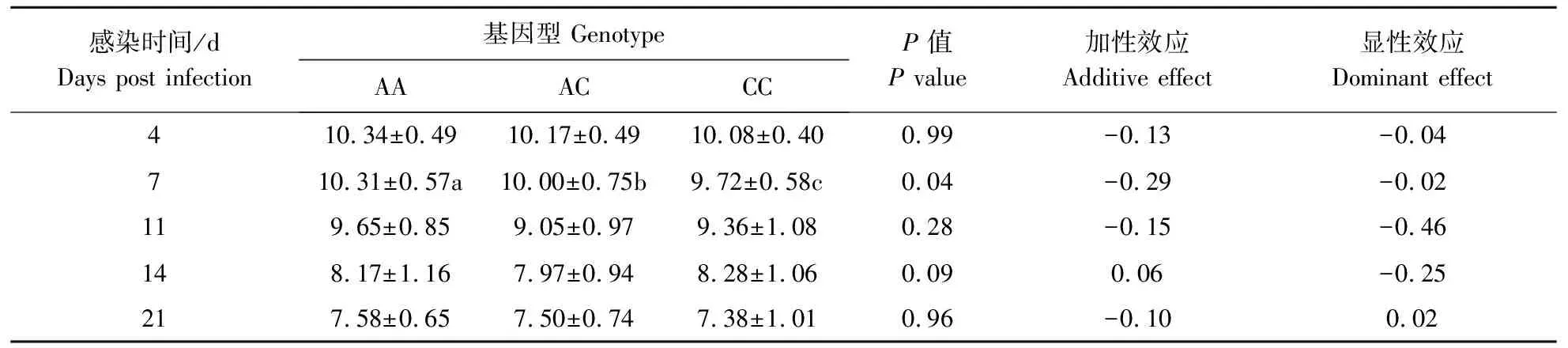
表6 rs81257542位点多态性与血清病毒载量的关联分析 Table 6 Association analysis of rs81257542 polymorphisms with viral load in serum

表7 rs334594334位点多态性与血清病毒载量的关联分析 Table 7 Association analysis of rs334594334 polymorphisms with viral load in serum
2.5 SNP的多态性Tetra-primer ARMS-PCR快速检测方法建立
根据Tetra-primer ARMS-PCR琼脂糖凝胶电泳检测结果的条带数目和扩增片段大小可鉴定不同基因型:3种基因型均可扩增外引物目的条带,杂合子有3条目的条带,纯合子有2条目的条带。在rs81257542位点共检测3种基因型:AA基因型(595/281 bp)、CC基因型(595/364 bp)、AC基因型(595/364/281 bp);在rs334594334位点不同基因型的扩增条带情况:AA基因型(464/194 bp)、TT基因型(464/321 bp)、TA基因型(464/321/194 bp)。扩增条带均符合预期扩增结果,没有非特异扩增条带(图1),表明该检测方法可以准确区分3种基因型。

A:rs81257542; B:rs334594334.图1 rs81257542和rs334594334位点 Tetra-primer ARMS-PCR分型结果Fig.1 Genotyping results of rs81257542 and rs334594334 by Tetra-primer ARMS-PCR
3 讨 论
3.1 DDX17基因多态位点与PRRS抗病指示性状的关联分析
DDX17是一种依赖ATP的RNA解旋酶,参与病毒mRNA合成和降解过程,在病毒入侵和复制过程中发挥重要作用[16-17]。本研究通过对rs81257542位点的基因型检测及其与PRRSV感染前(第0天)和感染后(第4、7、11、14、21天)6个时间点的淋巴细胞百分比进行关联分析,证明了该位点多态性与PRRSV感染后第7天和第11天的淋巴细胞百分比具有显著关联性,且基因型效应和加性效应显著,AA基因型个体的淋巴细胞百分比显著低于AC和CC基因型个体。3种基因型个体在感染后第4天和第7天对应的淋巴细胞百分比和病毒载量呈现淋巴细胞百分比越低病毒载量越高的趋势,这一结果与王媛等[13]的研究结果一致,其中,CC基因型个体具有最高的淋巴细胞百分比和最低的病毒载量,说明CC基因型的个体具有更强的抗病能力,该位点所含等位基因C的数目越多,抗病能力越强。
3.2 BTG1基因多态位点与PRRS抗病指示性状的关联分析
BTG1是抗增殖基因家族的成员之一,该基因首次在慢性B淋巴细胞性白血病上发现[18],能参与细胞的增殖和分化,其抗增殖性在诱导细胞凋亡过程中具有重要的意义[19]。BTG1和BTG2下调mRNA稳定性是T细胞静息状态维持的关键机制[20]。有研究表明B淋巴细胞的增殖活性下降可能引起PRRSV感染后期的免疫抑制和持续感染[21]。本研究中rs334594334和rs329240026位点多态性与感染前和感染后第7天的淋巴细胞百分比具有显著关联性,感染后第11天具有边缘显著的基因型效应。标签SNP rs334594334的淋巴细胞百分比加性效应值在感染前为3.04,感染后7 d和11 d分别高达4.71和6.32,且AA基因型的淋巴细胞百分比最小二乘均值均显著高于TA和TT基因型。AA基因型个体在PRRSV感染后第4天和第7天,具有最高的淋巴细胞百分比和最低的病毒载量,符合PRRSV感染早期淋巴细胞百分比和血清病毒载量负相关的规律[13]。以上结果说明,rs334594334位点的等位基因A为优势等位基因,AA为优势基因型,该位点所含等位基因A的数目越多,抗病能力越强,AA基因型个体具有更强抗病力。
3.3 DDX17-BTG1基因聚合效应
DDX17-BTG1基因聚合的合并基因型与PRRSV感染后第7天的淋巴细胞百分比显著关联,且2个SNP间的聚合效应显著(P<0.05)。前期研究表明,PRRSV感染早期由于机体免疫抑制,会出现短暂的淋巴细胞减少[12-13]。感染后第7天的淋巴细胞百分比可以反映抗病和易感个体免疫应答的差异[13]。C为DDX17的优势等位基因,A为BTG1的优势等位基因,合并基因型CC-AA对应的淋巴细胞百分比的最小二乘均值最高(44.11%),多重比较结果显示,CC-AA与其他7种基因型具有显著差异(P<0.05),因此,DDX17-BTG1的最优合并基因型为CC-AA,与单基因效应结果保持一致。劣势等位基因较多的3种基因型(AA-TT、AA-TA和CA-TT)对应的淋巴细胞百分比均低于35%,且基因型为CA-TT的2个个体在PRRSV感染后7~11 d间陆续死亡。8种不同基因型保持优势等位基因越少淋巴细胞百分比越低的趋势,优势的合并基因型(CC-AA、CC-TA和CA-AA)占总群体的39.6%(63/159),劣势的合并基因型(AA-TT、AA-TA和CA-TT)占总群体的24.5%(39/159),可通过优势基因型筛选抗病个体,进一步改良群体抗病力。
