克氏原螯虾不同生长阶段饲料适宜蛋白水平的研究
2022-02-17杨伟杰莫爱杰杨慧君袁勇超顾泽茂王岳松桂聪
杨伟杰,莫爱杰,杨慧君,袁勇超,2,顾泽茂,2,王岳松,桂聪
1. 华中农业大学水产学院/农业动物遗传育种与繁殖教育部重点实验室/农业农村部淡水生物繁育重点实验室,武汉430070;2.华中农业大学双水双绿研究院/长江经济带大宗水生生物产业绿色发展教育部工程研究中心/湖北省名优鱼育种与健康养殖工程技术研究中心/湖北省水生动物病害防控工程技术研究中心/淡水水产健康养殖湖北省协同创新中心,武汉430070
克氏原螯虾(Procambarusclarkii),俗称小龙虾,原产美洲,1929年经日本传入我国,现已成为我国最为重要的淡水养殖经济虾类之一。据《中国小龙虾产业发展报告(2021)》统计,2020年,我国克氏原螯虾养殖总面积达到145.64万hm2,养殖总产量达到239.37万t。在水产动物规模化养殖中,人工饲料占养殖总成本的50%以上[1]。饲料中适宜的蛋白质水平对维持动物良好的生长性能和健康状态起着至关重要的作用。蛋白水平不足或过量不仅会对养殖对象的生长、蜕壳和免疫产生负面影响,还会增加养殖水体的氮排放,提高养殖成本[2]。
近年来,虽有研究学者围绕克氏原螯虾开展饲料中适宜蛋白水平的相关研究[3-4],但研究对象主要集中在5 g左右的亚成体虾。现有研究表明,仔、幼体生长阶段的水生养殖动物相比于成体前期对饵料中蛋白质的需求量存在明显差异[5-6]。在水生动物中,酶和非酶抗氧化系统是保护生物体免受氧化损伤的第一线,包括超氧化物歧化酶(SOD)、酚氧化酶(PO)等,而膳食蛋白质作为合成各种免疫酶的必需物质,对机体的抗氧化能力和抗菌能力有积极的作用[7]。因此,有必要对不同生长阶段克氏原螯虾的适宜蛋白需求进行精准评估。
本研究以仔虾、幼虾、亚成体虾3个不同生长阶段的克氏原螯虾作为试验对象,通过为期8周的养殖生长试验分析克氏原螯虾的生长性能、饲料利用、肝胰腺抗氧化指标、血清生化指标以及全虾营养成分的变化,明确不同生长阶段克氏原螯虾对饲料适宜蛋白的需求量,旨在为克氏原螯虾绿色优质饲料研制提供理论支持。
1 材料与方法
1.1 试验饲料
试验饲料中蛋白源为鱼粉和酪蛋白等,脂肪源为鱼油和大豆油,碳水化合物来源为小麦淀粉,具体试验饲料配方表见表1。其中,维生素预混料成分(mg或g/kg):维生素B1,15 g;维生素B2,25 g;维生素B6,20 g;维生素B12,50 mg;肌醇,180 g;维生素B3,30 g;维生素B5,40 g;叶酸,5 g;维生素B7,1 mg;维生素A,500万IU;维生素D3,300万IU;维生素K3,10 g;维生素C,150 g;维生素E,60 g;纤维素,415 g。矿物质预混料成分(g/kg):NaF,1.5 g;KI,2.5 g;CoCl2·6H2O,0.1 g;CuSO4·5H2O,10 g;FeSO4·7H2O,40 g;ZnSO4·7H2O,6.0 g;MnSO4·H2O,2.0 g;MgSO4·7H2O,25 g;Ca(H2PO4)2·H2O,15 g;CaCO3,27.8 g。所有饲料原料均过0.425 mm孔径筛网,用原料混合机充分混匀,再加入约300 g/kg蒸馏水使原料形成面团状,然后分别将仔虾、幼虾和亚成体虾试验饲料所对应的面团状混合物通过球团机(霍巴特混合机,型号A200)制成直径为1 mm和2 mm左右的颗粒饲料,置于45 ℃的恒温烘箱中干燥至水分<10%,然后装入密封袋,存储于-20 ℃冰箱中备用。

表1 饲料配方和成分(干物质) Table 1 Feed formula and composition (dry matter) g/kg
1.2 试验动物与饲养管理
试验用虾由华中农业大学双水双绿科研基地(监利县)提供。试验于华中农业大学水产学院室内循环水养殖系统开展。试验前养殖玻璃缸(60 cm×80 cm×60 cm)用高锰酸钾消毒。每个玻璃缸放置1个充气石,24 h开启气泵连续增氧,将30根PVC管(25 cm×7.5 cm)放置在缸中作为克氏原螯虾的栖息场所,降低试验虾的相互残食和应激反应。试验前,克氏原螯虾在实验室条件下暂养2周以适应养殖环境。暂养结束后,选取体格健壮、附肢齐全、规格整齐的克氏原螯虾作为试验对象。试验开始前饥饿24 h,记录克氏原螯虾初始体质量。饲养试验阶段,3个生长阶段都分别设计5种配合饲料。仔虾、幼虾和亚成体虾的初始体质量分别为0.026±0.001、1.04±0.03、5.06±0.17 g。每个生长阶段分别选取450尾试验虾,随机分成5组,每个处理组设置3个重复,每个重复放养30尾。饲养试验进行8周,仔虾和幼虾生长阶段投喂直径为1 mm的试验饲料。亚成体虾投喂直径为2 mm的试验饲料。本试验仔虾和幼虾每日饱食投喂量约为其体质量的5%,亚成体虾每日饱食投喂量为其体质量的3%~5%,养殖期间每2周称体质量1次,同时根据摄食强度、剩饵量、水温等情况及时调整试验虾的投喂量。投喂时间为 07:30和18:00,每餐投喂2 h后,用虹吸法吸出残饵,残饵在蒸馏水中缓慢冲洗,以分离杂质和粪便等其他物质,然后进行干燥和称质量,以计算摄食量。每天记录虾的死亡情况和蜕壳数,每2周清洗1次玻璃缸。试验阶段,每天早晨喂食前,充分清理粪便等污物,换水40%~50%,保持养殖用水水质维持良好状态(pH:7.3~8.1;DO:5.8~7.2 mg/L;水温,24.2~27.1 ℃;氨氮:0.022~0.051 mg/L),缸内水位保持在45 cm。
1.3 样品采集与分析方法
饲料制好后,分别从各组饲料中取100 g放置于自封袋内,做好标记并保存于-20 ℃冰箱中待检测饲料营养成分。采样前试验虾饥饿24 h,记录克氏原螯虾的体质量、存活数等。养殖试验开始前,每个生长阶段随机选取体质量相近的40只克氏原螯虾置于-20 ℃冰箱中保存,试验结束后每缸随机选取10只克氏原螯虾置于-20 ℃冰箱中,上述克氏原螯虾样品用于检测分析体组织营养成分。每个玻璃缸随机选取7只克氏原螯虾用于分离肝胰腺、肌肉样品,肝胰腺液氮速冻,储存在-80 ℃冰箱用于后续酶活性分析;肌肉称质量计算含肉率。参考AOAC(1995)方法分析检测饲料原料、试验饲料及克氏原螯虾的常规生化指标。在105 ℃恒温烘箱中烘干检测试验饲料和全虾中水分含量,粗蛋白质含量采用酸消化处理后用全自动凯氏定氮分析仪(2300 Auto analyzer,Foss Tecator,AB,Hoganas,Sweden)进行分析,粗脂肪用索氏抽提法检测,灰分含量用马弗炉在550 ℃下灼烧分析。超氧化物歧化酶(SOD)和酚氧化酶(PO)的活性均按试剂盒(南京建成生物工程研究所)说明书检测。
1.4 数据分析
采用SPSS 25.0软件统计和分析虾的初始体质量(initial mean body weight,IBW)、终末体质量(final mean body weight,FBW)、增重率(weight gain rate,WGR)、特定生长率(specific growth rate,SGR)、摄食量(feed intake,FI)、饲料系数(feed coefficient ratio,FCR)、存活率(survival,SR)、蛋白质沉积率(protein deposition rate,PDR)、蛋白质效率(protein efficiency ratio,PER)、蜕壳数等数据,以“平均值±标准差”表示,首先进行单因素方差分析(One-way ANOVA),若存在显著性影响,再用Duncan’s法进行多重比较,显著性水平α=0.05。蜕壳数计算公式如下:
平均蜕壳数=∑Nt/nt-1
其中,Nt为 第t天的蜕壳数;nt-1为第t-1天的存活虾数;t为试验时间,d。
2 结果与分析
2.1 克氏原螯虾生长性能和饲料利用
不同饲料蛋白水平对克氏原螯虾仔虾生长性能、成活率、饲料利用和蜕壳频率的影响见表2和图1。WGR随饲料蛋白水平的增加而增加,当饲料蛋白水平超过400 g/kg时,WGR无显著差异(P>0.05)。饲料蛋白水平为300 g/kg组克氏原螯虾SGR最低。蛋白水平从300 g/kg提高到400 g/kg,FCR显著降低(P<0.05),此后保持相对稳定。饲料蛋白水平从300 g/kg提高到500 g/kg,PER和PDR都呈现出下降的趋势。当饲料蛋白水平增加到400 g/kg时,DP逐渐增加。饲料蛋白水平对存活率有显著影响(P<0.05),500 g/kg组成活率最高。随着饲料蛋白水平从300 g/kg提高到400 g/kg,克氏原螯虾的蜕壳数量显著增加(P<0.05)。
由表3和图1可知,饲料蛋白水平显著影响克氏原螯虾幼虾的生长性能、成活率、饲料利用和蜕壳颇率(P<0.05)。饲料蛋白水平为350、400和450 g/kg组克氏原螯虾的WGR和SGR显著高于250和300 g/kg组(P<0.05)。FCR随饲料蛋白水平的升高而降低,然而,当饲料蛋白水平超过350 g/kg,FCR没有显著性差异(P>0.05)。饲料蛋白水平为450 g/kg组克氏原螯虾PER最低。在饲料蛋白水平为450 g/kg时,DP值最高。当饲料蛋白水平超过350 g/kg时,克氏原螯虾的存活率均超过90%。然而,当饲料蛋白水平为300 g/kg时,克氏原螯虾的成活率仅为85.56%。
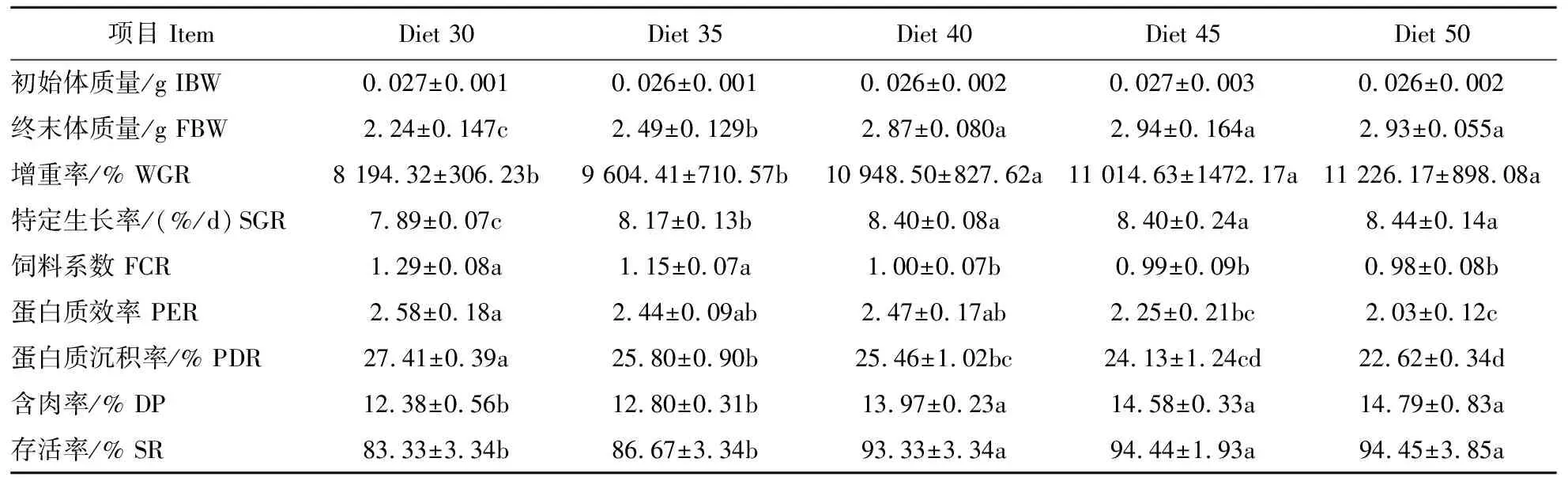
表2 第一生长阶段克氏原螯虾(仔虾)的生长性能和饲料利用效率(n=3) Table 2 Growth performance,feed utilization,and survival of crayfish at first growth stage

表3 第二生长阶段克氏原螯虾(幼虾)生长性能和饲料利用效率 Table 3 Growth performance,feed utilization,and survival of crayfish at second growth stage
饲料蛋白水平对亚成体虾阶段克氏原螯虾生长性能、存活率和饲料利用的影响见表4和图1。饲料蛋白水平为400 g/kg组克氏原螯虾WGR和SGR最高(600.48%,3.48%)。300、350和400 g/kg 组克氏原螯虾WGR和SGR显著高于200 g/kg 组和250 g/kg组(P<0.05)。350 g/kg和400 g/kg组FCR显著低于200 g/kg组(P<0.05)。饲料蛋白水平为400 g/kg组的PER和PDR最低。饲料蛋白水平为400 g/kg组DP最高,200 g/kg组DP最低。存活率和蜕壳频率受蛋白水平影响显著(P<0.05),饲料蛋白水平最高的试验组(400 g/kg)成活率最低,为86.67%。蜕壳频率200 g/kg组最低。
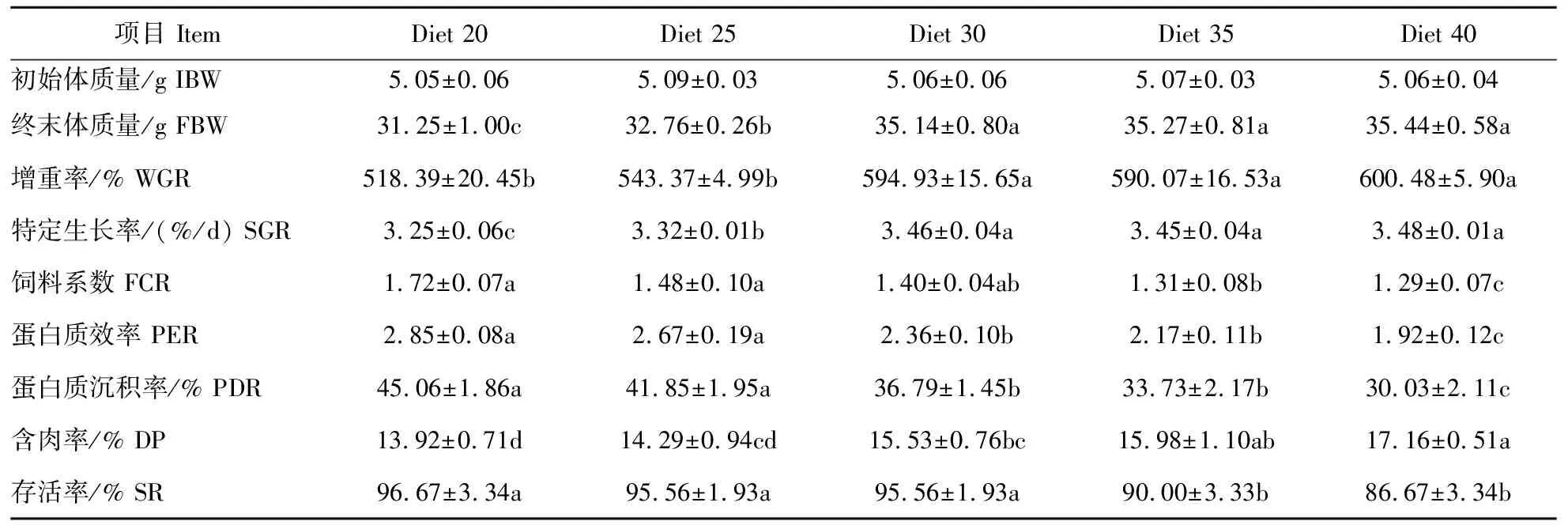
表4 第三生长阶段克氏原螯虾(亚成体虾)生长性能和饲料利用效率 Table 4 Growth performance,feed utilization,and survival of sub-adult crayfish
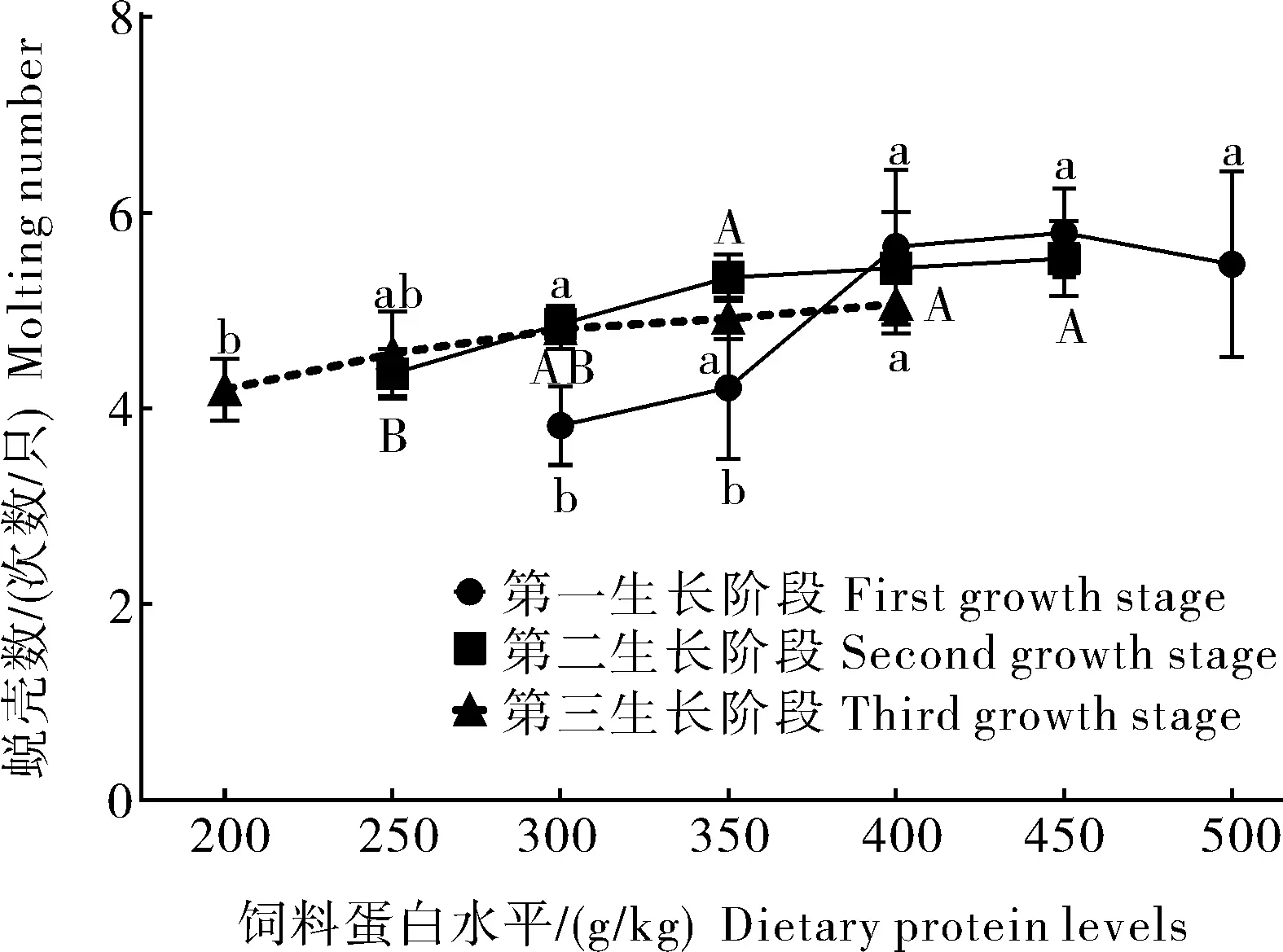
图中每个生长阶段不同的字母表示存在显著性差异(P<0.05),下同。 Date with different letters are significantly different at each stage of growth (P<0.05),the same as below.
对克氏原螯虾特定生长率进行折线模型回归分析,结果显示:在本试验条件下,初始体质量为0.026、1.04和5.06 g左右的克氏原螯虾适宜的饲料蛋白水平分别为403.3、358.8和305.6 g/kg(图2)。
2.2 克氏原螯虾全虾营养成分
由表5可知,仔虾阶段全虾营养成分均受不同饲料蛋白水平的影响。水分含量随饲料蛋白水平的变化呈相反趋势。300 g/kg以上,水分含量差异不显著(P>0.05)。饲料蛋白水平显著影响粗蛋白含量(P<0.05)。300 g/kg组粗蛋白含量最低,500 g/kg组粗蛋白含量最高。450 g/kg组粗脂肪含量最高。
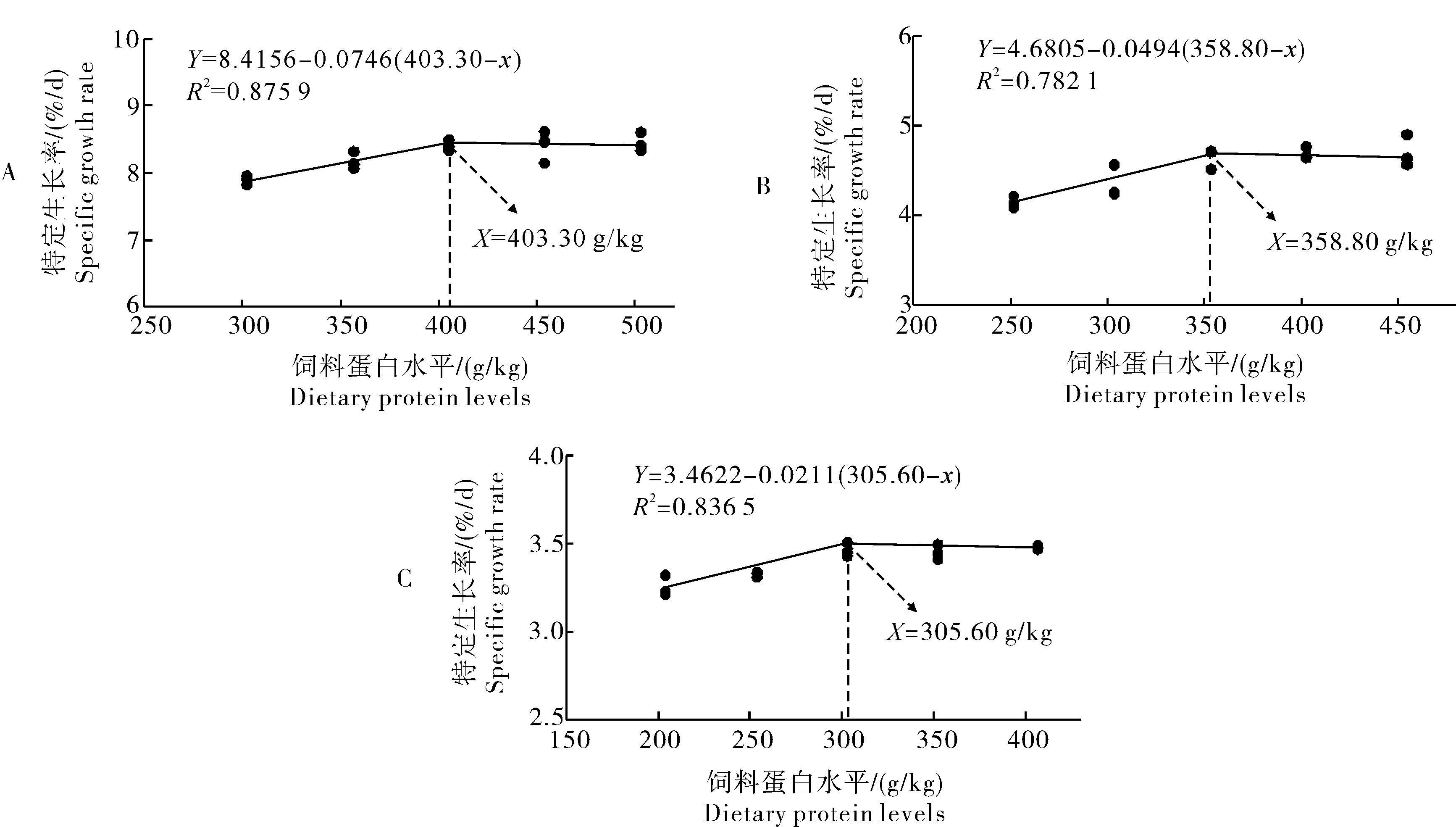
A:第一生长阶段 First growth stage; B:第二生长阶段 Second growth stage; C:第三生长阶段 Third growth stage.图2 克氏原螯虾饲料蛋白水平与SGR的关系Fig.2 Relationship between dietary protein levels and SGR of crayfish

表5 第一生长阶段克氏原螯虾(仔虾)全虾营养成分 Table 5 Whole body composition (percentage wet weight) of crayfish at first growth stages %
幼虾阶段,粗蛋白、灰分和粗脂肪含量随着饲料蛋白水平的提高显著增加(P<0.05);450 g/kg组的粗蛋白含量最高,显著高于250、300和350 g/kg组(P<0.05)。饲料蛋白水平为450 g/kg 组粗脂肪含量最高,但与400 g/kg组没有显著差异。饲料蛋白水平为250 g/kg组水分含量最高。详情见表6。
由表7可见,亚成体虾阶段,各处理组间水分、灰分和粗脂肪含量差异不显著(P>0.05)。粗蛋白含量随饲料蛋白水平的增加而增加。饲料蛋白水平超过250 g/kg后,各组间粗蛋白质含量无显著差异(P>0.05)。

表6 第二生长阶段克氏原螯虾(幼虾)全虾营养成分 Table 6 Whole body composition (percentage wet weight) of crayfish at second growth stages %
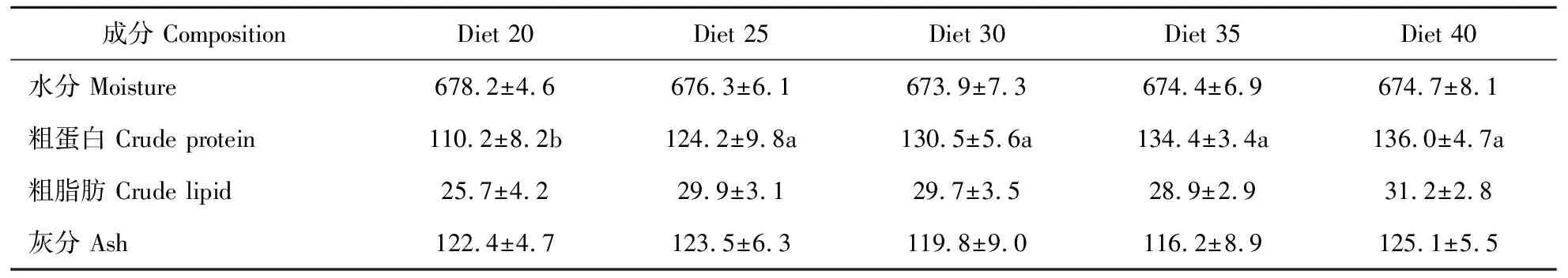
表7 第三生长阶段克氏原螯虾(亚成体虾)全虾营养成分 Table 7 Whole body composition (percentage wet weight) of crayfish at third growth stages %
2.3 饲料蛋白水平对SOD活性和PO活性的影响
由图3可见,仔虾阶段,随着饲料蛋白水平的提高,SOD活性显著提高(P<0.05),蛋白水平达到400 g/kg时趋于稳定。幼虾阶段,饲料蛋白水平为250 g/kg的试验组SOD活性显著低于其他组(P<0.05)。相反,在亚成体虾阶段,随着饲料蛋白水平的提高,SOD活性显著降低(P<0.05)。

图3 不同生长阶段克氏原螯虾肝胰腺SOD活性Fig.3 SOD activities in hepatopancreas of crayfishat different growth stage
由图4可知,不同生长阶段克氏原螯虾肝胰腺PO活性受到饲料蛋白水平的影响。仔虾阶段,400、450和500 g/kg组PO活性均高于300 g/kg组。幼虾阶段,PO活性随着饲料蛋白水平从250 g/kg增加到300 g/kg显著增加(P<0.05),此后PO活性保持相对稳定。亚成体虾阶段,当饲料蛋白水平为350 g/kg和400 g/kg时,肝胰腺PO活性低于饲料蛋白水平为200、250和300 g/kg组。
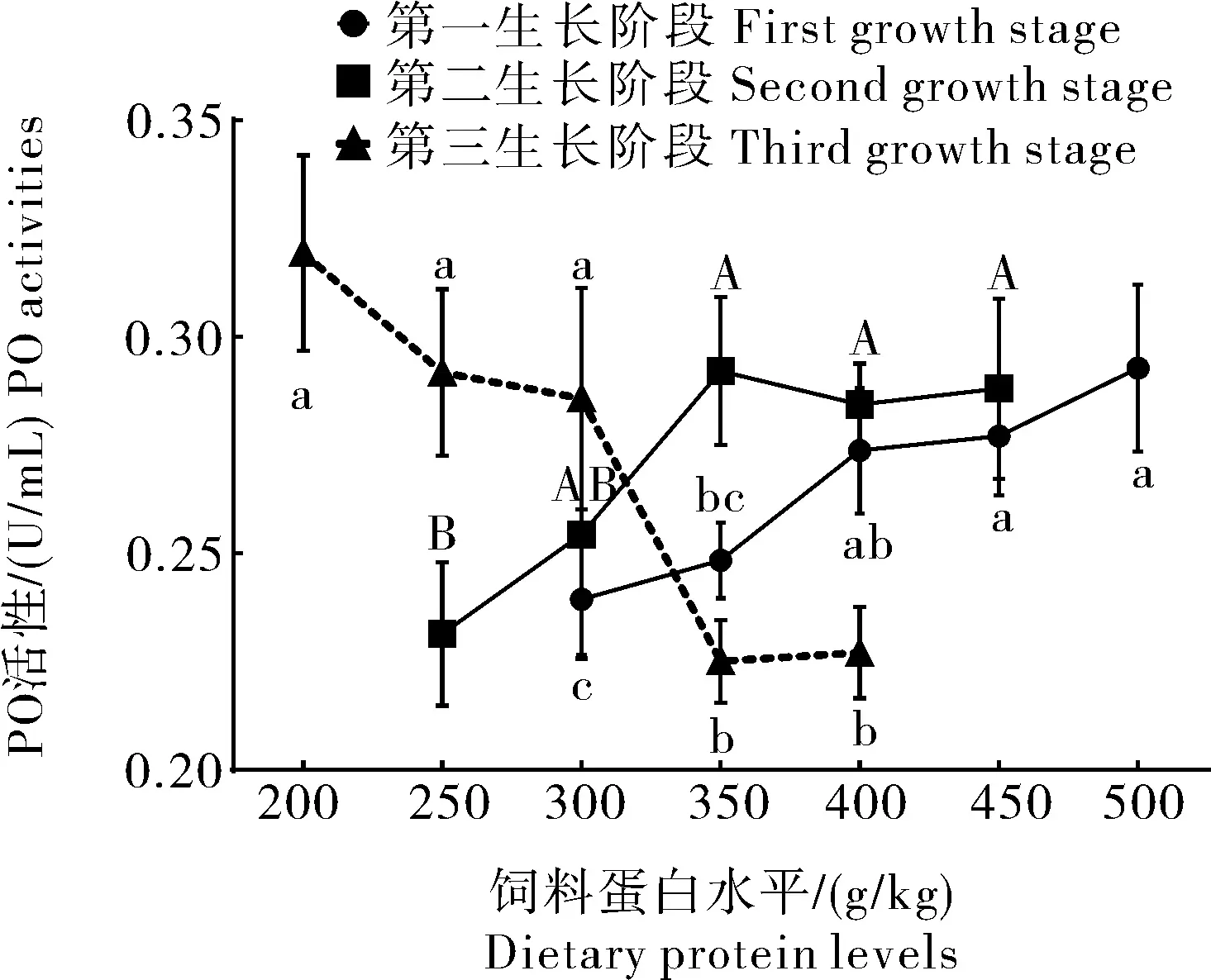
图4 不同生长阶段克氏原螯虾肝胰腺PO活性Fig.4 Phenoloxidase activities in hepatopancreas of crayfish at different growth stage
3 讨 论
本研究结果表明,在一定范围内,不同生长阶段的克氏原螯虾对饲料蛋白质的需求存在明显差异。3个不同生长阶段的克氏原螯虾增重率均随蛋白水平升高而表现出显著提高。然而,仔虾阶段当饲料蛋白水平高于400 g/kg、幼虾阶段高于350 g/kg、亚成体虾阶段高于300 g/kg时,其增重率并没有表现出随蛋白水平的上升而显著上升。上述现象可能是饲料中过高的蛋白质超过养殖对象生长所需之后,多余的蛋白质主要通过脱氨分解来供能,增加了机体的氮代谢负担导致[8]。对克氏原螯虾的特定生长率进行折线模型回归分析,结果显示在本试验条件下,初始体质量为0.026、1.04和5.06 g左右的克氏原螯虾适宜的饲料蛋白水平分别为403.3、358.8和305.6 g/kg,仔虾阶段对饲料蛋白质的需求要显著高于幼虾和亚成体虾,这与之前的报道一致[9]。然而,本研究发现,在亚成体虾阶段,适宜的饲料蛋白水平高于文献[5]所报道的270 g/kg,这可能是由于试验饲料原料和饲养条件等因素不同所致[10]。
3个不同生长阶段克氏原螯虾的PER均与饲料蛋白水平在一定范围内呈显著性负相关,说明饲料中蛋白质超过一定水平之后,饲料蛋白质效率反而降低。Farahiyah 等[11]也报道了类似的结果,他们发现给何氏细须鲃(Leptobarbushoevenii)投喂蛋白质水平最低的饲料时,PER达到最高。这可能是因为鱼类摄食高蛋白水平的饲料时,部分蛋白质用作能量被消耗,减少了组织中蛋白质的沉积[12]。本研究中,在一定范围内,随着饲料蛋白水平的提高,3个不同生长阶段克氏原螯虾粗蛋白水平均有所提高。但是,饲料蛋白达到一定水平时,粗蛋白含量不再显著增加。这一发现与文献[5]报道的结果一致。
甲壳类动物的蜕皮是一种周期性、大量耗能的过程,由特殊组织合成的蜕皮激素控制,这对甲壳类动物的自然生长发育至关重要。在快速生长期,蜕壳频率显著增加[1]。有研究者通过探究幼梭子蟹(Portunustrituberculatus)的生长和蜕壳性能,确定幼梭子蟹饲料中添加卵磷脂的最佳量[13]。一些甲壳类动物可以利用胆固醇合成蜕皮激素,但它们自身不能合成胆固醇,只能从食物中获得[14]。本试验结果显示,3个不同生长阶段克氏原螯虾蜕壳频率都随着饲料蛋白水平在一定范围内增加而显著性增加。Moullac等[15]也报道了类似的结果,推测当蛋白质利用率超过南美白对虾(Penaeusvannamei)幼虾的阈值时,肝胰腺会被触发,建立一个对蜕皮、生长和繁殖的响应储备机制。
在农业养殖中,动物的健康是不可忽视的,包括克氏原螯虾在内的大多数甲壳类动物缺乏真正的自适应免疫系统,主要依赖于非特异性免疫[16]。酚氧化酶(PO)被认为是评估甲壳类非特异性免疫状况的具体指标[17-18]。在本研究中,仔虾阶段和幼虾阶段饲料蛋白水平分别在30%和35%的试验组PO活性最低。同时,存活率随着饲料蛋白水平的提高而提高。这些结果进一步支持了营养不足损害免疫反应并改变对感染和疾病易感性的假设[19]。亚成体虾阶段,蛋白质水平为300、350和400 g/kg的饲料导致克氏原螯虾蜕壳频率显著增加。PO参与蜕壳后角质层的形成[20],蜕壳过程持续十到几十分钟,此时,由于外壳还没有变硬,非常柔软,没有很强的攻击和躲避能力,易受敌人攻击和病原体感染[21]。此外,蜕壳频繁的克氏原螯虾很容易被同类残食,导致高蛋白饲料组克氏原螯虾的成活率降低。
水生动物的抗氧化防御系统可以去除有毒的ROS,保护组织免受氧化损伤[22]。据报道,抗氧化酶和蛋白质在应对环境污染物诱导的应激和中和过量ROS方面发挥重要作用[23]。SOD系统通过将O2-转化为H2O2提供了对抗氧化应激的第一道防线,从而防止了O2-对身体的直接伤害,随后有毒的H2O2被CAT和GSH-Px进一步消除[24-25]。本研究结果表明,随着饲料蛋白质水平的升高,仔虾阶段和幼虾阶段克氏原螯虾的SOD活性显著升高,然后趋于稳定。这可能是由于在克氏原螯虾生长早期蛋白质需求量大,提供蛋白质含量较高的饲料,有利于提高其抗氧化酶活性从而降低体内的氧化应激。亚成体虾阶段,饲料高蛋白水平350 g/kg和400 g/kg组克氏原螯虾的SOD活性显著低于其他组。可能原因是亚成体虾对饲料蛋白质需求较低,当饲料蛋白质水平过高时,体内过多的蛋白质水解生成大量ROS并且损伤机体,抑制SOD活性[26]。
