哈密瓜脱氢抗坏血酸还原酶基因的鉴定及冷胁迫表达分析
2022-02-16周发科杨新泉单春会唐凤仙
宋 文,张 琴,宁 明,周发科,杨新泉,单春会,唐凤仙
(石河子大学食品学院,新疆特色果蔬贮藏加工教育部工程研究中心,新疆 石河子 832000)
哈密瓜(Cucumis melovar.saccharinus)属于葫芦科黄瓜属甜瓜亚属的一个品种,得名于清代康熙年间,古称 “甘瓜”、“甜瓜”,维吾尔语称“库拱”[1-2]。新疆栽培哈密瓜已有4 000多年的历史,不仅是我国甜瓜栽培历史最悠久、种植面积最大、品种资源最丰富、品质最佳的地区,也是世界甜瓜种植基地之一,其在吐哈盆地独特的地理、生态条件下,通过世代相传的特殊栽培技术,形成了哈密瓜特有的品质[2]。新疆哈密瓜不仅美味可口,而且营养丰富,富含糖分、果胶物质、纤维素、苹果酸、维生素以及钙、磷、铁等元素,适宜于肾病、胃病、咳嗽痰喘、贫血和便秘患者。作为我国新疆地区主要的经济作物之一,哈密瓜对当地经济发展起重要作用。由于新疆地域辽阔、交通运输不便,因此低温贮藏是使用广泛的果蔬保鲜方式之一[3]。然而长时间的低温贮藏会导致哈密瓜发生冷害,加快哈密瓜表皮的凹陷、褐变以及腐烂,从而影响经济效益[4]。因此从分子生物学角度研究哈密瓜的耐冷机制对提高哈密瓜耐冷性具有重要意义。
冷胁迫是影响植物生长发育的主要环境因素之一,会刺激植物在体内产生并积累活性氧、丙二醛、过氧化氢等有毒物质,破坏细胞质膜,引起细胞内代谢紊乱,最后导致细胞与组织的死亡,从而影响植物的生长[5-6]。植物在进化过程中产生了一系列复杂的保护机制适应环境胁迫对其产生的影响,其中谷胱甘肽(reduced glutathione,GSH)抗氧化系统属于植物体内氧自由基清除体系的主要防御措施之一[7]。
谷胱甘肽-S-转移酶(glutathione S-transferase,GST)是一种多功能酶,可以催化GSH和疏水及亲电底物的共价结合,形成共轭物,隔离在液泡或转移到质外体,从而对内源和外来有害物质进行降解,以达到降低细胞损害程度的作用[8-9]。典型的GST蛋白含有两个功能位点:一个是N-末端结构域中的GSH结合位点(G-位点),另一个是C-末端共底物结合结构域(H-位点)[10]。通常GST被分为7 类,包括Tau(GSTU)、Phi(GSTF)、Lambda(GSTL)、Theta(GSTT)、Zeta(GSTZ)、四氯氢醌脱卤素酶(tetrachlorohydroquinone dehalogenase,TCHQD)和脱氢抗坏血酸还原酶(dehydroascorbate reductase,DHAR)[11]。作为植物特有的一类GST,DHAR可将GSH作为还原剂,催化脱氢抗坏血酸(dehydroascorbic acid,DHA)还原为抗坏血酸(ascorbic acid,AsA),从而保护植物组织免受活性氧的损害[12]。
前期研究发现,与不耐冷型哈密瓜相比,耐冷型哈密瓜GST相关差异蛋白在冷胁迫初期显著上调表达[3]。本研究在生物信息学的基础上对哈密瓜DHAR基因(CmDHAR)进行鉴定分析,随后利用实时反转录聚合酶链式反应(real-time reverse transcription-polymerase chain reaction,real-time RT-PCR)技术分析冷胁迫下的基因表达情况,以期为进一步揭示DHAR基因在哈密瓜抵御冷胁迫过程中参与的反应机理奠定基础。
1 材料与方法
1.1 材料与试剂
耐冷型哈密瓜“伽师瓜-310”(JS)与不耐冷型哈密瓜“金皇后-308”(GE)果实,2019年7—9月采购自新疆石河子121团农场。样品成熟度为八成熟、大小均匀、无机械损伤及病虫害。采后套泡沫网套直接置于(0.5±0.5)℃冷库中贮藏0、6、12、18、24 d,从果实赤道周围3个位置的外表皮内层1~2 mm处采集果肉1.2~1.5 g并立即用液氮冷冻,随后保藏于-80 ℃超低温冰箱。每个品种每次实验选取3个果实,进行3 次生物学重复。
Plant DHAR ELISA检测试剂盒、Plant AsA ELISA检测试剂盒 上海优选生物科技有限公司;UNlQ-10柱式Trizol总RNA抽提试剂盒 生工生物工程(上海)股份有限公司。
1.2 仪器与设备
WD-2102A多功能酶标仪 美国伯腾仪器有限公司;HC-2518R高速冷冻离心机 安徽中科中佳仪器有限公司;ZXRD-7080恒温鼓风干燥箱 河北润创科技开发有限公司;LightCycler480 II型荧光定量PCR仪瑞士Rotkreuz公司;FA201S万分之一分析天平 上海天平仪器厂。
1.3 方法
1.3.1CmDHAR基因生物信息学分析
从哈密瓜数据库Cucurbit Genomics Database(http://cucurbitgenomics.org)中获取哈密瓜(Melon(DHL92)genome 3.5.1)的氨基酸序列及结构文件。从拟南芥(Arabidopsis thaliana)数据库TAIR(https://www.arabidopsis.org)获取拟南芥DHAR(AtDHAR)的氨基酸序列及结构文件。从EnsemblPlants(http://plants.ensembl.org/index.html)获取水稻(Oryza sativa Japonica)DHAR(OsDHAR)的氨基酸序列及结构文件。随后通过与拟南芥和水稻DHAR氨基酸序列进行多序列比对、筛选,鉴定得到了哈密瓜的DHAR基因。
通过NCBI(https://www.ncbi.nlm.nih.gov)中的Protein BLAST工具鉴定筛选获得CmDHAR的可靠性。利用在线工具CD-search(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)鉴定CmDHAR基因的保守功能域;利用ExPASy(http://web.expasy.org/protparam/)对CmDHAR成员编码蛋白的分子质量、等电点和氨基酸长度进行分析;使用Softberry(www.softberry.com)对CmDHAR成员进行亚细胞定位;使用Clustal Omega(https://www.ebi.ac.uk/Tools/msa/clustalo/)进行多序列比对分析;使用MEGA7软件,采用邻比法(Neighborjoining,NJ)构建物种间系统进化树;使用MCScanX和TBTools(https://github.com/CJ-Chen/TBtools)完成共线性分析[13];使用MEME(http://meme-suite.org)对CmDHAR功能基序进行分析;使用PlantCare(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对CmDHAR顺式作用元件进行预测;使用STRING(https://string-db.org/cgi/input.pl)对CmDHAR与哈密瓜其他GST家族蛋白之间的相互作用进行分析;SWISSMODEL(https://swissmodel.expasy.org/interactive)用于对CmDHAR的蛋白质三级结构进行预测;使用基因集富集分析(gene set enrichment analysis,GSEA)软件对CmDHAR进行分析[14]。
1.3.2 CmDHAR活力及AsA含量测定
设置标准品孔和样本孔后按照ELISA检测试剂盒使用说明书进行操作,在450 nm波长下使用酶标仪测定OD值,通过标准曲线计算样品CmDHAR活力及AsA含量。
1.3.3 哈密瓜总RNA提取
采用UNlQ-10柱式Trizol总RNA抽提试剂盒分别从哈密瓜表皮内层1~2 mm处的果肉提取总RNA。使用Primer Premier 5.0软件设计引物,引物由生工生物工程(上海)股份有限公司合成(表1)。

表1 Real-time RT-PCR序列Table 1 List of primer sequences used for real-time RT-PCR
1.3.4CmDHAR基因的real-time RT-PCR验证
以GAPDH(LOC103484230)为内参基因,选取CmDHAR基因,通过real-time RT-PCR对其在冷胁迫下的基因表达水平进行测定。利用SYBRGreen染料法在ABI2700系统上开展real-time RT-PCR检测。反应条件如下:95 ℃预变性3 min,95 ℃变性5 s;60 ℃退火30 s,65 ℃延伸25 s(40 个循环),进行3 组生物学重复,基因的表达量采用2-ΔΔCt方法计算。
1.4 数据分析
使用Excel 2016、SPSS 19.0和Origin软件进行数据处理和图形绘制。
2 结果与分析
2.1 CmDHAR基因的基本信息
将筛选获得的2个CmDHAR基因,根据GST系统命名法分别命名为CmDHAR1(MELO3C020204T1)与CmDHAR2(MELO3C023826T1)。由表2可知,2个CmDHAR基因编码蛋白氨基酸的长度分别为CmDHAR1(297 aa)与CmDHAR2(206 aa),等电点分别为CmDHAR1(8.67)与CmDHAR2(5.99),分子质量分别为CmDHAR1(33 082.9 Da)与CmDHAR2(22 891.6 Da)。亚细胞定位结果表明,2个CmDHAR基因主要位于叶绿体中。染色体定位显示CmDHAR1位于哈密瓜6号染色体,CmDHAR2位于哈密瓜10号染色体。此外,CD-search结果表明,2个哈密瓜CmDHAR均包含可以结合GSH的GST-N末端功能结构域(CmDHAR1:1~297;CmDHAR2:3~203)。
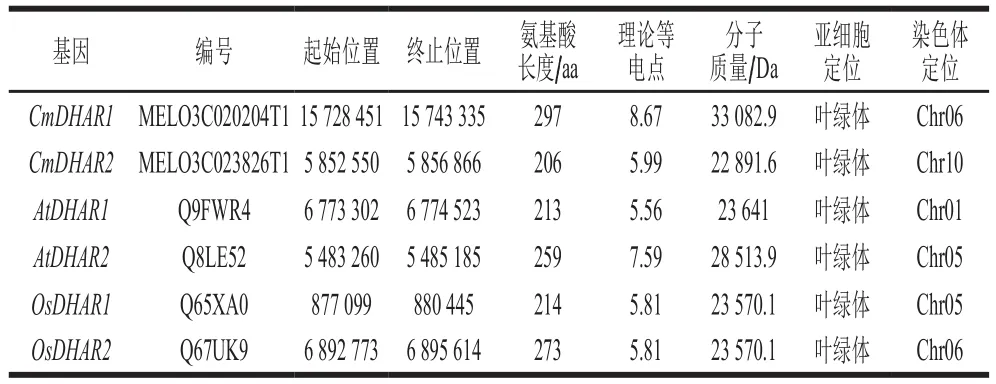
表2 哈密瓜及其他物种DHAR基因基本信息Table 2 Physicochemical properties of DHAR genes in Hami melon and other species
2.2 CmDHAR系统进化与多序列比对分析
基于NJ构建的系统进化树显示,CmDHAR1与Q8LE52AtDHAR2为直系同源基因;CmDHAR2与Q9FWR4AtDHAR1为直系同源基因。结果表明,相比于OsDHAR,CmDHAR与AtDHAR之间的同源性更高(图1)。
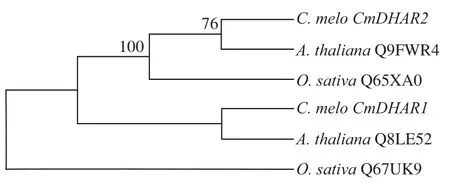
图1 CmDHAR的系统进化树Fig. 1 Phylogenetic tree of CmDHAR
基于系统进化树分析,将CmDHAR的氨基酸序列与AtDHAR和OsDHAR的氨基酸序列进行多序列比对分析。图2表明,CmDHAR基因与AtDHAR和OsDHAR基因之间的氨基酸序列保守性较高,说明CmDHAR与AtDHAR和OsDHAR在抵御胁迫过程中具有类似的功能[15-16]。此外,在CmDHAR的蛋白中还找到了12个GSH结合位点(G-site)与9 个磷酸化位点。

图2 哈密瓜与其他DHAR的蛋白氨基酸序列比对分析Fig. 2 Multiple sequence alignments of DHAR from Hami melon and other species
2.3 CmDHAR基因结构分析
由图3可知,CmDHAR基因包含6个外显子与6个保守基序,这与Q8LE52AtDHAR2和水稻DHAR的基因结构相似,再次证明DHAR基因的高度保守性,说明它们在功能上具有一定的相似性[17]。除了CmDHAR2,其他DHAR均包含motif 5,表明在进化过程中CmDHAR2缺失了这段氨基酸序列,也说明CmDHAR在进化过程中会存在一定的差异[18]。

图3 哈密瓜与其他植物DHAR的基因结构(A)与功能基序(B)预测Fig. 3 Gene structure (A) and motif (B) prediction of DHAR in Hami melon and other plants
PlantCare预测结果表明CmDHAR基因包含10 种顺式作用元件(表3),它们可以分为3 大类:胁迫相关作用元件(WUN-motif、MBS与W box)、植物激素作用元件(TCA-element、TGA-element、TGACG-motif与CGTCA-motif)及光反应作用元件(GT1-motif、I-box与MRE)[19-20]。CmDHAR1包括TGA-element、TGACG-motif、CGTCA-motif等植物激素作用元件与光反应作用元件GT1-motif和MRE。有研究表明植物激素、光合作用等在调节植物生长发育、抵御胁迫方面起到关键作用[5,21]。CmDHAR2包括胁迫相关作用元件WUN-motif、MBS和W box,植物激素作用元件TCA-element及光反应作用元件I-box。其中WUN-motif作用元件与抵御冷胁迫相关[22],MBS作用元件是抗逆因子MYB的结合位点[23]。综上所述,推测CmDHAR在抵御胁迫方面发挥着重要作用。
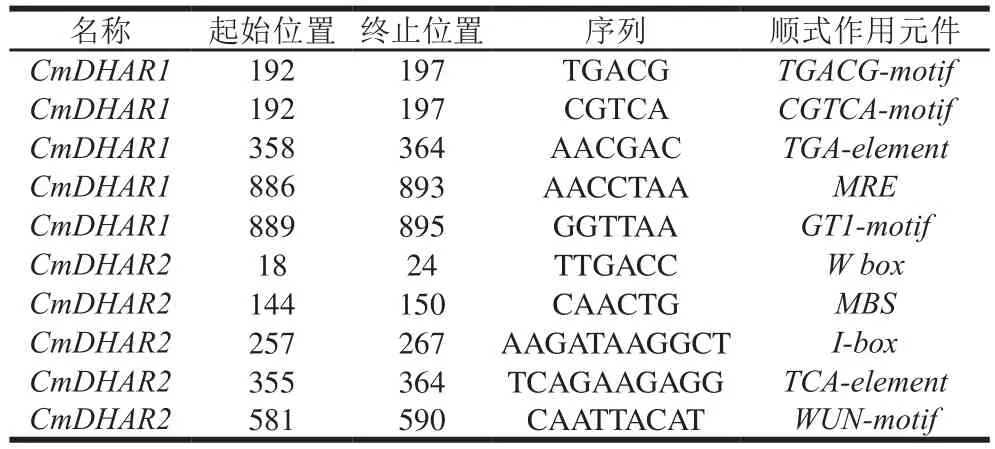
表3 哈密瓜CmDHAR基因顺式作用元件Table 3 Cis-elements of CmDHAR genes in Hami melon
2.4 CmDHAR共线性分析
为进一步了解DHAR的进化关系,利用MCScanX和TBtools软件对葫芦科植物的DHAR基因进行共线性分析。图4说明CmDHAR基因与其他葫芦科植物中的DHAR基因之间存在明显的共线性关系。哈密瓜与西瓜存在1 对同源基因对,与黄瓜存在2 对同源基因对,与西葫芦、笋瓜和南瓜之间各存在3 对同源基因对,说明在物种进化过程中,哈密瓜与西葫芦、笋瓜和南瓜更为接近。此外,CmDHAR2与其他5个物种至少存在1 对同源基因对,推测CmDHAR2在这6个物种分化前已经存在,也证明CmDHAR2在进化过程中十分重要。

图4 哈密瓜与其他物种DHAR的共线性分析Fig. 4 Synteny analysis of DHAR from Hami melon and other species
非同义突变频率(Ka)与同义突变频率(Ks)的比值结果表明,8 对同源基因对的Ka/Ks<1,说明它们在进化过程中发生了纯化选择,避免了对自身不利的变异(表4)[24-25]。基因倍增时间估算结果表明,这8 对同源基因对倍增的时间大约发生在0.65~3.5百万年前。
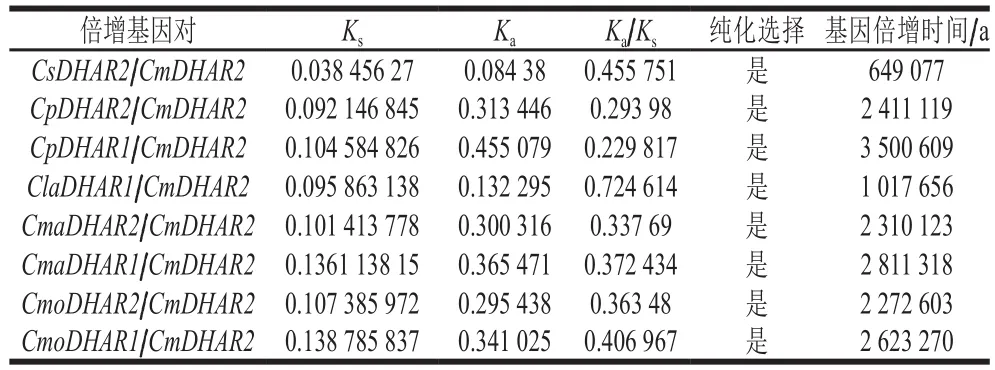
表4 哈密瓜及其他物种DHAR基因复制分析Table 4 Duplication analysis of DHAR genes in Hami melon and other species
2.5 CmDHAR的蛋白互作分析
蛋白质之间通过相互作用在生物体内行使其相应的生物学功能[26]。蛋白-蛋白网络互作分析结果表明(图5),CmDHAR成员与其他哈密瓜GST成员之间相互作用效果明显。因此推测,在响应胁迫过程中,DHAR可以有效调节其他家族蛋白共同发挥作用,参与一系列生化反应帮助哈密瓜抵御胁迫。CmDHAR与其他哈密瓜GST家族蛋白的具体互作机制将在日后进行深入研究。

图5 CmDHAR及其他GST家族蛋白之间互作网络图Fig. 5 Protein-protein interaction networks of CmDHAR with other CmGST members in Hami melon
2.6 CmDHAR三级模型的预测
蛋白质二级结构预测结果表明CmDHAR主要包括α-螺旋、无规卷曲、延伸链和β-转角4 种构象,其中在CmDHAR1中:α-螺旋(43.10%)、无规卷曲(42.76%)、延伸链(10.44%)和β-转角(3.70%);在CmDHAR2中:α-螺旋(45.63%)、无规卷曲(38.83%)、延伸链(9.71%)与β-转角(5.83%)。
基于同源建模法,在SWISS-MODEL中以毛果杨DHAR(ID:5mye.1.A;5n9u.1.A)为模板[27],分别预测了CmDHAR1与CmDHAR2的蛋白三级结构,其中CmDHAR2与5n9u.1.A的序列相似性为73.53%,GMQE为0.80,QMEAN为-2.69,说明模板能较好地拟合CmDHAR2的三维结构[28]。ProQ三级模型质量评估结果表明CmDHAR2的LGscore为4.375,MaxSub为0.366,证明模型预测的可靠性较高[29]。图6表明,CmDHAR2蛋白主要由α-螺旋(紫色)、无规卷曲(白色)、延伸链(黄色)和β-转角(青色)构成。在CmDHAR2蛋白中找到了12个GST-N末端功能结构域的GSH结合位点(G-site),包括20C、22F、25R、44L、47K、58G、59K、60V、61P、72D、73S与202K。其中,20C、22F、25R、72D和73S 位于α-螺旋;58G、59K 与202K位于无规卷曲;60V与61P 位于延伸链;44L与47K位于β-转角。22F参与疏水互作;25R、60V、61P、72D与73S构成氢键;47K构成盐桥。这12个G-sites均位于CmDHAR2蛋白的表面,有利于CmDHAR2与GSH的结合[19]。

图6 CmDHAR2蛋白质三级模型预测Fig. 6 Deduced 3D structure of CmDHAR2
2.7 CmDHAR基因响应冷胁迫的表达分析
由图7可知,低温贮藏对GE的影响更大。在冷藏第12天时,GE表皮开始出现褐变并产生凹陷,随着贮藏时间的延长,GE的冷害程度越来越严重。相比于GE,JS在第18天表皮开始产生凹陷,受冷害影响的程度较小。由此可知,在响应低温胁迫时,JS与GE内部抵御氧化胁迫体系的差异性决定了它们在贮藏过程中品质变化的差异性。

图7 低温贮藏过程中哈密瓜外观状态Fig. 7 Appearance of Hemi melon fruits after cold storage
DHAR与AsA循环系统在植物抵御氧化胁迫过程中具有重要作用[30]。从图8可以看出,随着贮藏时间的延长,耐冷型JS和不耐冷型GE果实中CmDHAR活力呈现先上升后下降的趋势。在0~12 d,JS中的CmDHAR活力均高于GE,且在第12天时差异极显著(P<0.01),随后酶活力逐渐降低。在GE中,CmDHAR活力在第18天达到最高值,随后活力下降(图8)。AsA含量随贮藏时间延长逐渐降低,但其在JS中的含量高于GE,说明在响应低温胁迫过程中,AsA扮演着重要角色[31]。结果表明,CmDHAR活力快速、高水平的表达有利于提升哈密瓜对低温环境的适应能力,从而降低冷害的损伤,能够较好地维持哈密瓜的商品价值[32]。
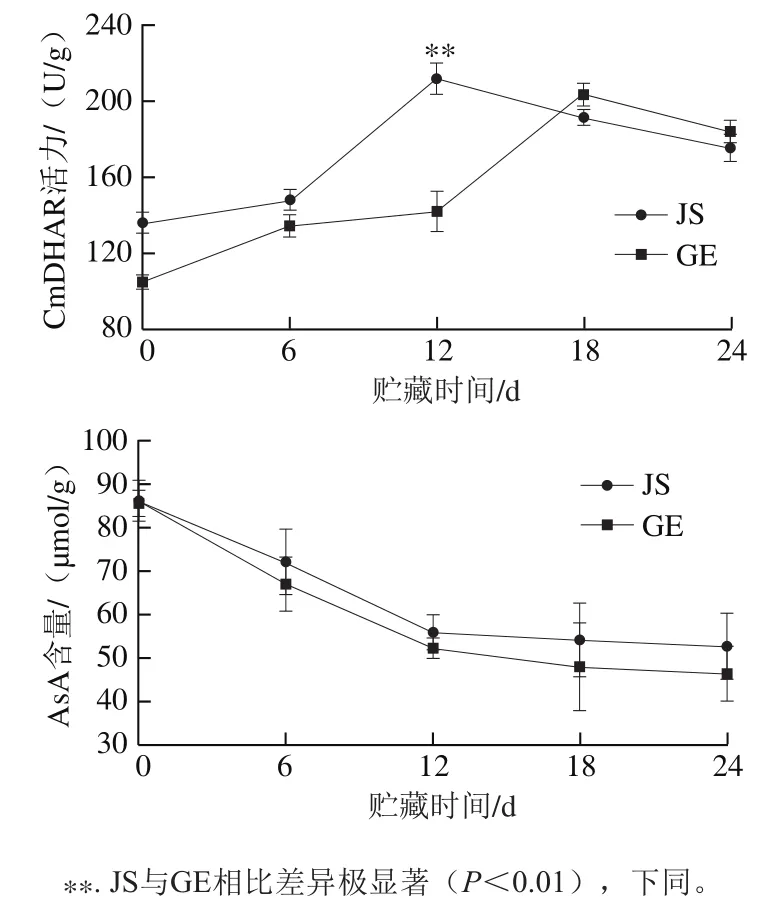
图8 低温贮藏过程中CmDHAR活力和AsA含量的变化Fig. 8 Effect of cold storage on CmDHAR activity and AsA content in Hemi melon
利用real-time RT-PCR验证哈密瓜CmDHAR1与CmDHAR2基因在冷胁迫下的表达情况(图9)。随着贮藏时间的延长,CmDHAR1和CmDHAR2均为上调表达。与GE相比,CmDHAR1与CmDHAR2在JS中的相对表达量更高,说明CmDHAR基因在响应冷胁迫过程中的重要性,它的大量表达可以延缓冷害发生[33]。
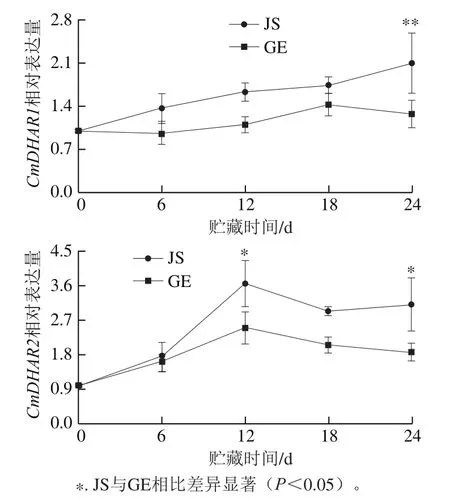
图9 低温贮藏过程中CmDHAR基因表达的变化Fig. 9 Effect of cold storage on the expression levels of CmDHAR genes
2.8 CmDHAR GSEA
基于基因表达结果,使用GSEA对CmDHAR进行功能注释,结果表明CmDHAR的高表达与结构分子活性、大分子复合物、细胞膜封闭内腔以及抗氧化活性等生物学功能显著关联(图10)。GSEA结果说明在冷胁迫下,CmDHAR可以通过参与上述生物学过程调节生化反应,从而响应冷胁迫。


图10 CmDHAR 基因GSEA功能富集结果Fig. 10 GSEA analysis of CmDHAR genes
3 讨 论
DHAR属于GST中的一类抗氧化酶,具有谷胱甘肽依赖性硫醇转移酶和DHAR活性,是AsA循环系统的关键组成部分,参与氧化还原稳态,可以清除氧化应激下产生的活性氧自由基[34-35]。Noshi等[36]研究发现AtDHAR1在拟南芥抵御光氧化胁迫中起关键作用。Dixon等[35]认为AtDHAR参与氧化还原反应,并且在清除活性氧自由基过程中发挥重要作用。Ushimaru等[37]将水稻中OsDHAR1基因提取并在拟南芥中进行表达,结果发现与野生品种(空白对照组)相比,导入OsDHAR1基因的拟南芥耐盐性有所提高。Yin Guangkun等[38]研究发现OsDHAR1活力的下降会导致水稻更容易受到活性氧的损害。Loi等[30]对马铃薯进行外源施加霉菌毒素处理,实验结果表明处理组的DHAR、DHA及GSH含量有所提升,表明马铃薯DHAR在参与响应氧化胁迫的过程中发挥重要作用。
本研究对2个CmDHAR基因进行鉴定并研究了冷胁迫下的酶活力及基因表达水平,确定了CmDHAR基因在响应冷胁迫过程中扮演重要角色。根据CmDHAR在染色体的分布位置将其分别命名为CmDHAR1和CmDHAR2。CmDHAR1位于哈密瓜6号染色体,CmDHAR2位于哈密瓜10号染色体。系统进化树结果表明CmDHAR基因与AtDHAR基因的同源性更高。多序列比对结果表明CmDHAR基因的GST-N末端功能结构域在进化过程中序列保守性较高,因此更有利于G-site与GSH的结合[39-40]。CmDHAR基因与拟南芥和水稻中参与抗氧化过程的DHAR基因的氨基酸序列保守性较高,说明CmDHAR基因在抵御胁迫过程中具有相似的功能。基因结构分析结果表明CmDHAR包含6个外显子、6个保守基序、3大类顺式作用元件,由于结构上是保守的,再次证明CmDHAR与拟南芥和水稻DHAR具有相似的功能[15-16]。共线性分析说明在葫芦科植物中,哈密瓜与西葫芦、笋瓜和南瓜在物种进化过程中更为接近,同源基因对倍增的时间大约发生在0.65~3.5百万年前。蛋白互作分析表明CmDHAR成员与其他哈密瓜GST成员之间联系紧密,说明CmDHAR在调节各类蛋白共同发挥作用方面发挥重要作用[23,41]。蛋白质三级结构预测结果表明CmDHAR2主要由α-螺旋、无规卷曲、延伸链和β-转角等结构构成。鉴定到的12个GSH结合位点位于蛋白质表面,这在结构上更有助于CmDHAR2与GSH的结合。冷胁迫下,耐冷型JS中的CmDHAR活力、AsA含量及CmDHAR基因表达量明显高于不耐冷型GE。GSEA功能富集分析显示CmDHAR通过参与一系列生物学过程响应冷胁迫,表明其在哈密瓜响应冷胁迫的机制中十分重要。未来将会对CmDHAR基因在冷胁迫过程中的具体代谢及调控机制做进一步研究。
