接种发酵对葡萄酵素多酚生物利用度及抗氧化活性的影响
2022-02-16丁玉峰马艳莉李素萍席晓丽孙剑锋刘亚琼牟建楼
丁玉峰,马艳莉,2,*,李素萍,席晓丽,孙剑锋,刘亚琼,牟建楼
(1.河北农业大学食品科技学院,河北 保定 071000;2.南阳理工学院 河南省张仲景方药与免疫调节重点实验室,河南 南阳 473000)
葡萄(Vitis viniferaL.)为葡萄科葡萄属木质藤本植物,是世界上栽培面积最大、产量第2的水果,广泛分布在温带至亚热带地区,遍及亚洲、欧洲和美洲,据国家统计局数据,2018年我国葡萄年产1 366.68万 t,因其较高的营养特性和附加值深受消费者欢迎。葡萄中含有丰富的营养成分,葡萄浆果中含约10%~30%的糖、维生素、类胡萝卜素、矿物质、钙、钾、磷、铁、维生素、氨基酸和多酚类化合物等。葡萄中的类胡萝卜素主要是β-胡萝卜素和叶黄素,类胡萝卜素是天然色素,负责葡萄的红色、橙色和黄色色调,多酚是植物的次生代谢产物,在果肉、果皮和种子中均有分布,对葡萄的颜色和味道发挥着重要作用,是潜在的抗氧化分子,能够清除自由基、调节各种信号通路[1]。葡萄除了丰富的营养特性,也因其口感酸甜、多汁和浓郁的风味受到消费者的青睐[2-3]。
葡萄酵素是以葡萄为原料,利用微生物发酵制得的具有营养和保健作用的产品。在微生物作用下,葡萄基质中的糖类、维生素和花色苷等营养成分转化成小分子活性物质。酚类化合物的转化也发生在食品发酵过程中,Morais等[4]研究乳酸菌对火龙果发酵过程中酚类物质的影响;Garbetta等[5]研究副干酪乳杆菌对朝鲜蓟多酚的影响;Khan等[6]研究植物乳杆菌和酿酒酵母共发酵对糙米发酵过程中酚类物质的影响。然而,目前市场上酵素产品多以自然发酵制得,存在菌株混杂不可靠的缺点,易产生食品安全风险大、产品指标稳定性差、发酵周期长等问题[7-8]。因此采用接种发酵的方式研究微生物对多酚的影响十分必要;在酶作用下,微生物能够释放与基质中其他成分相关的酚类化合物,如糖类,使生物活性更强的配位体形式可能从相应的糖苷中释放[9-10]。
酚类化合物的生物转化也发生在宿主体内,事实上多酚的健康效应在很大程度上取决于其在宿主中的生物利用度,这些化合物从食物基质中释放,并在胃肠道消化过程中被吸收;此外,当部分多酚类物质在小肠中吸收不良时,会以不变的形式到达大肠,在大肠中多酚会被肠道微生物转化形成更活跃、更易吸收的代谢物,其结构不同于母体化合物[11-13],因此,这种情况下富含多酚食物的有益作用归因于微生物衍生的酚类代谢物,而不是母体酚类物质的作用。
本实验评估接种发酵对葡萄酵素发酵过程中发酵特性、总酚和总黄酮含量的影响,并对其酚类物质进行鉴定;利用体外消化模型对酚类物质的生物利用度进行研究;评估葡萄酵素发酵过程及肠道代谢物的抗氧化活性,旨在探讨接种发酵对多酚的释放及抗氧化能力的影响,为开发功能型葡萄酵素提供理论支持。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌种
夏黑葡萄购自河南省南阳市某大型超市,产地河南省南阳市社旗县。
酿酒酵母31145由河南省工业微生物菌种保藏中心提供;巴氏醋杆菌CGMCC 1.41、植物乳杆菌ACCC 11095由北京生物保藏中心提供。
红糖 市售;1,1-二苯基-2-三硝基苯肼自由基(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2′-联氮-双(3-乙基苯并噻唑啉-6-磺酸)(2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)、福林-酚、没食子酸(均为分析纯) 上海麦克林生化科技有限公司;二氢杨梅素、杨梅素、槲皮素、山柰酚、柚皮素、花旗松素、圣草酚、芹菜素、香橙素、木犀草素、没食子酸、儿茶素、香草酸、阿魏酸、苯甲酸、水杨酸(色谱纯,纯度≥98%) 美国Sigma公司;猪胆盐、胃蛋白酶(3 000 U/g)、胰酶(250 U/mg)、α-淀粉酶(4 000 U/g) 北京索莱宝科技有限公司。
1.1.2 菌种培养基
乳酸菌通用培养基(MRS):蛋白胨1%(质量分数,下同)、牛肉浸膏0.5%、葡萄糖2%、酵母浸粉0.4%、乙酸钠0.5%、磷酸氢二钾0.2%、硫酸镁0.02%、柠檬酸三胺0.2%、硫酸锰0.005%、吐温80 0.1%(固体培养基在此基础上加入1.5%~2%的琼脂粉),于121 ℃高压蒸汽灭菌锅中灭菌20 min。
酵母浸出粉胨葡萄糖培养基(YPD):酵母浸膏1%、蛋白胨2%、葡萄糖2%(固体培养基在此基础上加入1.5%~2%的琼脂粉),于121 ℃高压蒸汽灭菌锅中灭菌20 min。
许氏醋酸菌种子培养基:1%葡萄糖、1%酵母膏,121 ℃灭菌20 min,使用前按体积分数3%加入无水乙醇。
1.2 仪器与设备
Neofuge 15R高速冷冻离心机 上海力申科学仪器有限公司;SPX生化培养箱 宁波东南仪器有限公司;UV752N紫外-可见分光光度计 上海精密科学仪器有限公司;QL-861涡旋机 海门市其林贝尔仪器制造有限公司;1260高效液相色谱-7890气相色谱仪 美国安捷伦科技有限公司。
1.3 方法
1.3.1 葡萄酵素的制备
取20 μL保藏在甘油管中的不同菌株,在相应的固体培养基上活化,待平板上长出单菌落,挑取一环于相应的液体培养基中。乳酸菌培养温度37 ℃,摇床转速200 r/min,培养36~72 h;酵母菌培养温度30 ℃,摇床转速200 r/min,培养24 h;醋酸菌培养温度30 ℃,摇床转速200 r/min,培养72 h。
挑选完好无破损的葡萄洗净、晾干、打浆过滤,用红糖调整糖度为18 °Brix,加入75 mg/mL的果胶酶酶解40 min后进行灭菌(60 ℃灭菌30 min),冷却,接入体积分数5%的酵母菌,发酵6 d,于第6天接入5%的醋酸菌继续发酵21 d,过滤除菌,于第27天接入体积分数3%的乳酸菌,继续发酵14 d,共发酵41 d,每隔一定时间取样[14-15]。样品按发酵时间进行编号(如D34表示发酵第34天样品);编号XH表示模拟胃肠道消化后的样品。
1.3.2 发酵特性的测定
还原糖含量的测定采用3,5-二硝基水杨酸法[16],利用酸度计测定发酵过程中样品的pH值,总酸含量的测定参照GB/T 12456—2008《食品中总酸的测定》,结果以乳酸质量浓度计。乙醇体积分数的测定采用陈学泽[17]的方法并稍作改动,气相色谱检测条件:VF-WAXms色谱柱(30 m×0.25 mm,0.25 μm);程序升温:60 ℃保持2 min,以5 ℃/min升至70 ℃,保持6 min,以5 ℃/min升至100 ℃;进样口温度200 ℃;氢火焰离子化检测器温度220 ℃;分流比5∶1,氢气流速40 mL/min,空气流速400 mL/min,载气(N2)流速30 mL/min,进样量1 μL。
1.3.3 活菌数的测定
发酵过程中乳酸菌活细胞数采用平板计数的方法,参照GB 4789.35—2016《食品微生物学检验 乳酸菌检验》操作。
1.3.4 总酚和总黄酮含量的测定
总酚含量:测定采用福林-酚法[18],取0.1 mL稀释到合适倍数的发酵上清液,加入6 mL蒸馏水,再加入0.5 mL福林-酚,充分混匀,快速加入1.5 mL 7.5 g/100 mL Na2CO3溶液,混合后用蒸馏水定容。将溶液在20 ℃放置2 h,然后采用紫外-可见分光光度计在765 nm波长处测定各溶液的吸光度。以没食子酸溶液质量浓度为横坐标,吸光度为纵坐标,绘制标准曲线,得到标准曲线方程为y=0.001 0x+0.005 4(R2=0.999 2)。
总黄酮含量的测定采用NaNO2-Al(NO3)3比色法[19],取发酵液上清液1 mL加入10 mL容量瓶中,加入0.5 mL 5 g/100 mL NaNO2溶液,混匀,室温下静置6 min,然后加入0.5 mL 10% Al(NO3)3溶液,充分混合并在室温下保持6 min。然后,加入4 mL 4 g/100 mL NaOH溶液,混合放置15 min,最后蒸馏水定容。采用紫外-可见分光光度计在510 nm波长处测定溶液吸光度,以芦丁溶液质量浓度为横坐标,以吸光度为纵坐标,绘制标准曲线,得到标准曲线方程为y=0.001 0x+0.005 4(R2=0.999 3)。
1.3.5β-葡萄糖苷酶活力的测定
取0.1 mL发酵液与0.2 mL 35 mmol/L对硝基苯-β-D-吡喃半乳糖苷(p-nitrophenyl-β-D-galactopyranoside,p-NPG)溶液(由pH 5.0的柠檬酸-磷酸盐缓冲液配制),混匀,50 ℃保温10 min,加入2 mL 1 mol/L Na2CO3溶液终止反应并显色,于400 nm波长处测定吸光度。以添加等量加热失活的酶液作为空白。酶活力单位(U)定义为pH 5.0、50 ℃反应条件下,1 min水解p-NPG产生1 μmol 对硝基苯酚所需要的酶量[20]。
1.3.6 葡萄酵素中酚酸含量的测定
取20 mL发酵上清液与20 mL乙酸乙酯混匀,萃取3 次,回收上清液,将回收液置于50 ℃旋转蒸发仪上去除有机溶剂,将蒸干后的固体复溶于4 mL甲醇中,过0.45 μm滤膜,于-20 ℃保存待测[21]。高效液相色谱检测条件:色谱柱Eclipse XDB-C18柱(4.6 mm×250 mm,5 μm);流动相A体积分数2%的乙酸溶液,流动相B乙腈;流速1 mL/min;柱温30 ℃;进样量10 μL;检测波长280 nm。
1.3.7 葡萄酵素中类黄酮含量的测定
采用Padilha等[22]的方法,取发酵上清液5 mL,称质量,冷冻干燥浓缩,将浓缩后的物质复溶于1 mL甲醇中,过0.45 μm滤膜,待测。
高效液相色谱检测条件:色谱柱ZORBAX-SB C18柱(4.6 mm×250 mm,5 μm);流动相:体积分数0.1%甲酸溶液-甲醇(1∶1,V/V);流速1 mL/min;柱温25 ℃;进样量10 μL;检测波长320 nm。
1.3.8 体外模拟消化分析葡萄酵素酚类物质的生物利用度
采用体外唾液和胃肠消化法评价葡萄酵素酚类物质的生物利用度。体外模拟消化过程参照Gawlik-Dziki等[23]的方法,5 mL发酵上清液与15 mL的唾液淀粉酶溶液(0.2 U/mL)混合,置于缓冲溶液(含2.38 g/L Na2HPO4、0.19 g/L KH2PO4、8 g/L NaCl,pH 6.75)中。混合溶液置于37 ℃水浴中振荡10 min,随后用5 mol/L HCl溶液调整pH值至1.2,然后在pH 1.2 0.03 mol/L NaCl溶液中加入15 mL模拟胃液(含0.32%胃蛋白酶),37 ℃振荡孵育120 min后,加入0.1 mol/L NaHCO3溶液调整pH值至6,停止胃消化。随后加入15 mL肠消化液(含0.05 g胰酶、0.3 g胆汁提取物、0.1mol/L NaHCO3)、2.5 mL 0.12 mol/L NaCl溶液和2.5 mL 5 mmol/L KCl溶液。将混合溶液在37 ℃摇动60 min,最后得到的混合溶液在4 ℃、5 000×g离心10 min,收集上清液用于测定酚类物质生物有效性。多酚生物利用度表示为消化后与消化前样品中酚类物质含量的比值。
1.3.9 抗氧化能力的测定
称取12.5 mg DPPH溶解于甲醇中,定容到100 mL,使用时再稀释5 倍,现配现用,取0.1 mL稀释到合适倍数的发酵上清液加入3.9 mL DPPH-甲醇溶液中,避光反应20 min,在517 nm波长处测定吸光度[24]。以Trolox浓度为横坐标,以吸光度为纵坐标,绘制标准曲线,得到标准曲线方程为y=-0.000 5x-0.003 6(R2=0.999 5)。根据标准曲线方程,计算得出样品的Trolox当量抗氧化能力(trolox equivalent antioxidant capacity,TEAC)值。DPPH自由基清除能力以TEAC值表示,单位μmol/L。
取5 mL 7 mmol/L ABTS溶液,加入88 μL 140 mmol/L过硫酸钾-水溶液,配制ABTS工作液,静置避光反应24 h,使用前用无水乙醇稀释到A734nm为(0.70±0.02)。取0.1 mL稀释到合适倍数的发酵上清液加入3.9 mL ABTS工作液,避光反应8 min,在734 nm波长处测定吸光度[20]。以Trolox浓度为横坐标,吸光度为纵坐标,绘制标准曲线,得到回归方程为y=-0.000 7x+0.009 0(R2=0.999 9)。根据标准曲线方程,计算得出样品TEAC值。ABTS阳离子自由基清除能力以TEAC值表示,单位μmol/L。
1.4 数据统计分析
2 结果与分析
2.1 葡萄酵素发酵过程中的发酵特性
由图1A可知,接种酵母菌后,酵母菌利用葡萄糖生成乙醇,发酵0~6 d,还原糖质量浓度由31.91 g/L下降到0.46 g/L,乙醇体积分数由0%迅速增加至7.66%。接种醋酸菌后,醋酸菌利用乙醇生成乙酸,乙醇体积分数由7.66%下降至发酵27 d的0.47%,在之后的发酵过程中乙醇体积分数和还原糖质量浓度基本保持不变,无显著差异。由图1B可知,葡萄酵素发酵过程中发酵液pH值呈下降趋势,总酸质量浓度呈升高趋势。在发酵前6 d,pH值由3.77下降至3.67,总酸质量浓度由4.16 g/L升高至6.31 g/L,接种醋酸菌后,发酵6~20 d,pH值和总酸质量浓度变化不明显,主要是由于醋酸菌启动比较缓慢,在发酵20~27 d,醋酸菌利用乙醇分解成乙酸,pH值迅速降低为3.12,总酸质量浓度达到最高值,为19.33 g/L,接种乳酸菌后pH值保持在3.19左右,总酸保持在19.09 g/L左右,变化差异不显著。陈小伟等[25]研究草莓酵素自然发酵过程中总糖、总酸含量和pH值的变化表明,发酵初期酵母菌等微生物大量繁殖,糖类物质用于微生物的增殖和合成代谢,总糖含量显著下降,与此同时大量的次级代谢产物(乳酸和醋酸等有机酸)生成,总酸含量显著增加,随后pH值较大程度影响益生菌的繁殖以及代谢,总酸含量有轻微下降趋势,总糖耗尽,含量接近0.40 g/mL,发酵后期微生物代谢缓慢,溶液pH值变化不显著,以上结果与本研究中观察的现象基本一致。

图1 葡萄酵素发酵过程中还原糖含量、乙醇体积分数(A)、pH值和总酸含量(B)的变化Fig. 1 Changes in reducing sugar and ethanol contents (A), pH and total acid content (B) during the fermentation of grape jiaosu
2.2 葡萄酵素发酵过程及体外模拟胃肠道消化后乳酸菌活菌数的变化
乳酸菌因其对维持人体肠道菌群平衡、提高免疫力具有重要作用而被广泛研究,此外,作为酵素产品的优势种群,其对最终产品的品质也发挥重要作用。因此,本研究对葡萄酵素发酵过程中乳酸菌活菌数的动态变化进行研究。如图2所示,初始乳酸菌数(D0)为8.27(lg(CFU/mL)),接入乳酸菌后7 d(即发酵34 d),乳酸菌总数下降至6.85(lg(CFU/mL)),这主要是因为发酵液经醋酸菌发酵后,pH值较低为3.12,低pH值的环境对乳酸菌生长有一定影响,待发酵结束后(D41),乳酸菌总数达到7.53(lg(CFU/mL)),该结果与发酵液中pH值和总酸含量的变化都体现出乳酸菌的代谢活性。益生菌在通过胃肠道直至结肠的消化过程中能够保持一定的存活能力,在本研究中,经过体外消化后,乳酸菌活菌数为6.27(lg(CFU/mL)),较发酵液显著降低(P<0.05),主要是由于胃肠道消化液pH值较低,乳酸菌受到外界环境胁迫细胞失活,尤其是由胃液到肠液的pH值变化,这与Valero-Cases等[26]报道的益生菌发酵石榴汁经体外消化后的活菌数变化相似。

图2 葡萄酵素发酵过程及体外模拟胃肠道消化后乳酸菌活菌数的变化Fig. 2 Changes in viable bacterial count of grape jiaosu during fermentation and after in vitro simulated gastrointestinal digestion
2.3 葡萄酵素发酵过程及体外模拟胃肠道消化后总酚和总黄酮含量的变化
由图3可知,葡萄酵素发酵过程中总酚、总黄酮质量浓度呈波动上升变化,发酵结束后较未发酵时分别增加1.16 倍和0.83 倍。在酵母菌发酵(0~6 d)期间,总酚质量浓度呈上升趋势;接种醋酸菌(第6天)后总酚质量浓度先降低后升高,这主要是由于pH值及微生物产生的酶系作用;接种乳酸菌发酵过程(27~41 d)中,总酚质量浓度呈现先下降后上升的趋势,但发酵结束后总酚质量浓度达到最高,显著高于其他样品(P<0.05),这表明微生物的相互作用会促进酚类物质的生成。发酵过程中总黄酮质量浓度呈波动上升的趋势,发酵前20 d,总黄酮质量浓度在129.18~137.97 mg/L之间,无显著差异(P>0.05),当醋酸菌发酵结束后,第27天时总黄酮质量浓度显著升高至147.36 mg/L,接种乳酸菌发酵后,总黄酮质量浓度先略降低,后大幅升高至251.91 mg/L。经过体外模拟消化后总酚和总黄酮含量均显著下降(P<0.05),这与Bao Tao等[27]的研究结果一致。体外模拟消化后总酚含量的下降可能与消化液pH值的变化有关,特别是从胃液pH 1.2到肠液pH 7.4的变化会导致酚类物质结构的变化。
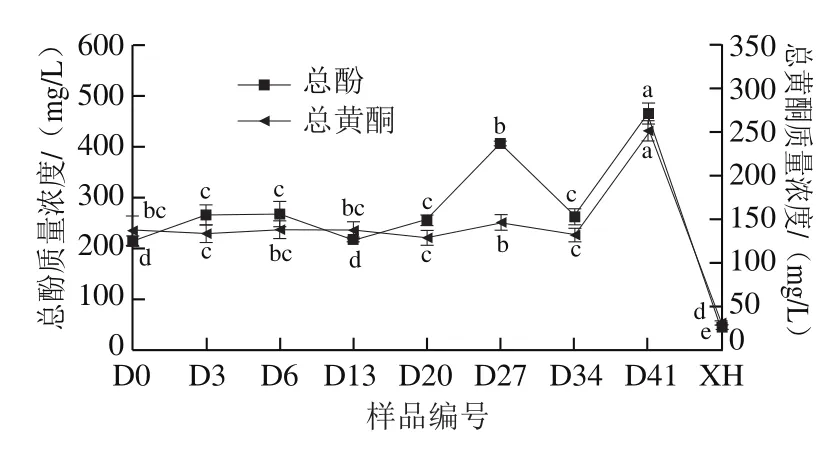
图3 葡萄酵素发酵过程及体外模拟胃肠道消化后总酚及总黄酮含量的变化Fig. 3 Changes in total phenol and flavonoid contents of grape jiaosu during fermentation and after in vitro simulated gastrointestinal digestion
2.4 葡萄酵素发酵过程中及体外模拟胃肠道消化后β-葡萄糖苷酶活力的变化
植物中的酚类物质通常与细胞壁中的纤维素、木质素、蛋白质、有机酸结合形成共价化合物[28],而微生物发酵产生的酶系可以破坏细胞壁纤维成分的致密结构或者破坏多酚物质与其他物质之间交联的共价键,从而促进酚类物质的释放和转化,β-葡萄糖苷酶被认为是裂解交联键的一类重要的酶。为阐明葡萄酵素发酵过程中酚类物质含量与β-葡萄糖苷酶活力的关系,对发酵过程中β-葡萄糖苷酶活力进行测定,结果如图4所示。葡萄酵素发酵过程中β-葡萄糖苷酶活力的变化趋势与总酚含量的变化趋势基本保持一致,发酵0~6 d逐渐升高,接种醋酸菌(第6天)后呈先下降后上升的趋势,接种乳酸菌发酵14 d(即发酵27~41 d)达到最大值,为266.57 μU/mL,这也进一步说明酚类物质含量的变化与微生物发酵过程中产生的水解酶系有关。阎欲晓等[29]研究黑曲霉发酵甘蔗叶中酚类物质与β-葡萄糖苷酶活力的变化,表明酚类物质的释放与β-葡萄糖苷酶活力存在显著相关性。
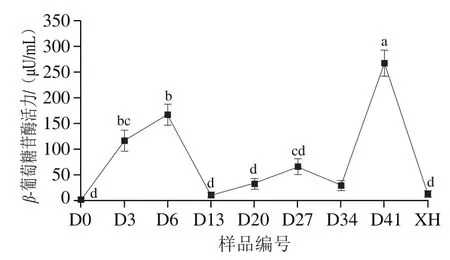
图4 葡萄酵素发酵过程及体外模拟胃肠道消化后β-葡萄糖苷酶活力的变化Fig. 4 Changes in β-glucosidase activity of grape jiaosu during fermentation and after in vitro simulated gastrointestinal digestion
2.5 葡萄酵素发酵过程及体外模拟胃肠道消化后酚类化合物含量的变化
为进一步考察葡萄酵素发酵过程中不同酚类组分的变化,对发酵过程中酚酸和类黄酮进行跟踪监测,图5为10 种类黄酮和7 种酚酸物质标准品的高效液相色谱图。在未发酵的葡萄汁(D0样品)中检测到6 种酚酸,分别为没食子酸、儿茶素、香草酸、阿魏酸、苯甲酸和水杨酸,发酵结束后,样品中各酚酸含量均显著升高(P<0.05),没食子酸、香草酸和儿茶素含量较未发酵葡萄汁分别增加了6.17、4.18 倍和1.65 倍。发酵过程及体外消化后样品中总酚酸质量浓度为21.80~95.82 mg/L。在发酵过程中,没食子酸、香草酸、阿魏酸、苯甲酸这4 种酚酸的含量均随着发酵时间的延长呈波动上升的趋势,并于发酵第41天达到最高值,这可能是由于微生物产生的酶系作用导致细胞壁结构降解,使酚酸类物质从细胞壁上解离释放。而儿茶素和水杨酸含量在发酵过程中呈现先升高后降低的趋势;发酵第3天,儿茶素含量较未发酵的葡萄汁(D0样品)增加了约11.36 倍,占此时总酚酸含量的68.07%;发酵第13天,水杨酸含量较D0样品增加了约13.04 倍,这也是导致此时总酚酸含量显著高于其他样品的原因(P<0.05)。随着发酵的进行,儿茶素和水杨酸含量呈现不同程度的降低,这可能是由于某些酚类化合物可以作为微生物代谢的底物。Campanella等[30]报道葡萄渣经植物乳杆菌12A、PU1,副干酪乳杆菌14A和短双歧杆菌15A发酵后,酚类化合物含量下降。
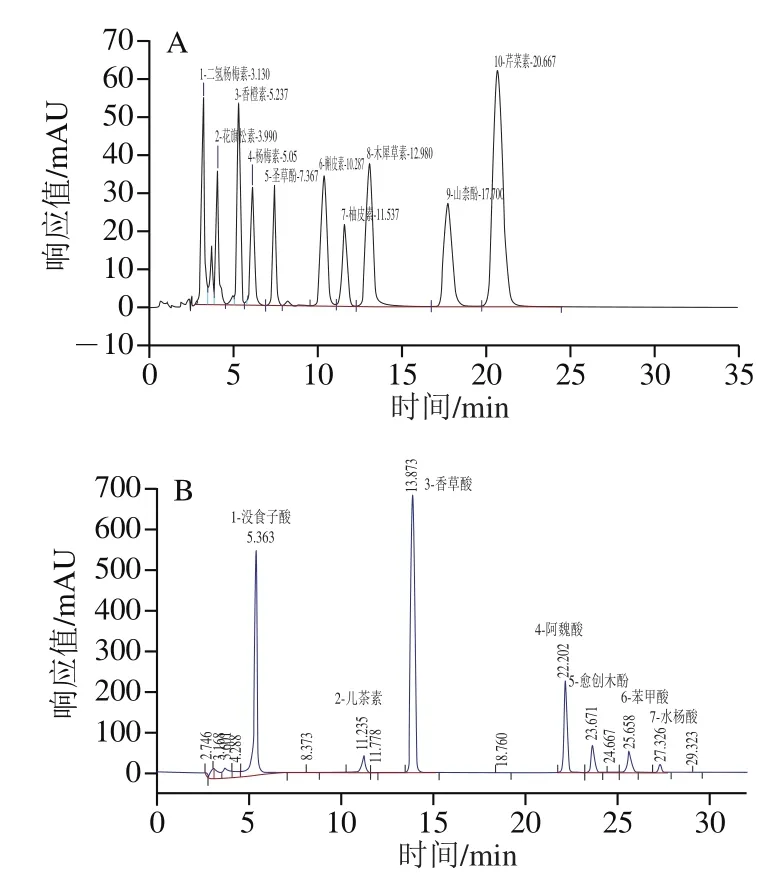
图5 10 种类黄酮(A)和7 种酚酸物质(B)标准品的高效液相色谱图Fig. 5 High performance liquid chromatograms of mixed standard of ten flavonoids (A) and mixed standard of seven monophenols (B)
本研究鉴定出5 种类黄酮,总类黄酮质量浓度为0.68~3.96 mg/L,其中D0样品中仅检测到杨梅素(0.68 mg/L)。杨梅素存在于所有发酵样品中,是主要的类黄酮,发酵结束时占总类黄酮含量的45.35%;随着发酵时间的延长,杨梅素含量呈先升高后降低的趋势,并于发酵第6天时达到最大值,为2.46 mg/L。槲皮素在发酵前3 d未检测到,在第6天时检测到质量浓度为1.14 mg/L,之后槲皮素含量呈上升趋势,第27天时上升至1.92 mg/L,随后逐渐下降。柚皮素仅在发酵第3天时检测到,木犀草素在发酵完成(第41天)后检测到,且均以微量存在。山柰酚在D0样品中未检出,但是在接种酵母菌期间,含量增加,但接种醋酸菌后含量逐渐降低直至发酵结束后检测不出。
总的来说,发酵过程中酚类的变化可能是由于菌株中特定酶的作用,它们能够分解植物细胞壁中的化学成分,水解酯键从而释放酚类化合物[31-32]。而葡萄糖苷酶水解酚类化合物结构中糖苷键则是酚类化合物释放过程中的第1步,这种酶活性可以解释葡萄酵素发酵过程中酚类组分含量的上升。而随着发酵的进行酚类物质含量的下降,这归因于pH值不断降低以及酚类组分作为发酵微生物的代谢底物被消耗[33]。
2.6 葡萄酵素酚类物质的生物有效性
酚类物质通过消化液中的酶作用从食物基质中释放,被认为具有生物有效性。如表1所示,经过体外模拟消化后,除水杨酸其他5 种酚酸均具有生物有效性,生物利用度为39.11%~57.77%。对于类黄酮,仅杨梅素和槲皮素具有较好的生物有效性,生物利用度分别为35.78%和42.34%。多酚的生物利用度是高度可变的,主要取决于其结构和共轭形式,因此多酚的生物利用度会受到植物组织内含量差异、细胞壁结构的变化、细胞中糖苷位置及酚类化合物在食品基质中的结合因素等的影响。本实验结果与Gowd等[34]报道的杨梅多酚的生物利用度结果相似。酚类化合物的吸收取决于其物理化学特性,大部分酚类化合物属于单体,而一些酚类化合物单体和二聚体能够直接被小肠吸收,因此大部分酚酸具有生物有效性[35]。葡萄经过微生物发酵,其抗氧化能力虽然低于葡萄汁,但是部分酚类物质含量增加。葡萄酵素酚类物质发挥其生物有效性,一方面,摄入的多酚经过结肠微生物群代谢,多酚复杂结构中的低分子质量部分被破坏、吸收并作用于靶器官发挥生物活性功能[36-37];另一方面,未被吸收的酚类化合物也可能被微生物转化为更有活性的形式[38]。本研究在XH样品中检测到大量乳酸菌,当酚类物质到达结肠,其被微生物酯酶水解,发生转化,可能对肠道细菌产生正向调节[39]。一项关于富含酚类物质的苹果皮的研究表明,在苹果皮多酚作用下乳酸菌菌株的黏附性增强,表明这些化合物可能促进了有益微生物或原生肠道微生物群的黏附[40]。

表1 葡萄酵素发酵过程及体外模拟胃肠道消化后酚类物质组成及含量的变化Table 1 Changes in phenol composition of grape jiaosu during fermentation and after in vitro simulated gastrointestinal digestion
2.7 葡萄酵素发酵过程及体外模拟胃肠道消化后抗氧化活性的变化
为进一步考察葡萄酵素发酵过程中抗氧化能力的变化,对DPPH自由基、ABTS阳离子自由基清除能力进行表征。如图6所示,DPPH自由基、ABTS阳离子自由基清除能力的TEAC值在未发酵葡萄汁(D0样品)中分别为364.13、887.14 μmol/L,发酵13 d均达到最高,分别为566.80、2 374.29 μmol/L,发酵27 d又逐渐分别下降至437.47、1 155.71 μmol/L,接种乳酸菌发酵期间(27~34 d),自由基清除能力与第27天时相比无显著差异,发酵41 d分别上升至551.47、1 616.67 μmol/L,经体外模拟胃肠道消化后,DPPH自由基、ABTS阳离子自由基清除能力的TEAC值分别为184.80、583.33 μmol/L。总的来说,发酵结束后葡萄酵素的DPPH自由基、ABTS阳离子自由基清除能力相比未发酵葡萄汁分别提高了51.45%、82.23%,但是经体外模拟消化后,由于酚类物质含量降低,抗氧化活性也发生了不同程度的降低。
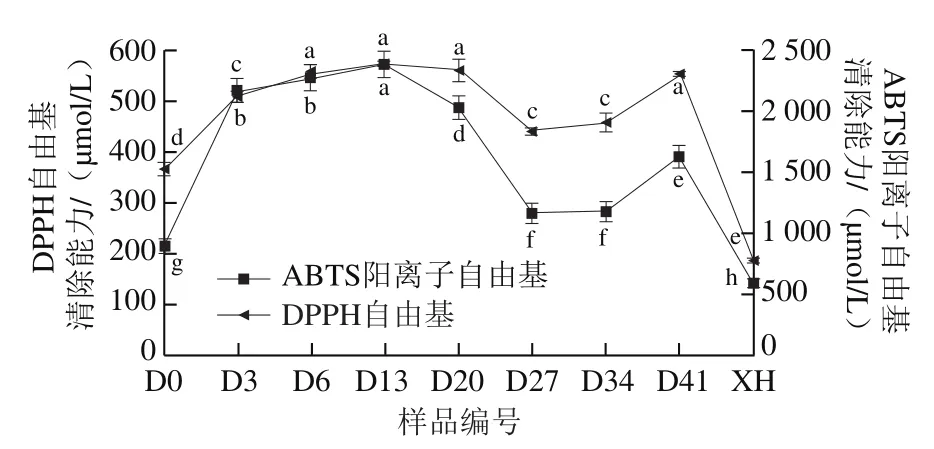
图6 葡萄酵素发酵过程及体外模拟胃肠道消化后DPPH自由基、ABTS阳离子自由基清除能力的变化Fig. 6 Changes in DPPH and ABTS cation radical scavenging capacity of grape jiaosu during fermentation and after in vitro simulated gastrointestinal digestion
虽然发酵过程中,第13天时总酚含量低于第41天,但是抗氧化能力却高于第41天,这主要是因为酚类物质的抗氧化能力取决于酚类化合物的化学结构、芳香环的羟基数目、羟基位置以及羟基结构糖基化,由细菌发酵引起的酚类化合物结构变化可能与观察到的抗氧化活性增强有关[41]。与本结果一致,一些研究结果也表明,细菌发酵后酚类物质含量的降低和抗氧化活性的提高之间成反比[42-43]。
3 结 论
酵母菌、醋酸菌、乳酸菌依次接种发酵提高了发酵液中总酚和总黄酮含量,发酵过程中β-葡萄糖苷酶活力与总酚含量的变化趋势基本一致,实验乳酸菌能在葡萄酵素及体外模拟消化环境中存活;与未发酵的葡萄汁相比,接种发酵显著增加了没食子酸、儿茶素、香草酸、阿魏酸、苯甲酸和水杨酸6 种酚酸的含量,其中没食子酸、香草酸含量较葡萄汁增加了6.17 倍和4.18 倍;接种发酵促进了一些类黄酮物质的水解,杨梅素和槲皮素的含量相比未接种时显著提高;体外模拟消化实验表明除水杨酸,其余5 种酚酸均具有生物有效性,对于类黄酮,杨梅素和槲皮素具有较好的生物有效性;接种发酵提高了葡萄酵素的抗氧化能力。这些研究结果表明,接种发酵不仅可以潜在地提高葡萄酵素多酚物质的含量,还可以作为提高抗氧化活性的加工方法,这为开发功能型葡萄酵素产品奠定了基础。
